TIP30基因敲除小鼠EGFR下游信号通路活性
2015-10-21陈逢生1陈晓华2李爱民1周瑾1罗荣城1
陈逢生1 陈晓华2 李爱民1 周瑾1 罗荣城1★
·论著·
TIP30基因敲除小鼠EGFR下游信号通路活性
陈逢生1 陈晓华2 李爱民1 周瑾1 罗荣城1★
目的探讨TIP30基因敲除后是否影响小鼠EGFR下游信号通路的活性。方法获取野生型及TIP30基因敲除的BALB/c小鼠乳腺组织及乳腺癌组织,用免疫组化检测EGFR下游信号通路相关分子pAKT及pErk1/2的表达。结果Tip30-/-小鼠乳腺上皮细胞pErk1/2及pAkt阳性率分别为(27.83±8.46)%和(30.83±6.65)%(n=4),显著高于Tip30+/+小鼠乳腺上皮细胞的(12.58±5.87)%和(14.94±5.77)%(n=4),P值分别0.02和0.011。而Tip30-/-小鼠乳腺肿瘤细胞pErk1/2及pAkt阳性率分别为(51.68±8.57)%和(56.08±8.44)%(n=4),则显著高于Tip30-/-小鼠乳腺上皮细胞阳性率,P分别为0.002和0.001。结论TIP30基因缺失可能通过使EGFR下游ERK/MAPK及PI3K/AKT信号通路的活化,从而导致TIP30基因缺失小鼠发生乳腺癌。
TIP30;表皮生长因子受体;乳腺癌
TIP30基因,又称CC3或Htatip2,是1998年肖华等在研究人类免疫缺陷病毒(human immunodeficiency virus,HIV)的体外转录时发现一种分子量为30 kD的Tat(transactivator of transcription)结合蛋白(tat interactive protein)[1]。研究发现TIP30在多种肿瘤组织中表达异常,如肺癌、乳腺癌、胃癌、结肠癌、肝细胞癌和前列腺癌等[2-7],提示TIP30与肿瘤之间存在密切联系。Hua等研究发现,TIP30基因敲除小鼠可以自发形成多种肿瘤[7-8]。这些研究提示TIP30是一种肿瘤抑制基因。TIP30具有多种功能,可以作为一种转录共分子参与凋亡及增殖相关基因的调控[9-10],它还可以作为细胞核转运抑制因子调节细胞凋亡[11]。近年已有研究发现,在肝癌和肺癌中,TIP30可以调控EGFR下游信号通路的活性[12-13]。我们先前的研究发现,在BALB/c背景的小鼠中敲除TIP30能诱发小鼠乳腺癌发生[14]。然而在该模型的乳腺及乳腺癌组织中,TIP30是否具有调控EGFR下游信号通路的作用仍未明确。为了进一步研究其可能的机制,我们对该小鼠模型EGFR下游信号分子进行了初步的探讨。
1 材料与方法
1.1实验动物的饲养
通过杂交的方法,获得Tip30基因敲除的BALB/c小鼠,连续传代7代以上,获得纯合背景的Tip30-/-BALB/c小鼠。Tip30基因敲除的BALB/c小鼠均由美国密西根州立大学肖华实验室赠送。共47只雌性小鼠均在南方医科大学动物中心SPF级层流柜内分笼饲养。
1.2实验动物的处死和标本处理
所有小鼠均为同系来源,共有47只雌性未孕小鼠完成18个月的实验观察并进入实验统计,其中Tip30+/+BALB/c小鼠19只和Tip30-/-BALB/c小鼠28只。所有小鼠均以二氧化碳吸入处死,并详细检查小鼠乳腺及其它器官肿瘤发生情况。用4%多聚甲醛固定全部小鼠乳腺及肿瘤组织,组织在4℃下过夜,然后用30%、50%、70%梯度酒精对组织脱水各30 min,滴加二甲苯3次,使其脱脂及透明,然后用石蜡包埋。部分组织立即置于液氮中冻存,最后放入-80℃冰箱中保存。
1.3石蜡切片免疫组织化学(immunohistochemistry paraffin chemical,IHC)检测
将3~5 μm石蜡切片置于二甲苯中浸泡10 min,更换二甲苯后再浸泡10 min;然后于100%、90%、80%、70%梯度酒精水化各浸泡2 min;去离子双蒸水洗2次。
1.3.2抗原修复
应用高压热修复法。首先配置存储溶液A: 0.1 mol/L Citrate Acid,溶液B:0.1 mol/L Sodium Citrate.于4℃长期保存。工作液配置:9 mL溶液A+41 mL溶液B+450 mL dH2O,调整PH为6.0。然后将脱蜡水化后的玻片置于装有工作液的烧杯中,高压锅内高压20 min,121℃,压力15psi。然后于室温内放置30 min待其冷却。
1.3.3免疫组织化学染色
将组织切片脱蜡水化后,置入3%H2O2溶液室温孵育10 min,以消除内源性过氧化物酶的活性,降低染色背景。应用PBST浸洗组织切片3次,各5 min。然后用5%BSA-PBST封闭液(150 μL/片)封闭组织1 h。同时准备一抗,根据各抗体稀释需要,应用5%BSA-PBST稀释配置抗体,兔抗小鼠pAkt单克隆抗体(Cell Signaling)和兔抗小鼠pErk1/2单克隆抗体(Cell Signaling)均按1∶100稀释。吸除切片上的封闭液,加入事先配好的一抗(150 μL/片),随后将切片置于湿盒内,4℃孵育过夜。第二天应用PBST浸洗切片3次,每次5 min。根据一抗种属选择并滴加适当比例稀释的生物素结合的二抗(用1%BSA-PBST稀释液按1∶200稀释),于室温孵育30 min。同时配好ABC(美国Vector Laboratories公司)工作液(用PBST按1∶100稀释,并混合均匀),于室温放置30 min。室温孵育完成后,用PBST浸洗切片3次,每次5 min。切片滴加ABC液150 μL/片,室温孵育30 min后,用PBST浸洗3次,每次5 min。随后用新鲜配制的0.5 mg/mL的DAB显色液显色,显微镜下观察显色情况,决定显色时间,显色完成后蒸馏水终止显色反应。应用苏木精复染细胞核1.5 min,双蒸水冲洗15 min。应用90%酒精、100%酒精脱水各2次,每次10s,二甲苯透明2次,每次10 s。最后用永久封片液封片,并将切片置于显微镜下观察。
1.3.4乳腺组织及肿瘤组织中pAkt、pErk1/2细胞计数方法
将每个切片置于光学显微镜(Olympus公司)5个高倍视野(10×40倍)下进行观察,胞浆、胞核染色为棕黄或棕褐色为阳性细胞。分别统计乳腺组织中、肿瘤组织中阳性细胞数百分比,取平均值。
1.4统计分析
其中两电平VSC的接地需求包括2个方面:(1)交流侧滤波器的接地需求;(2)直流侧电容的接地需求。由于VSC电平数少,采用高频脉宽调试方式,开关频率高,换流器出口将含有较大的高次谐波,需在变压器阀侧加装较小容量的高频谐波滤波器。VSC在直流线路上有集中电容,可采取电容中点直接接地或通过组件接地的方式,如图1所示。
采用SPSS 13.0统计软件进行分析。实验结果以表示,均数比较采用单因素方差分析,多重比较采用LSD检验,P<0.05视为差异有统计学意义。
2 结果
我们前期研究发现,28只Tip30-/-小鼠中有8只发现乳腺自发肿瘤(发病率28.6%),而19只Tip30+/+小鼠中均未发现有乳腺自发肿瘤(0%);对TIP30基因敲除小鼠形成的乳腺癌组织进行H&E染色发现[14],该模型乳腺癌组织为中分化浸润性导管癌,癌组织存在非典型上皮细胞组成的腺样、管状、巢状和微乳头结构。为了进一步探讨小鼠TIP30基因敲除后形成的乳腺癌组织EGFR下游信号通路可能的变化,我们对PI3K及MAPK相关信号通路进行了研究,结果如下:
2.1TIP30基因敲除可致小鼠乳腺及肿瘤EGFR下游PI3K信号通路的活化
为了检测TIP30基因敲除对EGFR下游PI3K信号通路的影响,我们应用免疫组化检测小鼠乳腺及肿瘤组织的pAKT活化情况。检测结果如图1和表1示,应用方差分析法,Tip30-/-小鼠乳腺组织中pAKT阳性细胞百分率为(30.83±6.65)%(n=4),显著性高于Tip30+/+小鼠乳腺上皮细胞的pAkt阳性率(14.94±5.77)%(n=4),P=0.011;而Tip30-/-小鼠乳腺肿瘤组织pAkt阳性率(56.08±8.44)%(n=4)则显著性高于Tip30-/-小鼠乳腺组织,P=0.001。
2.2TIP30基因敲除可致小鼠乳腺及肿瘤EGFR下游MAPK信号通路的活化
为了进一步检测TIP30基因敲除后对小鼠乳腺及肿瘤组织EGFR下游MAPK通路的影响,我们同样应用了免疫组化对小鼠乳腺及肿瘤组织进行检测。见图1和表1,Tip30+/+小鼠乳腺组织pErk1/2阳性细胞百分率为(12.58±5.87)%(n=4),显著性低于Tip30-/-小鼠乳腺上皮细胞(27.83±8.46)%(n=4),P=0.021;而Tip30-/-小鼠乳腺肿瘤细胞pErk1/2阳性率为(51.68±8.57)%(n=4),显著高于Tip30-/-小鼠乳腺组织,P=0.002。
3 讨论
TIP30基因作为一种肿瘤抑制基因,在多种肿瘤的发生发展中起了重要的作用[2-7]。研究发现多种肿瘤组织中TIP30表达异常,而且TIP30基因敲除小鼠可以形成多种肿瘤[7-8]。近来研究还发现,在肝癌和肺癌中,TIP30可以调控EGFR细胞浆内转运和下游信号通路的活性[12]。我们的前期研究发现TIP30基因敲除的BALB/c小鼠中,28%的小鼠能自发形成乳腺癌。而本研究对该模型小鼠EGFR信号分子通路的改变进行了初步的探讨,发现TIP30缺失会导致EGFR下游信号通路的活化,而这可能是TIP30基因敲除小鼠形成乳腺癌的原因之一。
表1 免疫组化检测小鼠乳腺组织及Tip30-/-乳腺肿瘤pErk和pAkt阳性细胞率(%,±s)Table 1Percentage of pErk and pAkt positive cells in mouse mammary gland and Tip30-/-mammary tumor by IHC(%,x±s)
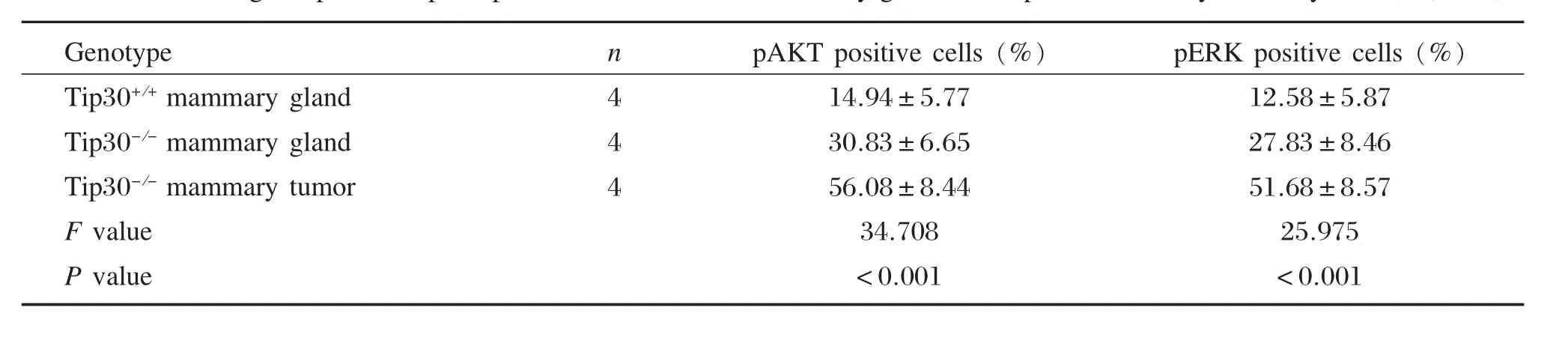
表1 免疫组化检测小鼠乳腺组织及Tip30-/-乳腺肿瘤pErk和pAkt阳性细胞率(%,±s)Table 1Percentage of pErk and pAkt positive cells in mouse mammary gland and Tip30-/-mammary tumor by IHC(%,x±s)
Genotype Tip30+/+mammary gland Tip30-/-mammary gland Tip30-/-mammary tumor F value P value n 4 4 4 pAKT positive cells(%)14.94±5.77 30.83±6.65 56.08±8.44 34.708<0.001 pERK positive cells(%)12.58±5.87 27.83±8.46 51.68±8.57 25.975<0.001
MAPK信号传递途径起着极为重要的作用,控制着细胞多种生理过程,如细胞生长、发育、分裂、死亡等。ERK是MAPK家族的主要成员,遵循MAPKs的三级酶促级联反应,即上游激活蛋白→MAPK激酶的激酶(MAPKKK)→MAPK激酶(MAP-KK)→MAPK,它的信号传递途径是涉及调节细胞生长、发育及分裂的信号网络的核心。ERK和其信号途径一方面接受大量来自生长因子、丝裂原、环境刺激等的信号,另一方面通过ERK信号级联反应作用于核转录因子如AP-1、NF-кB等,调控基因表达,从而在肿瘤侵袭和转移过程中起中介和放大信号的作用。本研究显示TIP30基因敲除的小鼠乳腺组织较野生型小鼠的pERK表达水平明显上升,并且在乳腺肿瘤组织中有更高的pERK表达水平。这些结果提示TIP30基因敲除后,可能通过影响MAPK信号通路而在乳腺癌的发生发展中起一定的作用。已有研究发现ERK的活性或表达水平在乳腺癌中明显升高。Mueller等[15]研究发现,与18例癌旁正常组织相比,131例原发性乳腺癌组织存在ERK活性的上调。Sivaraman等[16]的研究显示与良性乳腺疾病相比,乳腺癌组织中ERK活性升高5~10倍。因此提示TIP30缺失可能通过调节ERK活性来达到促进乳腺癌发生的作用。

图1 TIP30基因敲除活化小鼠乳腺及肿瘤组织EGFR下游信号分子(×400)Figure 1TIP30 deletion activates downsteam molecules of EGFR in mice(×400)
本研究还发现,EGFR下游PI3K通路在TIP30基因敲除的小鼠乳腺组织中活化明显强于野生型小鼠,而且TIP30基因敲除的小鼠的乳腺肿瘤组织pAKT表达更高。提示该通路的激活可能与该小鼠模型乳腺癌的发生发展存在一定关系。既往已经有很多研究发现,PI3K通路的激活不但与乳腺癌的发生发展有关,还与其它多种肿瘤如黑色素瘤、淋巴瘤、前列腺癌、乳腺癌等发生发展有着密切关系。在PI3K信号通路中,AKT是信号通路中的核心分子,AKT下游包括Nf-kB、VEGF、FOXO等等,是促增殖抑凋亡的因子。PI3K/AKT途径通过抑制肿瘤细胞凋亡、增强细胞对低氧和营养缺乏的耐受能力,辅助肿瘤生长。异常活化的PI3K通路还可以阻断肿瘤细胞的极化,从而增强其侵袭和转移能力。值得一提的是,研究发现乳腺上皮细胞内单纯的AKT活化在小鼠体内并不足以诱发乳腺癌[17],因此提示乳腺癌发生还和其它多种机制相关[8,10]。有数据表明,TIP30基因缺失可以增强c-Myc和IGF-1等基因的表达,提示TIP30基因敲除后可能通过多种机制来诱导乳腺癌发生。
因此,本研究通过对TIP30基因敲除BALB/c小鼠模型的研究发现,TIP30缺失会导致EGFR下游ERK/MAPK及PI3K/AKT信号通路的活化,从而导致TIP30基因缺失小鼠发生乳腺癌,而pERK和pAKT阳性细胞表达率是否存在关联仍有待我们进一步研究。本研究对TIP30基因及其相关EGFR信号通路的研究,进一步阐明了乳腺癌发生的可能分子机制,还为寻找乳腺癌治疗潜在靶点提供一定的理论基础。
[1]Xiao H,Tao Y,Greenblatt J,et al.A cofactor,TIP30,specifically enhances HIV-1 Tat-activated transcription[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(5):2146-2151.
[2]Tong X,Li K,Luo Z,et al.Decreased TIP30 expression promotes tumor metastasis in lung cancer[J].The American Journal of Pathology,2009,174(5):1931-1939.
[3]Li X,Zhang Y,Cao S,et al.Reduction of TIP30 correlates with poor prognosis of gastric cancer patients and its restoration drastically inhibits tumor growth and metastasis[J].International Journal of Cancer,2009,124(3):713-721.
[4]Zhang H,Zhang Y,Duan HO,et al.TIP30 is associated with progression and metastasis of prostate cancer[J]. International Journal of Cancer,2008,123(4):810-816.
[5]Zhao J,Ni H,Ma Y,et al.TIP30/CC3 expression in breast carcinoma:relation to metastasis,clinicopathologic parameters,and P53 expression[J].Human pathology,2007,38(2):293-298.
[6]Chen X,Cao X,Dong W,et al.Expression of TIP30 tumor suppressor gene is down-regulated in human colorectal carcinoma[J].Digestive Diseases and Sciences,2010,55(8):2219-2226.
[7]Ito M,Jiang C,Krumm K,et al.TIP30 deficiency increases susceptibility to tumorigenesis[J].Cancer Research,2003,63(24):8763-8767.
[8]Pecha J,Ankrapp D,Jiang C,et al.Deletion of Tip30 leads to rapid immortalization of murine mammary epithelial cells and ductal hyperplasia in the mammary gland[J].Oncogene,2007,26(53):7423-7431.
[9]Xiao H,Palhan V,Yang Y,et al.TIP30 has an intrinsic kinase activity required for up-regulation of a subset of apoptotic genes[J].The EMBO Journal,2000,19(5):956-963.
[10]Jiang C,Ito M,Piening V,et al.TIP30 interacts with an estrogen receptor alpha-interacting coactivator CIA and regulates c-myc transcription[J].The Journal of Biological Chemistry,2004,279(26):27781-27789.
[11]King FW,Shtivelman E.Inhibition of nuclear import by the proapoptotic protein CC3[J].Molecular and Cellular Biology,2004,24(16):7091-7101.
[12]Zhang C,Li A,Zhang X,et al.A novel TIP30 protein complex regulates EGF receptor signaling and endocytic degradation[J].The Journal of Biological Chemistry,2011,286(11):9373-9381.
[13]Zhang C,Mori M,Gao S,et al.Tip30 deletion in MMTV-Neu mice leads to enhanced EGFR signaling and development of estrogen receptor-positive and progesterone receptor-negative mammary tumors[J].Cancer Research,2010,70(24):10224-10233.
[14]Chen F,Li A,Gao S,et al.Tip30 controls differentiation of murine mammary lu minal progenitor to estrogen receptor-positive lu minal cell through regulating FoxA1 expression[J].Cell Death&Disease,2014,15(7):785-788.
[15]Mueller H,Flury N,Eppenberger-Castori S,et al.Potential prognostic value of mitogen-activated protein kinase activity for disease-free survival of primary breast cancer patients[J].International Journal of Cancer,2000,89(4):384-388.
[16]Sivaraman VS,Wang H,Nuovo GJ,et al.Hyperexpression of mitogen-activated protein kinase in human breast cancer[J].The Journal of Clinical Investigation,1997,99(7):1478-1483.
[17]Hutchinson J,Jin J,Cardiff RD,et al.Activation of Akt(protein kinase B)in mammary epithelium provides a critical cell survival signal required for tumor progression[J].Molecular and Cellular Biology,2001,21(6):2203-2212.
EGFR downstream signal molecules in TIP30 knockout mice
CHEN Fengsheng1,CHEN Xiaohua2,LI Aimin1,ZHOU Jin1,LUO Rongcheng1★
(1.The Combination of Traditional Chinese and Western Medicine Hospital Cancer Center of Southern Medical University,Guangzhou,Guangdong,China,510315;2.Oncology Center of Panyu District Hospital in Guangzhou City,Guangzhou,Guangdong,China,511400)
ObjectiveTo investigate whether deletion of TIP30 in mice affect activity of EGFR downstream signal molecules.MethodsMammary glands and breast cancer tissues of Tip30+/+and Tip30-/-BALB/c mice were obtained.pAKT and pErk1/2 were detected in these samples by immunohistochemistry. ResultsPositive rates of pErk1/2 and pAkt in Tip30-/-mice mammary gland were(27.83±8.46)%and(30.83±6.65)%(n=4),which were significantly higher than(12.58±5.87)%and(14.94±5.77)%in Tip30+/+mice respectively.P values were 0.02 and 0.011.Moreover,positive rates of pErk1/2 and pAkt in Tip30-/-mice mammary tumor were(51.68±8.57)%and(56.08±8.44)%,significantly higher than Tip30-/-mice mammary gland,P values were 0.002 and 0.001 respectively.ConclusionDeletion of TIP30 in BALB/c mice resulted in mammary tumor partly through upregulation of EGFR downstream signal molecules activity.
TIP30;EGFR;Breast cancer
广东省医学科学技术研究基金(B2014267);广州市番禺区珠江科技新星专项(2013-专15-6.10)
1.南方医科大学中西医结合医院肿瘤中心,广东,广州510315 2.广州市番禺区中心医院肿瘤科,广东,广州511400
罗荣城,E-mail:lrc01@163.com
