保健食品和传统的中医药△
2015-09-25叶祖光侯红平
叶祖光,侯红平
(中国中医科学院中药研究所,北京 100700)
·专题·
保健食品和传统的中医药△
叶祖光*,侯红平
(中国中医科学院中药研究所,北京 100700)
在2015年以前,保健食品在进入市场前须进行科学的技术审评和官方的注册批准,保健食品申请资料包括功能评价,安全评价,稳定性测试,质量控制等相关资料。如有必要,还需要临床研究进一步证明其效果和安全性。根据2015年全国人大颁布的“食品安全法”,部分保健食品可以不必经过上述审批而实施备案制,其指导原则正在制定之中。这样我国的保健食品将实施审批制和备案制两种模式。在我国,保健食品的最大特点是与中医药密切相关。养生保健是中医药的重要组成部分。许多的中药药材或饮片不仅是药品原料,同时也是食品和保健食品的原料。此外,保健食品中的中药配方也是在中医理论指导下组方配伍的,因此,保健食品与中医药有着密切的关系。
中医药;保健食品;保健;注册;管理
保健食品,是指声称具有特定保健功能或者以补充维生素、矿物质为目的的特殊食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品[1]。在我国,有两种类型的保健食品,一种是能改善一定生理功能的功能性保健食品,另一种是补充人体营养的膳食补充剂。保健食品主要针对亚健康人群,随着生活水平的提高,人们对生活质量提出了越来越高的要求,这使得具有保健功能的保健食品市场成为发展速度最快的行业之一。在我国,保健食品2015年以前实行审批制而不是备案制,所有保健食品在上市销售前均需要国家管理部门的注册审批。为此,国家管理部门以前颁布了一系列的技术要求指导保健食品的研发和注册审批工作。2015年4月24日,我国颁布了《中华人民共和国食品安全法》(简称食品安全法),并要求在2015年10月1日施行。新的食品安全法明确提出,以后保健食品将实施注册审批制和备案制等两种审批模式。食品安全法中的第七十六条指出:“使用保健食品原料目录以外原料的保健食品和首次进口的保健食品应当经国务院食品药品监督管理部门注册。 但是,首次进口的保健食品中属于补充维生素、矿物质等营养物质的,应当报国务院食品药品监督管理部门备案。其他保健食品应当报省、自治区、直辖市人民政府食品药品监督管理部门备案。” 两种模式相应的技术要求等文件将会陆续出台。
中医药养生保健是中医药理论和实践的重要组成部分。因此,在我国保健食品和中医药有着千丝万缕的联系,同时中医药在保健食品研发中的应用也是我国保健食品产业的显著特色,也是不同于其他国家保健食品的特点之一[2-3]。
本文主要介绍中国保健食品的审评机制和技术要求,同时针对中医药与保健食品的关联性给予梗概的阐述。
1 我国保健食品的审评机制及其相关技术要求
1.1保健食品法律法规的形成与完善
在1995年以前,中国对保健食品没有明确的专门管理规定,在1995年由人大颁布了《中华人民共和国食品卫生法》,首次确立了保健食品的法律地位;卫生部于1996年根据上述法令颁布了《保健食品管理办法》,首次规范了对保健食品的审批、注册上市及其监督管理。2003年,根据国务院的指示,将保健食品注册审批管理的职能从卫生部转移到国家食品药品监督管理总局,由于变更了监管的责任主体,因此国家食品药品监督管理总局对《保健食品管理办法》进行了修订,于2003年国家食品药品监督管理总局出台了新的保健食品注册管理办法。近年来,随着人们对食品安全性的重视,全国人大于2009年和2015年分别对《中华人民共和国食品卫生法》进行了修订,强调了食品的安全性,同时要求严格管理保健食品的安全性。此外,行政主管部门针对保健食品注册审批中的问题,又颁布了一系列的技术要求和指导原则,例如2002年公布的 “卫生部关于进一步规范保健食品原料管理的通知”,主要内容就是有关中药作为保健食品原料的规定,其中有3个附件:附件1“既是食品又是药品的物品名单”,附件2“可用于保健食品的物品名单”,附件3“保健食品禁用物品名单”。该文件的出台明确了了哪些中药可用于保健食品原料,哪些不能用于保健食品原料。
1.2我国保健食品的审评机制
我国保健食品的审评是由国家食品药品监督管理总局食品三司负责审批,具体技术审评工作由该局直属的国家保健食品审评中心具体实施。审评中心采取外界专家和审评中心相结合的模式进行技术审评,外界专家在审评中起到至关重要的作用。外界专家委员会由多种学科的数百名专家组成,在评审时随机选择评审专家。
我国的保健食品审评实行两阶段审评程序:一是省(市)、自治区食药管理部门组织的初审;初审包括现场考核,审查所有实验记录,验证实验室样本的质量等,二是国家级终审,就是对已经通过了初审的申报材料和有关样品等,由审评中心组织外界专家进行最后的审评。一般而言,申请者将申报材料首先上交到地方管理部门,经过初审合格后,再上交到国家食品药品监督管理总局进行终审,以最终决定是否批准该产品上市注册。具体流程详见图1。
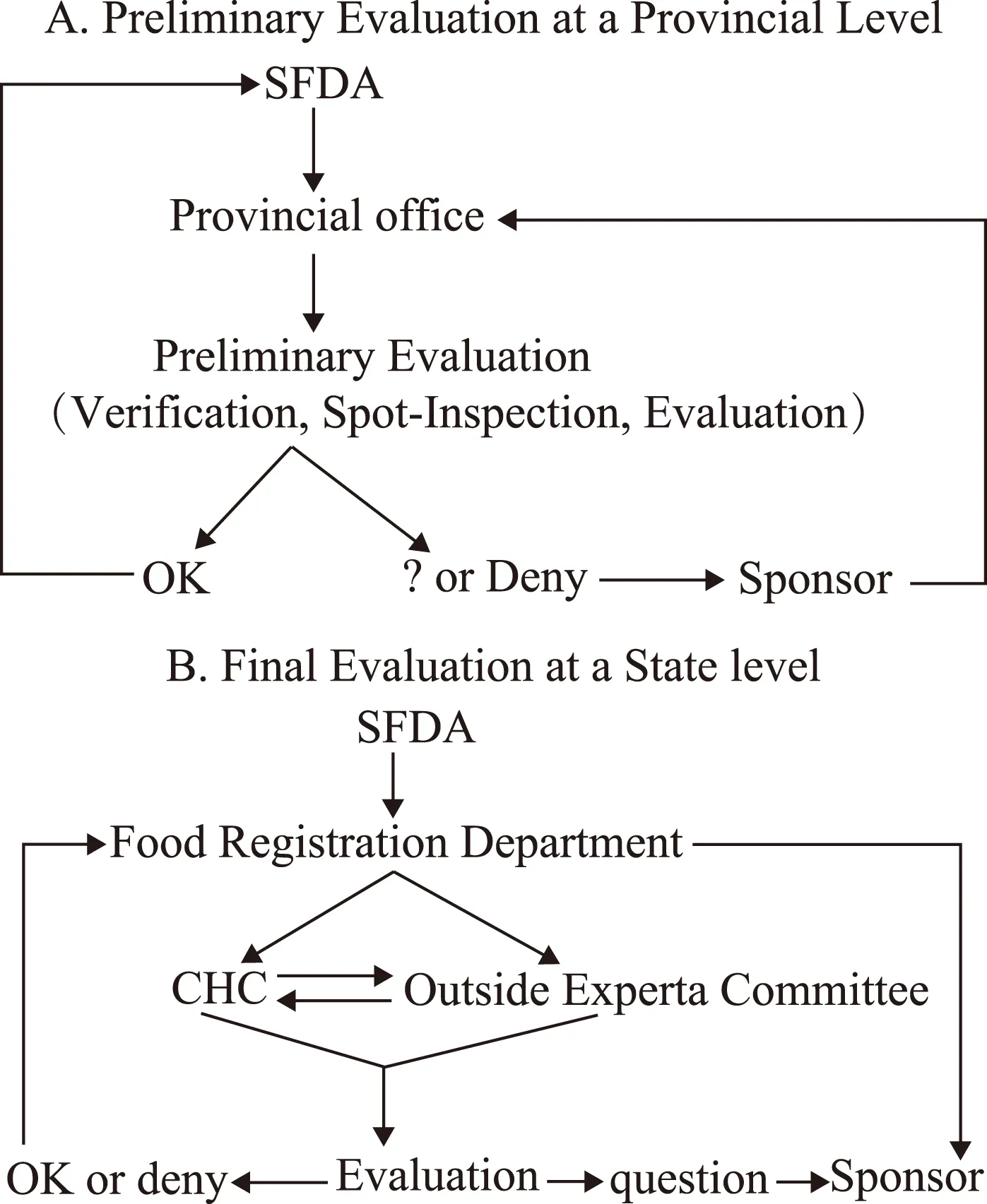
图1 保健食品申报的具体流程
1.3我国保健食品的技术要求
保健食品申请上市前的研发工作主要涉及保健功能检测(实验室研究和临床研究)、安全性评价的毒理学试验以及产品质量控制的相关研究等三大部分的研究内容[4]。关于保健功能的研究,除了申请者自行的研究之外,必须要到国家制定的科研单位进行验证性检验,并由他们出具检验报告作为保健功能的上报材料。目前,在我国保健食品的功能仅有27种(见表1),例如增强免疫力,改善睡眠,去黄褐斑、痤疮等。某些特定的保健食品需要做一些特定的实验,例如申请免疫功能的保健食品需要进行一组免疫测试,增加骨密度的保健食品需要做骨密度方面的测试。为了规范保健食品的测试,卫生部于2003年颁布了“保健食品检验与评价技术规范”。因此,保健食品的申请应根据相关技术要求完成相关实验。除了表1中所列举的27种功能之外,国家也鼓励发展新的保健功能,但需要提供较多的研究资料。

表1 保健食品的27种功能及分类
保健功能试验可以分为三种类别:只要求做动物实验,例如增强免疫、增加骨密度的功能试验;只要求做人体试验而不做动物实验的,例如去黄褐斑、痤疮;还有一类保健功能既要求做动物实验,又要做人体试验,例如辅助降血糖、降血脂、降血压。临床试验需要具有一定资质的医院完成,试验对象包括50例的对照组以及50例的受试组。为了保护受试者的权益,只有完成了安全性试验、动物的功能试验、以及卫生学和稳定性考察等所有试验之后,才能开展临床人体食服试验,此外只有功能性保健食品才要求做功能检验,而营养补充剂则不需要做功能试验,例如补充维生素或者补充矿物质(钙、锌、硒等)。
由于保健食品属于食品管理范畴,所以对其安全性格外的重视,其毒性检测包括急性毒性、长期毒性(30天喂养试验或90天喂养试验)、遗传毒性以及生殖毒性等。上述安全性评价试验需要采用合格健康的动物并在认证的实验室进行试验。有关工艺和质量控制指标的确定和检测等要求基本上等同于新药的研发,例如,工艺的筛选、中试研究、稳定性的考察、卫生学检测等。上述检测全部完成后整理总结成上报材料,然后才能向国家食品药品监督管理总局(CFDA)提交审评报告,经历两个阶段的审评程序。上述均是注册审批制的有关审评流程和技术要求,有关备案制尚待颁布有关实施指导原则和具体细节。
此外,我国保健食品的生产实施GMP管理制度,生产企业必须是符合GMP标准的、并且获得国家有关部门认证的企业。为了更好的实施保健食品的GMP管理,卫生部1998年颁布了《保健食品良好生产规范》,同时卫生部组织有关专家编写了有关《保健食品良好生产规范实施指南》。由于GMP的实施,保证了保健食品的生产质量和安全性[6]。
2 中医药在保健食品研发中的作用
2.1中药是我国保健食品原料来源之一
维持人体生理功能的平衡状态是中医的重要原则。中医认为,疾病往往表现在身体的某个特定部位,如血压、血糖、肿瘤等,这些疾病源于身体整体状态的平衡被打破。另外,中医更注重患者亚健康或疾病发生前的干预,而不是单纯治疗发病后的疾病或症状。因此,中医更关注卫生保健和亚健康状态,这与保健食品的理念相一致。除此之外,食疗是中医药的中药分支,同时养生保健是中医药理论与实践的重要组成部分,因此,一些中药的功效主要是用于维持身体的健康状态和调节机体的平衡。这些中药不仅可以用于治疗疾病的药品原料,而且也可以用于维持机体正常生理功能的保健食品原料。这样在中医药的长期发展过程中就形成了我国独特的药食兼用的中药。目前,我国保健食品的原料组成有以下几类:维生素、矿物质、天然产物、中药和其他可食用的材料。据统计,含中药原料的保健食品占所有已批准注册保健食品的60%以上,如果以功能性保健食品进行统计(排除维生素和营养性矿物质组成的营养补充剂),含有中药的保健食品在功能性保健食品中所占比例更高。由此可见,中药在保健食品原料中占有举足轻重的位置。然而,并非所有中药都适宜作为保健食品的原料。为规范中药原料在保健食品中的使用和管理,如前文所述,卫生部于2002年2月发布了《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号,以下简称“51号文件”),并将“既是食品又是药品的物品名单”、“可用于保健食品的物品名单”、“保健食品禁用物品名单”列为3个附件同时发布。其中,“既是食品又是药品的物品名单”中包括山药、山楂、甘草、阿胶、鱼腥草、枸杞子、栀子、茯苓、葛根、酸枣仁等87种物品;“可用于保健食品的物品名单”中包括人参、女贞子、丹参、天麻、当归、红景天、西洋参、党参、益母草、淫羊藿等114种物品;“保健食品禁用物品名单”中包括草乌、马钱子、巴豆、甘遂、生狼毒、洋金花、牵牛子、香加皮、斑蝥、雷公藤等59种物品。最近对附件1的名单进行了系统的梳理和调研,又增补了人参、山银花、夏枯草等14味中药,使附件1名单中的中药数量达到101种,目前正在公示征求意见。由此可见,中药是保健食品原料的重要来源。
近年来,出于安全性的考虑,除了上述禁用物品之外,生大黄、黄芩、黄连、黄柏、鹅不食草等中药,也不允许用作保健食品原料。此外,根据国家相关法规规定,禁止使用国家一级和二级保护野生动植物及其产品作为原料生产保健食品,人工驯养繁殖或人工栽培的国家一级保护野生动植物及其产品也属于保健食品原料禁用范畴。但对于二级保护野生动植物,如果是人工驯养繁殖或人工栽培的,便可以用作保健食品原料[7]。
2.2如何科学地使用中药作为保健食品的原材料
由于保健食品在分类管理上归属于食品,消费者可以随意获得,且服用周期无特殊的限制要求,因此,其食用安全性问题就变得非常重要。以中药为原料生产的保健食品,长期食用的安全性问题同样格外引人关注。《中华人民共和国药典》(以下简称《药典》)中规定了中药材或中药饮片作为药品原料的参考用量标准。在保健食品的研发和注册审批中,其配方的中药原料用量一般参考《药典》的临床推荐量,出于安全性考虑,多数产品是参考《药典》推荐量的下限剂量,性味偏烈的中药用量甚至低于下限推荐量。如果保健食品中的中药材日用量超出药典推荐量的上限,则需要提供证明其用量安全性的依据[7]。
中医临床用药特点之一是中药配伍用药,在中医临床实践中,中药很少单独用药,绝大多数都是多味中药配伍用药,因此在中医药中发展了较系统的中药配伍的理论和经验总结。在保健食品的研发中,其配方组成的中药原料配伍也常常依循中医药配伍的理论和经验。含中药的保健食品配方通常是根据中医方剂学理论和中医临床应用经验进行复方配伍的。在中药配伍组方时,尤其要重视中医药理论中关于药物配伍可以引起毒副作用的经验总结,例如中药的七情配伍,协同、拮抗、相使、十八反、十九畏等[8]。因此,中药组成的保健食品在研发为商品的过程中,应当符合中医药理论,在组方时应当遵循中医配伍的方剂学理论。与此同时,保健食品配方也应当以现代药理学和营养保健为依据。只有这样,保健食品的保健功能才会增强,其安全性风险也会减少到最低程度。此外,通常以中药为原料的保健食品的生产工艺通常采用传统的制备工艺中,一般而言,其工艺多为水提取的制备工艺,有时为了获得脂溶性的有效组分,也采用醇提的方法,但不采用食品加工中所禁用的有机溶媒,以防止有机溶媒残留物可能引起的安全性问题。同时,为了安全性起见,不主张采用细菌发酵的方法加工中药原料。
综上所述,中医药和保健食品之间不论在理论上、还是在应用实践中,二者有着千丝万缕的联系。但研发具有中医药特色保健食品的研发、注册管理以及产业化和国际化还任重道远。
[1] 国家食品药品监督管理局关于发布保健食品命名规定(试行)的通告[J].中国食品卫生杂志,2007:19(4):374.
[2] 胡骏焯,徐清河.论中医药保健食品的研究开发契机[J].中国中医药信息杂志,1998(04):27-28.
[3] 张象麟,叶祖光.刍议美国FDA药品审评和研究中心2000和2001年度工作报告[J].中国新药杂志,2003(01):4-08.
[4] 叶祖光,张广平.中药安全性评价的发展、现状及其对策[J].中国实验方剂学杂志,2014(16):1-06.
[5] 卫生部关于印发《保健食品检验与评价技术规范》(2003年版)的通知[J].中国食品卫生杂志,2003(03):269.
[6] 白鸿,叶祖光.中医药与保健食品的关联性探讨[J].中国中医药信息杂志,2011(03):9-11.
[7] 党毅,肖培根,杨显荣.中医药与保健食品如何结合的刍议[J].时珍国医国药,1998(06):6-07.
[8] 李玉衡,高军.保健食品乎? 中药乎?——越来越多的保健食品配方与中成药处方相同[J].首都医药,2007(09):22-23.
HealthFoodandTraditionalChineseMedicineinChina
YEZuguang*,HOUHongping
(InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
UP to now,a health food has to be scientifically evaluation and officially approved before it legally is marketed in China.The application dossier submitted to CFDA for marketing of health foods includes the experimental data on its functional effects,safety evaluation,stability tests,quality control,and so on.If necessary,a clinical study is needed to further prove its effect and safety.Based on the new law “Act on Food Safety of People’s Republic of China”issued by National People’s Congress in 2015,some health foods on the list issued by CFDA are allowed to enter the market without the registration approval mentioned above,whose guidance is under formulation.Health foods in China are characterized by involvement of TCM (traditional Chinese Medicine) in them.Health care plays an important role in TCM system.A quite number of TCM raw materials (medicinal plants) are not only drug substances,but also popular foods,which are permitted to be used as ingredients of a health food.Therefore,some TCM raw materials have two sides:one is used for a medical drug,and the other side is for a health food.Formulation of the health food consisting of TCM materials is directed by TCM theory and knowledge.Therefore,health food has a close relationship with TCM.
Traditional Chinese medicine;health food;health care;registration;regulation
1.国家高新技术研究发展计划(863计划):基于海洋传统药源生物的中药新药开发(2013AA093003); 2.国家食品药品监督管理总局课题:中药复方新药命名原则制定研究
*
叶祖光,研究员,研究方向:中药药理毒理。电话:(010)84252805,E-mail:yezuguang@sina.com
10.13313/j.issn.1673-4890.2015.12.001
2015-11-20)
