5种大黄制剂微生物限度检查法的建立
2015-09-17吴晶晶王曙东
李 思 方 李 吴晶晶 陆 崟 苏 华 王曙东
南京军区南京总医院制剂科,江苏南京 210002
《中国药典》(2010年版)[1]强调对药品的微生物限度检查法进行方法学验证,南京军区南京总医院制剂科(以下简称“我科”)制剂以中药为主,多种中药材和中药单体化合物有不同程度的抑菌性,本研究以大黄制剂为例,目的是建立对抑菌性较强中成药的微生物限度检查方法,验证过程中当采用常规法不能真实反映制剂微生物污染情况时,应采用培养基稀释法或薄膜过滤法等方法先消除供试品中的抑菌活性,再进行微生物限度检查,以有效控制制剂质量。微生物限度检查是控制制剂质量的一项重要指标,制剂质量控制是制剂生产销售的关键,所以针对不同类型制剂建立安全有效的微生物限度检查法对控制我科制剂的安全性有着至关重要的意义。
1 仪器与材料
1.1 仪器
PYX-DHS-40×50型隔水式电热恒温细菌培养箱(上海跃进医疗器械厂);ML160型霉菌培养箱 (上海跃进医疗器械厂)。
1.2 样品
选取我科自制制剂保肾片、新保肾片、肾炎宁片、新肾炎胶囊和炎黄保肾胶囊,每种制剂选取近期的3个批次作为验证样品。
保肾片(批号:141230、150126、150202),新保肾片(批号:141227、150114、150128),肾炎宁片(批号:141223、150118、150210),新肾炎胶囊(批号:141230、150116、150204),炎黄保肾胶囊(批号:150112、150126、150209)均由我科提供。
1.3 试验菌株
金黄色葡萄球菌[编号 CMCC(B)26003第 3代],枯草芽孢杆菌[编号 CMCC(B)63501第 4代],大肠埃希菌[编号 CMCC(B)44102 第 4 代],白色念珠菌[编号CMCC(F)98001 第 3 代],黑曲霉[编号 CMCC(F)98003第3代]均由江苏省食品药品检验所提供。
1.4 培养基
营养琼脂培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:130513),玫瑰红钠琼脂培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:141010),营养肉汤培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:130311),胆盐乳糖培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:140212),MUG培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:130307),改良马丁培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:130830),改良马丁琼脂培养基(北京三药科技开发公司,中国药品生物制品检定所监制,批号:130923)均由江苏省食品药品检验所提供。按规定进行的适用性检查结果合格。稀释剂为pH 7.0无菌氯化钠-蛋白胨缓冲液,冲洗剂为0.1%蛋白胨(规格:250 g,北京三药科技开发公司,中国药品生物制品检定所监制,批号:130814)。
2 方法与结果
按《中国药典》(2010年版)[1]一部附录微生物限度检查法进行验证。
2.1 菌液制备[2]
2.1.1 金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌
用阳性菌专用接种环取适量金黄色葡萄球菌、大肠埃希菌和枯草芽孢杆菌新鲜培养物置已灭菌的10 mL营养肉汤培养基中,将接种这3株菌的培养基置于细菌培养箱(30~35℃)中培养 18~24 h,分别取各培养物1 mL加至0.9%无菌氯化钠溶液9 mL中,金黄色葡萄球菌10倍递增稀释至1/106,大肠埃希菌10倍递增稀释至1/10-7,枯草芽孢杆菌10倍递增稀释至1/105,分别制成每毫升含菌数为50~100 cfu的菌悬液。
2.1.2 白色念珠菌
用阳性菌专用接种环取适量白色念珠菌的新鲜培养物置已灭菌的10 mL改良马丁培养基中,将接种好的培养基置于霉菌培养箱(23~28℃)中培养36~48 h,取培养物1 mL加至0.9%无菌氯化钠溶液9 mL中,10倍递增稀释至1/105,制成每毫升含菌数为50~100 cfu的菌悬液。
2.1.3 黑曲霉
用阳性菌专用接种环取适量黑曲霉新鲜培养物置于改良马丁琼脂斜面培养基中,将接种好的培养基置于霉菌培养箱(23~28℃)中培养7 d,形成大量孢子,洗脱孢子过滤,取1 mL孢子液,制成孢子悬液,使之每毫升含孢子数为50~100 cfu。
2.2 供试液制备
取供试品(5种制剂每种各3个批次)10 g,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL,用匀浆仪研匀,制成1∶10均匀混悬液作为供试液备用。
2.3 回收率测定
细菌、霉菌和酵母菌计数检查方法的建立:若试验组的菌回收率均不低于70%,可按该供试液制备方法和计数方法测定供试品的细菌、霉菌和酵母菌数;若任一次平行试验中试验组的菌回收率低于70%,应建立新的方法,并重新验证。
2.3.1 常规法[3]
2.3.1.1 试验组 分别取上述5种制剂各3个批号的供试液(1∶10)1 mL,注入 10 个平皿中,2 个一组分为5组,每组分别加入上述稀释的5种菌悬液1 mL(50~100 cfu),每株试验菌平行制备2个平皿,细菌倾注营养琼脂培养基,霉菌和酵母菌倾注玫瑰红钠琼脂培养基,待凝固后,营养琼脂培养基置细菌培养箱(30~35℃)培养48 h,玫瑰红钠琼脂培养基置霉菌培养箱(23~28℃)培养 72 h。
2.3.1.2 菌液组 取10个平皿,2个一组分成5组,分别取上述稀释的5种菌悬液1 mL注入每组平皿中,每个菌平行制备2个平皿,细菌倾注营养琼脂培养基,霉菌和酵母菌倾注玫瑰红钠琼脂培养基,待凝固后,营养琼脂培养基置细菌培养箱(30~35℃)培养48 h,玫瑰红钠琼脂培养基置霉菌培养箱(23~28℃)培养72 h,测定所加入的试验菌数。
2.3.1.3 供试品对照组 每种培养基制备2个平皿,分别取上述5种制剂各3个批号的供试液 (1∶10)1 mL分别注入,倾注培养基,待凝固后,营养琼脂培养基置细菌培养箱(30~35℃)培养48 h,玫瑰红钠琼脂培养基置霉菌培养箱(23~28℃)培养72 h,以测定供试品的本底菌数。
2.3.1.4 稀释剂对照组 本品未用特殊方法处理和制备,所以未设置该组。
2.3.1.5 验证结果 依照下列公式,计算常规法项下5种大黄制剂的试验菌回收率:

由表1可知,5种大黄制剂对枯草芽孢杆菌均有很强的抑菌作用,均需改用培养基稀释法或薄膜过滤法重新验证;新肾炎胶囊和炎黄保肾胶囊对金黄色葡萄球菌有很强的抑菌作用;肾炎宁片、新肾炎胶囊和炎黄保肾胶囊对白色念珠菌有一定的抑菌作用;保肾片和新保肾片对白色念珠菌及黑曲霉均无抑制作用,回收率均达到70%以上,故可采用常规法测定这2个品种的霉菌和酵母菌数。
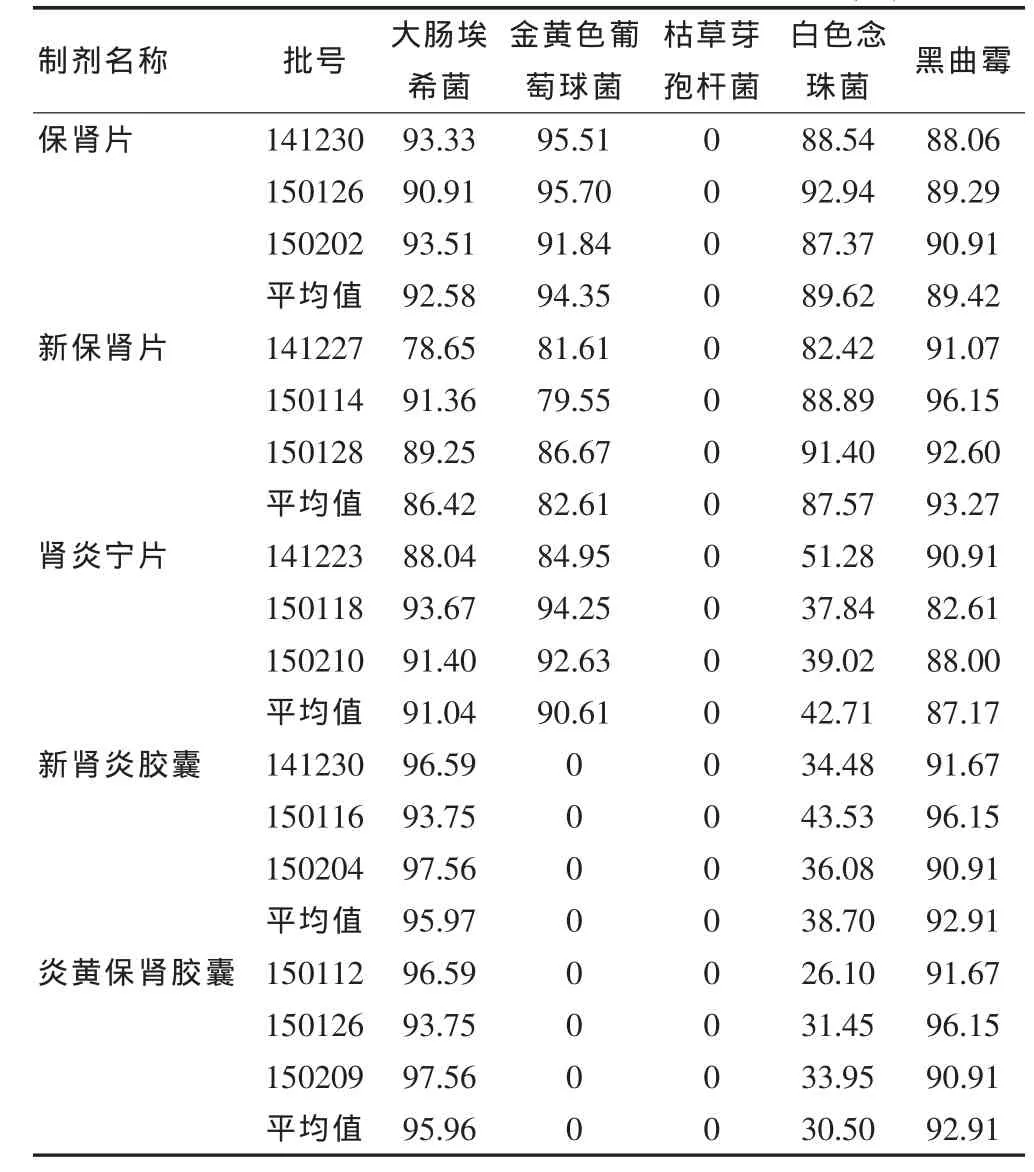
表1 常规法项下5种大黄制剂的试验菌回收率(%)
2.3.2 培养基稀释法[4-5]
2.3.2.1 试验组 分别取上述5种制剂各3个批号的供试液(1∶10)0.2 mL 置于 10个平皿,2个一组分成5组,每株试验菌平行制备2个平皿,即供试液每平皿0.2 mL,依次加入上述稀释的5种菌悬液1 mL(50~100 cfu),细菌倾注营养琼脂培养基,霉菌和酵母菌倾注玫瑰红钠琼脂培养基,待凝固后,营养琼脂培养基置细菌培养箱(30~35℃)培养48 h,玫瑰红钠琼脂培养基置霉菌培养箱(23~28℃)培养72 h。
2.3.2.2 菌液组 取10个平皿,2个一组分成5组,每个菌平行制备2个平皿,分别取上述稀释的5种菌悬液1 mL注入每组平皿中,细菌倾注营养琼脂培养基,霉菌和酵母菌倾注玫瑰红钠琼脂培养基,待凝固后,营养琼脂培养基置细菌培养箱(30~35℃)培养48 h,玫瑰红钠琼脂培养基置霉菌培养箱(23~28℃)培养72 h,测定所加入的试验菌数。
2.3.2.3 供试品对照组 分别取上述5种制剂各3个批号的供试液0.2 mL置4个平皿中,营养琼脂培养基和玫瑰红钠琼脂培养基每种培养基制备2个平皿,即供试液每平皿0.2 mL,待凝固后,营养琼脂培养基置细菌培养箱(30~35℃)培养48 h,玫瑰红钠琼脂培养基置霉菌培养箱(23~28℃)培养72 h,以测定供试品的本底菌数。
2.3.2.4 稀释剂对照组 本品未用特殊方法处理和制备,所以未设置该组。
2.3.2.5 验证结果 依照下列公式,计算培养基稀释法项下5种大黄制剂的试验菌回收率:

由表2可知,经培养基稀释(每平皿0.2 mL),保肾片、新保肾片和肾炎宁片3个品种对5株试验菌的回收率均高于70%,证明无抑菌作用。新肾炎胶囊和炎黄保肾胶囊对金黄色葡萄球菌和枯草芽孢杆菌抑菌作用较强,采用培养基稀释法不能完全消除其抑菌作用,需改用薄膜过滤法重新验证;对白色念珠菌和黑曲霉已无抑制作用,回收率均70%以上,可采用培养基稀释法测定。
2.3.3 薄膜过滤法[6]
2.3.3.1 试验组 分别取上述新肾炎胶囊和炎黄保肾胶囊各3个批次的供试液(1∶10)1 mL,加入装有100 mL冲洗液的过滤器中,经减压抽滤,每次约100 mL冲洗,共冲洗300 mL/膜,在最后一次冲洗液中依次加入上述稀释的细菌(大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌)的菌悬液 1 mL(50~100 cfu),抽滤干净后取膜,菌面向上贴于凝固的营养琼脂培养基上,置细菌培养箱(30~35℃)培养 48 h。
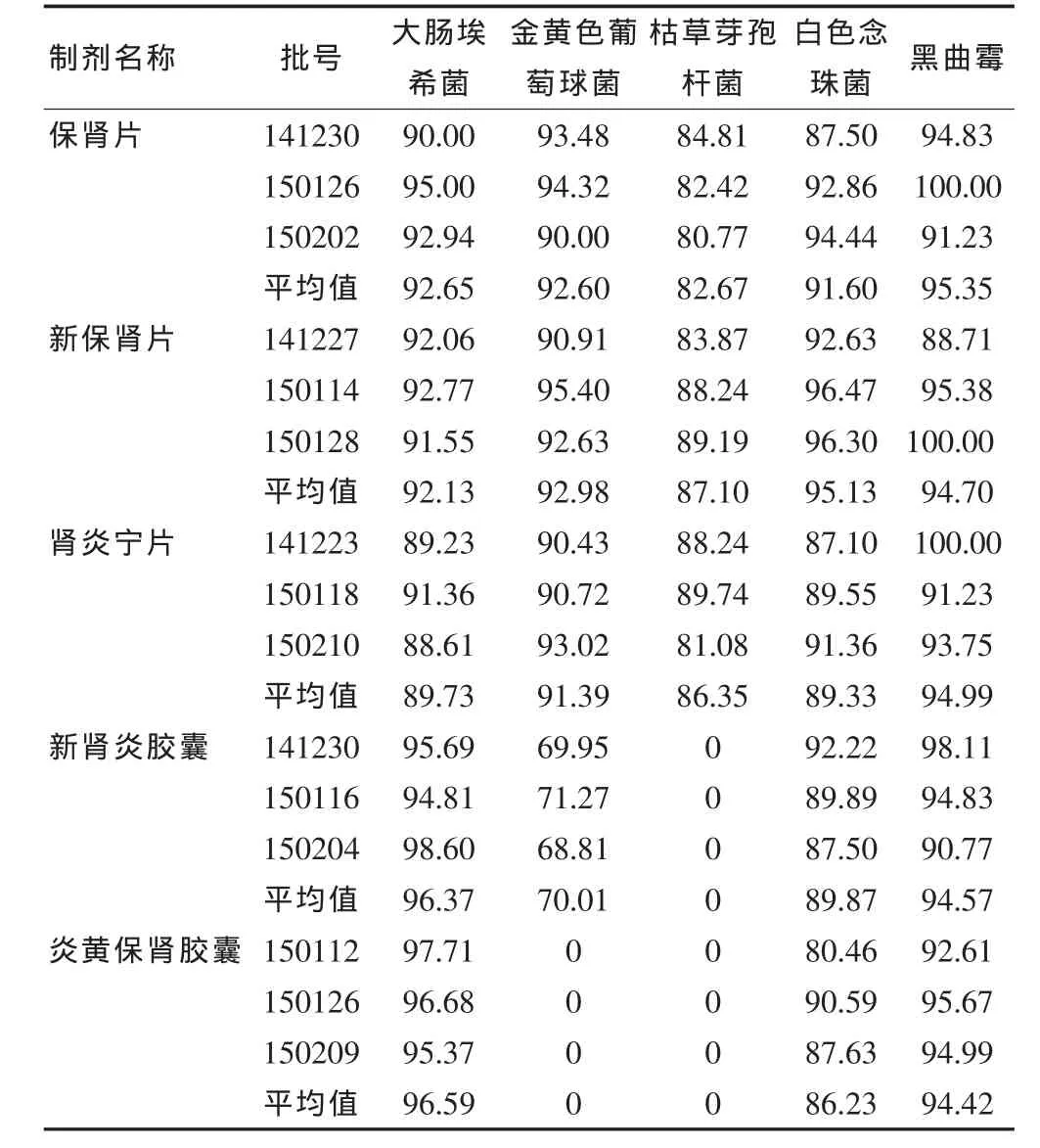
表2 培养基稀释法项下5种大黄制剂的试验菌回收率(0.2 mL/皿,%)
2.3.3.2 菌液组 分别取上述稀释的细菌菌液(大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌)1 mL,加入装有100 mL冲洗液的过滤器中,经减压抽滤,每次约100 mL冲洗,共冲洗300 mL/膜,抽滤干净后取膜,菌面向上贴于凝固的营养琼脂培养基上,置细菌培养箱(30~35℃)培养 48 h。
2.3.3.3 供试品对照组 分别取上述新肾炎胶囊和炎黄保肾胶囊各3个批次的供试液(1∶10)1 mL,加入装有100 mL冲洗液的过滤器中,经减压抽滤,每次约100 mL冲洗,共冲洗300 mL/膜,抽滤干净后取膜,菌面向上贴于凝固的营养琼脂培养基上,置细菌培养箱(30~35℃)培养 48 h。
2.3.3.4 稀释剂对照组 本品未用特殊方法处理和制备,所以未设置该组。
2.3.3.5 验证结果 依照下列公式,计算薄膜过滤法项下2种大黄制剂的试验菌回收率:

由表3可知,经薄膜过滤后,新肾炎胶囊和炎黄保肾胶囊对大肠埃希菌、金黄色葡萄球菌及枯草芽孢杆菌的回收率均高于70%,证明已无抑菌作用,可采用薄膜过滤法对这2个品种进行细菌计数检查。
2.4 控制菌检验方法验证
2.4.1 试验组
分别取上述5种制剂的供试液(1∶10)10 mL及92 cfu的大肠埃希菌,加入100 mL的胆盐乳糖增菌培养基中,置 30~35℃培养箱 18~24 h,取上述培养物0.2 mL接种至含5 mL MUG培养基的试管内培养,于5、24 h在366 nm紫外灯下观察,同时用未接种的MUG培养基作本底对照。

表3 薄膜过滤法项下2种大黄制剂的试验菌回收率(%)
2.4.2 阴性菌对照组
分别取上述5种制剂的供试液(1∶10)10 mL及93 cfu的金黄色葡萄球菌,加入100 mL的胆盐乳糖增菌培养基中,置 30~35℃培养箱18~24 h,取上述培养物0.2 mL接种至含5 mL MUG培养基的试管内培养,于5、24 h在366 nm紫外灯下观察,同时用未接种的MUG培养基作本底对照。
2.4.3 验证结果
由表4可见,采用常规法,控制菌(大肠埃希菌)能正常检出,阴性对照未检出金黄色葡萄球菌,符合《中国药典》(2010年版)微生物限度检查验证要求,所以常规法可用于这5种大黄制剂的控制菌检查。
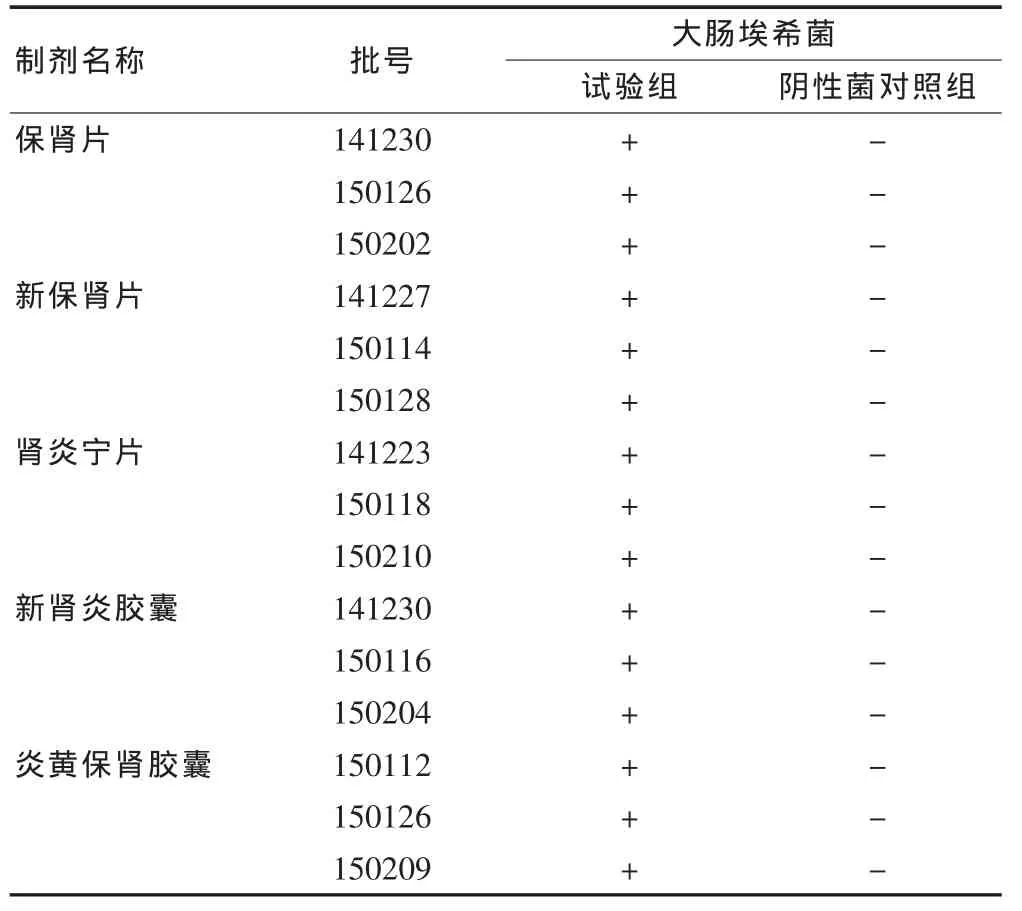
表4 控制菌(大肠埃希菌)验证结果
2.5 微生物限度检查法建立
根据以上试验验证结果,建立5种大黄制剂的微生物限度检查法,结果见表5。

表5 5种大黄制剂微生物限度检查法
3 讨论
我国具有大量宝贵的中药资源,而中草药在生长过程中不断与细菌抗争,逐渐成为天然的抑菌药物[7],中成药中含有较强抑菌成分时,要先排除抑菌成分的干扰[8],才能真实反映制剂污染微生物的状况,有研究报道过大黄与其他多种药材的抑菌性[9],大黄的抑菌作用相对都较强[10-11],所以建立大黄制剂微生物限度检查法时,必须先消除其抗菌性,才能正确反映制剂的微生物污染情况。
本研究选取的5种制剂均以大黄药材提取物为主要成分,大黄主要含蒽醌类化合物,主要包括芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚等,为大黄发挥抗菌作用的主要成分[12],尤其对金黄色葡萄球菌和链球菌等均有较强的抑制作用,5种制剂中保肾片、新保肾片和肾炎宁片含量测定以大黄酸、大黄素和大黄酚为主[13-14],新肾炎胶囊含量测定以大黄素为主,炎黄保肾胶囊含量测定以大黄酸为主。试验结果表明,5种大黄制剂中所含大黄蒽醌类成分含量不同,发挥抑菌作用效果也不同,含量愈高,抑菌作用也愈强。在对同一种中药原料制剂进行微生物限度检查时,由于所含主要成分差异以及含量高低而导致抑菌作用不同,故排除抑菌干扰所采取的方法也不同,应根据试验结果建立准确合适的微生物限度检查方法以保证制剂质量。
[1]国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:附录79-附录88.
[2]宾驰,颜栋林.4种医院制剂微生物限度检查方法验证[J].中国医药指南,2011,9(22):226-228.
[3]黄英.14种中成药微生物限度检查方法研究[J].中国执业药师,2013,10(2):27-30.
[4]方李,张心悦,吴晶晶,等.13种软膏剂微生物限度检查的方法验证讨论[J].研究简报,2014,17(9):1580-1583.
[5]方李,吴晶晶,钱琳娜,等.急支平喘软胶囊微生物限度检查的方法验证[J].安徽医药,2013,17(1):35-36.
[6]于风平,杨美琴,特玉香,等.含大黄、黄芩、黄连和黄柏药材的中成药微生物限度检查法的建立[J].药物分析杂志,2010,30(3):558-562.
[7]李亚娜.中药抑菌的研究现状及思考[J].国际检验医学杂志,2014,35(2):198-200.
[8]梁勤,乔登嫣,马小明,等.甘肃道地中药大黄、黄芩对多重耐药菌的抑菌活性[J].西部中医药,2014,27(5):5-7.
[9]费娜,杨俊杰.大黄等四种中草药体外抑菌活性比较[J].黑龙江医药科学,2010,33(1):18-19.
[10]宋丽琴.大黄不同炮制品的体外抑菌作用[J].海峡药学,2011,23(5):55-56.
[11]陈子彬,丰浩荣,王祥和.乌司他丁联合大黄对创伤后急性肺损伤的治疗效果[J].解放军医药杂志,2015,27(2):69-72.
[12]彭苑霞,刘晓强,温羚玲,等.大黄等5味中药及单体成分对临床多重耐药菌的抑制作用[J].中国实验方剂学杂志,2014,20(22):103-107.
[13]陆崟,王银娟,廖欣,等.肾炎宁片稳定性考察[J].安徽医药,2013,17(2):191-193.
[14]王曙东,乔立业,方李,等.保肾片的质量标准研究[J].研究论文,2014,17(8):1300-1302.
