羊种布鲁氏菌NN1202和LA1105株OPM25和OPM31蛋白B细胞抗原表位分析
2015-09-10李军李常挺潘艳等
李军+李常挺+潘艳等

摘要: 应用PCR技术对羊种布鲁氏菌NN1202和LA1105株的[WTBX][STBX]OMP25和OMP31 [STBZ]基因进行扩增、克隆和测序。测序结果显示,NN1202和LA1105株的[WTBX][STBX]OMP25和OMP31 [STBZ]基因在布鲁氏菌种间高度保守。应用Garnier-Robson方法和Chou-Fasman方法分析OMP25和OMP31蛋白的α-螺旋、β-折叠、转角区域和卷曲区域;应用Kyte-Doolittle方法、Karplus-Schulz方法、Emini方法和Jameson-Wolf方法分析蛋白的氨基酸亲水性、蛋白柔性区域、溶剂表面可及性和抗原指数。对各方法的结果综合分析,OMP25蛋白的27~34、59~65、69~75、101~107、148~154、182~189、197~202区域以及OMP31蛋白的25~32、50~58、63~70、102~111、125~130、166~173、176~183区域可能是优势B细胞抗原表位。
关键词: 布鲁氏菌;OMP25;OMP31;抗原表位
中图分类号: S858.26 文献标志码: A
文章编号:1002-1302(2015)08-0038-04
布鲁氏菌是一种感染人、家畜、野生动物等60多种动物的人兽共患病原菌,根据宿主和致病性的差异,分为羊种布鲁氏菌(Brucella melitensis)、牛种布鲁氏菌(B. abortus)、猪种布鲁氏菌(B.suis)、绵羊附睾种布鲁氏菌(B. ovis)、犬种布鲁氏菌(B. canis)和沙林鼠种布鲁氏菌(B. neotomae)6个种;此外,还从海洋动物中分离到在致病性和分子特征上有别于前6种的海豚布鲁氏菌(B. cetacease)和海豹布鲁氏菌(B. pinnipediae) [1]。在这8种布鲁氏菌中,以羊种布鲁氏菌对人的致病性最强。布鲁氏菌的外膜由外膜蛋白、脂多糖和磷脂层构成。外膜蛋白为一类与毒力密切相关的免疫原性蛋白 [2-3],其中,分子量分别为25 ku(OMP25)和31 ku(OMP31)的2种外膜蛋白是布鲁氏菌的主要外膜蛋白 [4-5]。OMP25蛋白和OPM31蛋白免疫小鼠后,能分别诱导产生IgG2a 和IgG1类型的抗体,是一种抗原免疫保护蛋白 [6-7]。Bowden等证实OMP31的单克隆抗体与其诱导产生的抗体存在竞争抑制现象,表明OMP31存在抗原表位 [8]。本研究拟对广西分离的2株羊种布鲁氏菌NN1202、LA1105菌株的[WTBX][STBX]OMP25和OMP31 [STBZ]基因进行克隆、测序,运用生物信息学技术对二者的B细胞抗原表位进行分析,为后续的合成肽疫苗研究提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 羊种布鲁氏菌NN1202和LA1105菌株由广西兽医研究所细菌研究室分离、鉴定和保存 [9]。羊种布氏菌5号疫苗为PCR扩增阳性对照菌株。
1.1.2 试剂 布氏琼脂粉购自英国Oxiod公司;马血清购自美国Thermo公司;细菌基因组DNA提取试剂盒、DNA胶回收试剂盒及PCR反应所用试剂购自北京康为世纪生物科技有限公司。
1.2 方法
1.2.1OMP25和OMP31 基因的PCR扩增和克隆 取保存的羊种布鲁氏菌NN1202株和LA1105株冻干菌种,每支菌种加入0.2 mL无菌水溶解,接种棒蘸取菌液接种于含10%马血清布氏琼脂斜面培养基,置于37 ℃的CO2培养箱培养 72 h。用细菌基因组DNA提取试剂盒提取细菌DNA,以细菌DNA为模板对[WTBX][WTBX]OMP25和OMP31 [STBZ]基因进行PCR扩增。以羊种布氏菌5号疫苗为阳性对照。PCR反应条件为:95 ℃ 5 min;95 ℃ 1 min,60 ℃(57 ℃) 1 min,72 ℃ 1 min,共35个循环;72 ℃ 10 min。扩增预期片段分别为650 bp和750 bp。引物序列分别为PM25-F:5′-GAATTCATGCGCACTCTTAAGTCTCTC-3′;OPM25-R:5′-GTCGACTTAGAACTTGTAGCCGATGCC-3′;OPM31 -F:5′-GCGAATTCATGAAGTCCGTAATT-3′;OPM31-R:5′-GCCTCGAGTTAGAACTTGTAGTT-3。引物由上海英骏生物技术有限公司合成。
DNA胶回收试剂盒纯化、回收目的片段后,与pMD-18T载体4 ℃过夜连接,转化大肠杆菌DH5α,PCR鉴定正确的阳性克隆送上海英骏生物技术有限公司测序。
1.2.2 OMP25和OMP31基因的核苷酸同源性分析 应用MegAlign软件对测序获得的OMP25和OMP31基因的核苷酸序列与GenBank上登录的已知序列进行同源性比较,分析它们之间的亲缘关系。
1.2.3 OMP25蛋白和OMP31蛋白二级结构分析 运用Garnier-Robson方法和Chou-Fasman方法分析OMP25蛋白和OMP31蛋白的α-螺旋、β-折叠、转角区域和卷曲区域 [10-11]。
1.2.4 OMP25蛋白和OMP31蛋白B细胞抗原表位分析 应用Kyte-Doolittle方法、Karplus-Schulz方法、Emini方法和Jameson-Wolf方法分析OMP25蛋白和OMP31蛋白的氨基酸亲水性、蛋白柔性区域、溶剂表面可及性和抗原指数,综合各方法的结果并结合B细胞表位网上预测(http://www.cbs.dtu.dk/services/BepiPred/)来分析OMP25蛋白和OMP31蛋白的B细胞抗原表位 [12-15]。
2 结果与分析
2.1OMP25和OMP31基因的PCR扩增
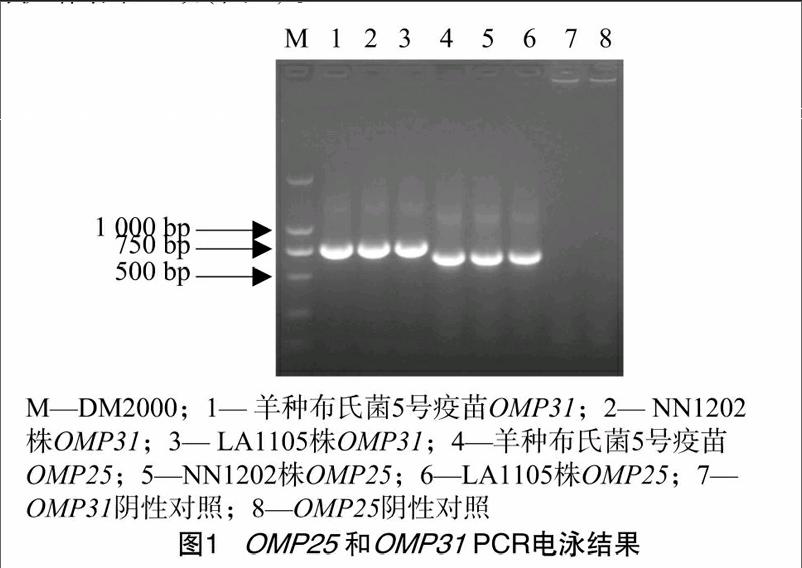
提取羊种布鲁氏菌NN1202株和LA1105株的DNA,分别对OMP25和OMP31 [STBZ]基因进行PCR扩增,得到650 bp和750 bp的扩增片段,大小与阳性对照羊种布鲁氏菌5号疫苗的扩增结果一致(图1)。
2.2 OMP25和OMP31 基因的核苷酸同源性分析
NN1202株和LA1105株的阳性OMP25质粒测序后证实扩增片段大小为650 bp,内含1个642 bp的开放阅读框,编码213个氨基酸,它们的核苷酸序列已登录GenBank,登录号分别为KJ720202和KJ720201。将它们的核苷酸序列与GenBank登录的相应序列进行同源性比较,NN1202株和LA1105株OMP25之间的同源性为100%,与羊种布鲁氏菌M5-90(CP001852)、猪种布鲁氏菌S2(CP006961)、牛种布鲁氏菌S19(CP000887)、犬种布鲁氏菌ATCC23365(CP000872)、绵羊附睾种ATCC25840(CP000708)的同源性均为100%。
NN1202株和LA1105株的阳性OMP31 质粒测序后证实扩增片段大小为750 bp,内含1个723 bp的开放阅读框,编码240个氨基酸,它们的核苷酸序列已登录GenBank,登录号分别为KJ720203和KJ720204。将它们的核苷酸序列与GenBank登录的相应序列进行同源性比较,NN1202株、LA1105株和羊种布鲁氏菌M5-90(CP001852)[OMP25 之间的同源性均为100%;与猪种布鲁氏菌S2(CP006961)、犬种布鲁氏菌ATCC23365(CP000872)、绵羊附睾种ATCC25840(CP000708)的同源性为99%。
2.3 OMP25蛋白和OMP31蛋白二级结构分析
综合Garnier-Robson方法和Chou-Fasman方法的分析,OMP25蛋白有4个α-螺旋区域(13~29、75~79、100~104、109~114),9个β-折叠区域(6~10、49~55、62~67、86~91、130~144、154~159、173~181、190~196、204~207)。在α-螺旋和β-折叠区域的间隙分布着长短不一的13个转角区域和11个卷曲区域(图2)。OMP31蛋白有4个α-螺旋区域(4~21、121~134、144~145、172~176),9个β-折叠区域(22~25、75~77、82~88、97~102、112~115、135~139、147~152、156~163、230~240)。在α-螺旋和β-折叠区域的间隙分布着长短不一的17个转角区域和12个卷曲区域(图3)。
2.4 OMP25蛋白和OMP31蛋白的氨基酸亲水性分析
Kyte-Doolittle方法分析表明,OMP25蛋白有较多的亲水[CM(25]性区域(≥0.5),分布较为均匀,主要有27~32、44~46、
2.5 OMP25蛋白和OMP31蛋白的柔性区域分析
2.6 OMP25蛋白和OMP31蛋白的溶剂表面可及性分析
Emini方法分析表明,59~63、70~75、101~107、177~189和196~202区域出现在OMP25蛋白溶剂表面可及性较大(≥1)(图8)。OMP31蛋白的溶剂表面可及性区域较少,只有2个区域(63~69和177~182)(图9)。
2.7 OMP25蛋白和OMP31蛋白的抗原指数分析
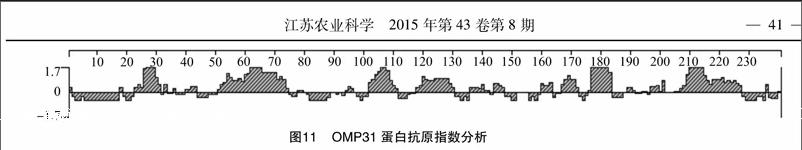
Jameson-Wolf方法分析表明,OMP25蛋白抗原指数较高的区域(≥0)有:26~33、56~65、68~75、93~99、101~105、117~127、143~156、165~179、183~190、195~207,以C端区域的抗原指数较高,跨度较大,存在抗原表位的可能性也较大(图10)。OMP31蛋白抗原指数较高的区域(≥0)分布较均匀,以23~33、51~75、102~111、118~130、136~147、167~173、177~184和206~227区域存在抗原表位的可能性较大(图11)。
2.8 OMP25蛋白和OMP31蛋白B细胞表位综合分析
应用Kyte-Doolittle方法、Karplus-Schulz方法、Emini方法和Jameson-Wolf方法并结合B细胞表位网上预测分析(http://www.cbs.dtu.dk/services/BepiPred/),OMP25蛋白的27~34、59~65、69~75、101~107、148~154、182~189、197~202[CM(21*2/3]区域以及OMP31蛋白的25~32、50~58、63~70、
102~111、125~130、166~173、176~183区域均具有较好的亲水性、柔性和溶剂表面可及性,抗原指数也较高,结合蛋白二级结构上含有容易形成抗原表位的转角和卷曲区域,因此,这些区域极有可能是OMP25蛋白和OMP31蛋白的优势B细胞抗原表位。
3 讨论
研究证实,布鲁氏菌[WTBX][STBX]OMP25和OMP31 基因是免疫原性基因,它们编码的蛋白对小鼠具有免疫保护作用 [6-7]。本研究对羊种NN1202株和LA1105株[WTBX][STBX]OMP25和OMP31 基因核苷酸同源性比较结果表明,[OMP25和OMP31 基因在布鲁氏菌种间高度保守,OMP25和OMP31蛋白可以作为布鲁氏菌合成肽疫苗的候选靶蛋白。
利用生物信息学技术对病原微生物的抗原蛋白二级结构和B细胞抗原表位进行分析是研制合成肽疫苗的基础 [16]。研究表明,B细胞抗原表位的形成取决于蛋白二级结构的形成。蛋白在形成立体构象时,多肽链中的α-螺旋和β-折叠的氢键键能高,形成稳定的刚性结构,在蛋白内部中起着“骨架”作用,不易与抗体结合,成为B细胞抗原表位的几率低。相反,转角和卷曲区域的氢键键能低,形成盘旋、扭曲等松散的柔性结构暴露在蛋白表面,与抗体结合的几率大,成为B细胞抗原表位的可能性高 [17]。此外,氨基酸的亲水性、极性也决定了其是否暴露在蛋白表面,因此,蛋白的亲水部位和溶剂表面可及性也与B细胞抗原表位有密切关系。
B细胞抗原表位的分析方法主要有蛋白二级结构分析、氨基酸亲水性分析、蛋白柔性区域分析、溶剂表面可及性分析 [10-14]。Jamson等将上述4种方法综合,以蛋白二级结构分析占40%、氨基酸亲水性分析占30%、蛋白柔性区域分析占15%、溶剂表面可及性分析占15%的计算模式,提出一种抗原指数分析法 [15]。根据该方法分析,发现OMP25蛋白的26~33、56~65、68~75、93~99、101~105、117~127、143~156、165~179、183~190、195~207区域以及OMP31蛋白的23~33、51~75、102~111、118~130、136~147、167~173、177~184和206~227区域存在抗原表位的可能性较大,但由于蛋白在形成立体构象时,蛋白表面的氨基酸会遮盖一些抗原指数较高的区域,使其不能成为优势抗原表位,因此,根据综合分析,笔者选择OMP25蛋白的27~34、59~65、69~75、101~107、148~154、182~189、197~202区域以及OMP31蛋白的25~32、50~58、63~70、102~111、125~130、166~173、176~183区域作为后续合成肽疫苗研究的靶位点。
参考文献:
[1] 陆承平. 兽医微生物学[M]. 4版.北京:中国农业出版社,2007:1-152.
[2]Cloeckaert A,Vizcaíno N,Paquet J Y,et al. Major outer membrane proteins of Brucella spp.:past,present and future[J]. Veterinary Microbiology,2002,90(1/4):229-247.
[3]Verstreate D R,Creasy M T,Caveney N T,et al. Outer membrane proteins of Brucella abortus:isolation and characterization[J]. Infection and Immunity,1982,35(3):979-989.
[4]曲 勍,王玉飞,徐 杰,等. 羊布鲁氏菌外膜蛋白质的组成鉴定[J]. 吉林大学学报:医学版,2009,35(5):805-811.
[5]Eschenbrenner M,Wagner M A,Horn T A,et al. Comparative proteome analysis of Brucella melitensis vaccine strain Rev 1 and a virulent strain 16M[J]. Journal of Bacteriology,2002,184(18):4962-4970.
[6]Bowden R A,Cloeckaert A,Zygmunt M S,et al. Evaluation of immunogenicity and protective activity in BALB/c mice of the 25-kDa major outer-membrane protein of Brucella melitensis (Omp25) expressed in Escherichia coli[J]. Journal of Medical Microbiology,1998,47(1):39-48.
[7]Cassataro J,Estein S M,Pasquevich K A,et al. Vaccination with the recombinant Brucella outer membrane protein 31 or a derived 27-amino-acid synthetic peptide elicits a CD+4 Thelper 1 response that protects against Brucella melitensis infection[J]. Infection and Immunity,2005,73(12):8079-8088.
[8]Bowden R A,Estein S M,Zygmunt M S,et al. Identification of protective outer membrane antigens of Brucella ovis by passive immunization of mice with monoclonal antibodies[J]. Microbes and Infection,2000,2(5):481-488.
[9]李 军,陈泽祥,杨 威,等. 广西家畜布鲁氏菌病的监测分析[J]. 中国人兽共患病学报,2012,28(7):754-758.
[10] Garnier J,Osguthorpe D J,Robson B. Analysis of the accuracy and implications of simple methods for predicting the secondary structure of globular proteins[J]. Journal of Molecular Biology,1978,120(1):97-120.[HJ1.8mm]
[11]Chou P Y,Fasman G D. Prediction of the secondary structure of proteins from their amino acid sequence[J]. Advances in Enzymology and Related Areas of Molecular Biology,1978,47:45-148.
[12]Kyte J,Doolittle R F. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology,1982,157(1):105-132.
[13]Karplus P A,Schulz G E. Prediction of chain flexibility in proteins[J]. Naturwissenschaften,1985,72(4):212-213.
[14]Emini E A,Hughes J V,Perlow D S,et al. Induction of hepatitis a virus-neutralizing antibody by a virus-specific synthetic peptide[J]. Journal of Virology,1985,55(3):836-839.
[15]Jameson B A,Wolf H. The antigenic index:a novel algorithm for predicting antigenic determinants[J]. Computer Applications in the Biosciences,1988,4(1):181-186.
[16]张洪勇,金宁一. 合成肽疫苗的分子设计[J]. 生物技术通讯,2003,14(2):145-147.
[17]来鲁华. 蛋白质的结构预测与分子设计[M].
