玉米大斑病菌黑色素合成调控基因StMR1回复载体的构建
2015-09-10贾慧等
贾慧等
摘要: 为研究玉米大斑病菌黑色素合成调控基因[WTBX][STBX]StMR1[WTBZ][STBZ]的功能,采用PCR方法克隆得到[WTBX][STBX]StMR1[WTBZ][STBZ]基因3 021 bp的OFR序列,将其插入到含有色氨酸强启动子、GFP和bar基因抗性的质粒pBARKS1-eGFP上构建回复载体pBARKS1-MR-eGFP,通过测序、双酶切验证载体构建情况。结果显示,pBARKS1-MR-eGFP载体构建成功,可以进行基因回复转化试验。该结果为进一步确定黑色素合成调控途径,进而明确黑色素合成调控机制奠定基础。
关键词: 玉米大斑病菌;黑色素;调控基因;[WTBX][STBX]StMR1[WTBZ][STBZ]
中图分类号: S435.131.4+9 文献标志码: A
文章编号:1002-1302(2015)08-0024-03
玉米大斑病在世界范围内广泛存在,是我国冷凉地区如东北、华北和西南玉米区重要叶部病害 [1-2],种植感病品种如遇到流行年份可减产50%以上。例如,2012年受布拉万台风的影响,东北地区潮湿多雨,玉米大斑病大暴发,平均危害程度3~5级,严重地块达9级。引起该病害的病原菌属半知菌突脐蠕孢属,1876年在意大利首次报道,其无性态为玉米大斑凸脐蠕孢菌(Exserohilum turcicum),有性态为玉米大斑病菌(Setosphaeria turcica)。有研究发现,玉米大斑病菌代谢产生的DHN黑色素是该病菌致病的重要毒力因子,沉积在真菌特化结构、附着在胞细胞壁和细胞膜之间,产生机械压力突破寄主表皮细胞,使植物染病 [3]。
DHN黑色素合成途径至少有聚酮体合成酶、还原酶、脱水酶、氧化酶4类蛋白酶参与。起始于1个聚酮体合成酶(polyketide synthase),催化醋酸盐合成1,3,6,8-4THN,经还原酶(1,3,6,8-tetra-HN reductase)催化合成小柱孢酮(scytalone),脱水酶(scytalone dehydratase)催化合成1,3,8-THN,还原酶(1,3,8-tetra-HN reductase)催化合成柱孢醌(vermelone),再经脱水酶催化合成1,8-DHN,最后经氧化酶(laccase)氧化聚合形成1,8-DHN黑色素。另外,该途径中还存在一种调控黑色素生物合成的转录因子MR [4]。研究发现,调控黑色素合成的转录因子能够调节黑色素合成途径中的多个关键酶基因的表达,进而影响黑色素的生成,改变病原菌致病力。水稻胡麻斑病菌(Bipolaris oryzae)中黑色素合成调控基因[WTBX][STBX]BMR1突变后,菌落颜色变白,过表达菌株的BMR1[WTBZ][STBZ]表达量高于野生型的10倍 [5]。葫芦刺盘孢(Colletotrichum lagenarium)和稻瘟病菌(Magnaporthe grisea)中Cmr1p和Pig1p是黑色素合成转录因子,编码基因[WTBX][STBX]Cmr1和Pig1[WTBZ][STBZ]突变后病原菌的黑色素合成受到影响,回复突变后,病原菌生长表型与野生型相似,说明功能回复到正常水平 [4]。甘蓝链格孢(Alternaria brassicicola)黑色素合成调控基因[WTBX][STBX]Amr1[WTBZ][STBZ]突变后,病原菌菌落颜色变浅,接种白菜叶片发现致病力较野生型增强 [6]。同时,文献报道,丝状真菌中黑色素合成酶基因缺失或沉默,黑色素合成则会受到影响,病原菌的致病力也有不同程度的变化 [7]。玉米大斑病菌中聚酮体合成酶基因(StPKS)RNAi的几株转化子黑色素合成受到不同程度的干扰 [8];玉米大斑病菌中HN还原酶基因([WTBX][STBX]3HNR[WTBZ][STBZ])突变则形成浅褐色突变菌株 [9];玉米小斑病菌(Cochliobolus heterostrophus)脱水酶基因([WTBX][STBX]scl1[WTBZ][STBZ])缺失后形成橙红色菌落 [10];条件致病真菌新型隐球酵母菌(Cryptococcus neoformans)氧化酶基因[WTBX][STBX]LAC1缺失后,菌落颜色发生了变化,而同工酶基因LAC2的转录水平远远低于LAC1[WTBZ][STBZ]基因,该基因缺失后,病原菌黑色素合成速度延迟,合成量并未受到影响 [11]。目前,以抑制黑色素合成过程中从1,3,6,8-四羟基萘到小柱孢酮、1,3,8-三羟基萘到柱孢醌的2步脱氢反应的2个还原酶为靶点开发的特异性抑制剂——三环唑(tricyclazole)作为新型杀菌剂防治稻瘟病菌,有良好效果 [12]。本研究室前期克隆到黑色素合成调控基因[WTBX][STBX]StMR1[WTBZ][STBZ],利用基因敲除技术获得了该基因的2株基因缺失突变体,初步分析了突变体的生长发育、黑色素合成及致病性等与野生型的差别,初步明确了该基因的功能,发现[WTBX][STBX]StMR1[WTBZ][STBZ]基因缺失后,病原菌生长速度没有明显变化,黑色素含量显著降低,致病力明显减弱。本试验在前期研究的基础上构建[WTBX][STBX]StMR1[WTBZ][STBZ]基因回复载体,从而对[WTBX][STBX]StMR1[WTBZ][STBZ]基因功能及黑色合成调控机制进行深入研究,以阐明玉米大斑病菌的致病机制,也可以为研发新型杀菌剂、探索新的防治途径提供理论基础。
1 材料与方法
1.1 试验材料
玉米大斑病菌菌株01-23、pBARKS1-eGFP载体、大肠杆菌(Eschrichia coli)DH5α感受态细胞、SDS碱裂解溶液(溶液Ⅰ、Ⅱ、Ⅲ),由河北农业大学真菌毒素与植物分子病理学实验室保存或配制;UNIQ-10柱式Trizol RNA提取试剂盒、反转录试剂盒、DNA凝胶回收试剂盒、DEPC、DNaseⅠ(RNase free)、RNasin、dNTP Mixture、限制性内切酶、Taq DNA聚合酶、T4-DNA连接酶,购自宝生物(大连)有限公司;引物的合成和测序由上海生工生物工程技术服务有限公司完成。
1.2 总RNA的提取
参照UNIQ-10柱式Trizol总RNA抽提试剂盒说明书,取经PD液体培养基21 ℃、黑暗培养7 d的玉米大斑病菌菌丝,滤纸吸干,取0.1 g用液氮研磨成粉末,转移至1.5 mL离心管中,加入Trizol试剂 1 mL,并用枪头反复吹打,室温放置5~10 min,使核蛋白与核酸完全分离;加入200 μL三氯甲烷 ∶ 异戊醇(24 ∶ 1)剧烈振荡30 s,室温放置3 min,12 000 r/min 4 ℃离心10 min;吸取上层水相转移至干净离心管中,加入 1/2 体积无水乙醇,混匀;将吸附柱放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部加至吸附柱中,静置 2 min,12 000 r/min 离心3 min,倒掉收集管中废液;将吸附柱放入收集管中,加入500 μL RPE Solution,静置 2 min,10 000 r/min 离心30 s,倒掉收集管中废液(检查RPE Solution是否已经按比例加入无水乙醇),此步骤重复1次;将吸附柱放回收集管中,10 000 r/min离心2 min,将残余的乙醇去除;将吸附柱加入干净的1.5 mL离心管中,在吸附膜中央加入30 μL DEPC-treated ddH2O,静置5 min,12 000 r/min离心2 min,提取得到RNA样品溶液,-80 ℃超低温冰箱中保存备用。配制10%琼脂糖凝胶,电泳检测得到的总RNA的纯度及完整性;紫外分光光度计检测其浓度和纯度。
1.3 反转录合成第一链cDNA
反转录反应:1 μg模板RNA,1 μL Oligo (dT)12~18 Primer(50 μmol/L),RNase free ddH2O补充至6 μL,70 ℃保温 10 min 后迅速在冰上急冷2 min以上,离心数秒使模板RNA/引物的变性溶液聚集于微管底部;在该微管中加入5×M-MLV buffer 2 μL,dNTP Mixture(10 mmol/L) 0.5 μL,RNase Inhibitor(40 U/μL)0.25 μL,RTase M-MLV(RNase H-,200 U/μL)0.25~1 μL,RNase free ddH2O补充至 10 μL;42 ℃保温1 h,70 ℃灭活反转录酶活性15 min,插冰上冷却;反应合成第一链cDNA,-20 ℃保存备用。
1.4 基因ORF序列的获得
分析 基因序列的酶切位点,根据载体pBARKS1-eGFP上的多克隆位点,设计带有酶切位点NotⅠ和SmaⅠ的特异引物MGF、MGR,扩增 基因的ORF序列。
扩增体系:2 μL模板cDNA,MGF(10 μmol/L)1.0 μL,MGR(10 μmol/L)1.0 μL,2.5 μL 10×Taq buffer(Mg 2+Plus),2 μL dNTP Mixture(2.5 mmol/L),0.3 μL Taq DNA聚合酶(5 U),ddH2O 16.2 μL。
扩增程序:95 ℃ 预变性5 min;94 ℃变性 30 s,61 ℃ 退火30 s,72 ℃延伸4 min,35个循环;72 ℃ 延伸10 min。用1%琼脂糖凝胶电泳检测PCR扩增产物,紫外凝胶成像仪(Bio-Rad)观察结果显示,DNA凝胶回收试剂盒切胶回收PCR扩增产物。
1.5 基因回复载体的构建
将回收PCR扩增产物和pBARKS1-eGFP载体用 SmaⅠ、NotⅠ双酶切,酶切体系为pBARKS1-eGFP质粒DNA 2 μL(PCR回收产物5 μL),SmaⅠ、NotⅠ各1 μL,缓冲液 2 μL,ddH2O补充至10 μL,37 ℃酶切3 h。酶切产物用1%琼脂糖凝胶电泳检测并回收线性[JP2]质粒片段和PCR产物。然后进行连接反应,反应体系为PCR扩增产物5 μL、pBARKS1- eGFP线性质粒 1 μL、T4连接酶(350 U/μL)1 μL、10×ligation buffer 1 μL(终浓度为1×),用dd H2O补至10 μL,最适连接温度为 16 ℃,时间为1~3 h或过夜;将连接产物转化感受态细胞大肠杆菌DH5α,37 ℃培养过夜,随机挑取白色单菌落于5 mL LB液体培养基(含100 μg/mL Amp+)[JP2]中,37 ℃、220 r/min 下振荡培养5~6 h;取2 μL菌液作模板,利用pBARKS1-eGFP载体上的通用引物T3/T7和特异引物MGF/MGR进行PCR检测;选取PCR检测阳性的单克隆测序;将测序正确的阳性克隆命名为pBARKS1-MR-eGFP。
2 结果与分析
2.1 玉米大斑病菌总RNA的提取
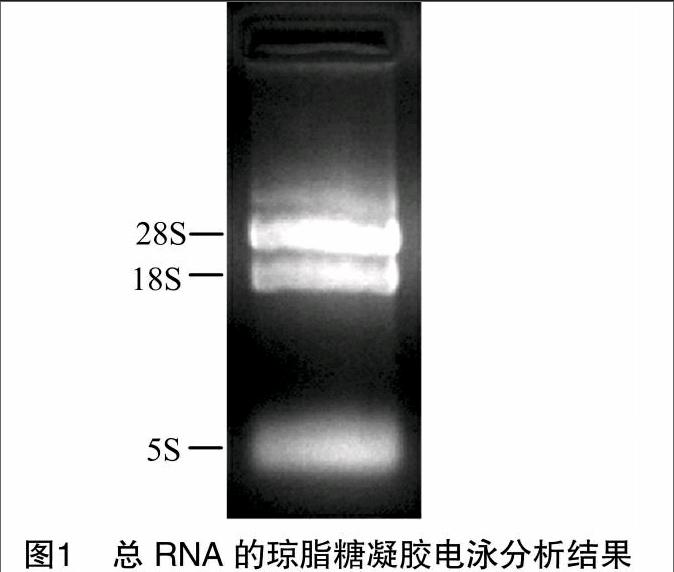
利用UNIQ-10柱式Trizol总RNA提取试剂盒提取PD培养7 d的玉米大斑病菌菌体的总RNA,紫外分光光度计测定D260 nm/D280 nm=1.98,浓度为35.7 μg/μL,表明所提取的总RNA质量较好、无蛋白质、DNA及小分子的污染。琼脂糖凝胶电泳检测,结果显示28S、18S、5S特征条带清晰(图1),说明总RNA质量较好,无降解,可以用于cDNA第一链的合成。
2.2 基因ORF序列的扩增
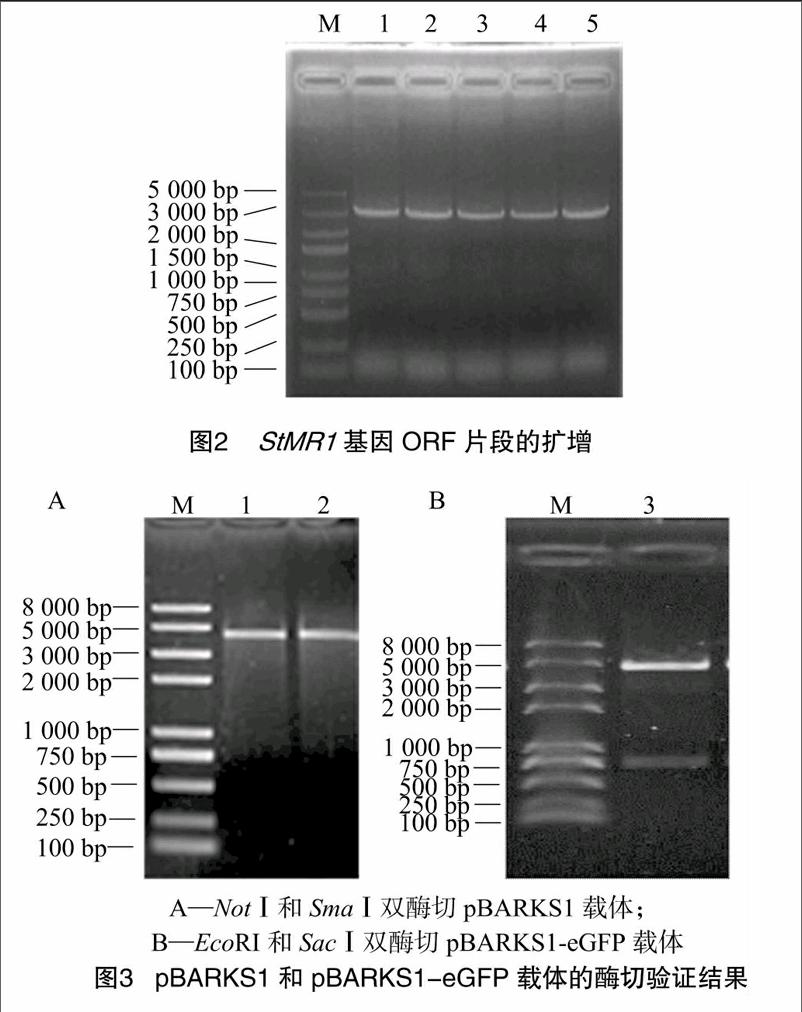
利用 基因序列的酶切位点,结合载体质粒pBARKS1-eGFP上的多克隆位点,最终选用限制性内切酶NotⅠ和SmaⅠ,设计1对带有酶切位点的特异引物,以反转录的cDNA为模板,扩增 基因ORF序列,得到3 021 bp的条带,与预期大小相符(图2)。
2.3 pBARKS1和pBARKS1-eGFP载体的酶切验证
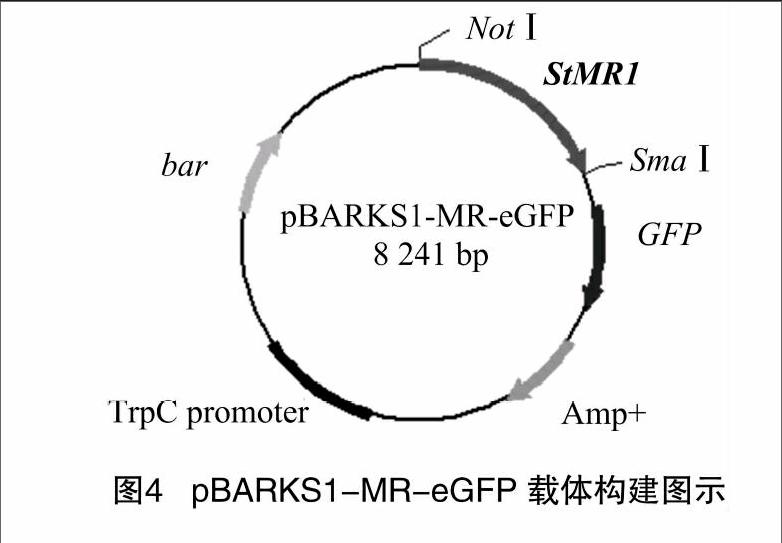
提取pBARKS1载体质粒,用NotⅠ和SmaⅠ进行双酶切,得到线性质粒,琼脂糖凝胶电泳检测结果显示有单一的 4 500 bp 条带(图3-A);提取pBARKS1-eGFP载体质粒,用EcoRⅠ和SacⅠ进行双酶切,得到线性载体pBARKS1和GFP片段,琼脂糖凝胶电泳检测显示有4 500、720 bp 等2条条带(图3-B)。说明pBARKS1-eGFP质粒载体正确。
2.4 回复载体的构建
将PCR产物分别和pBARKS1-eGFP用NotⅠ和SmaⅠ进行双酶切,回收目的片段后将带有相同黏性末端的PCR产物和线性的pBARKS1-eGFP连接,转化大肠杆菌感受态细胞DH5α,转化后选择白色单克隆进行菌液检测,引物用载体通用引物T3/T7和特异引物MGF/MGR进行PCR扩增验证,挑取阳性克隆进行测序,结果正确,得到pBARKS1-MR-eGFP重组载体(图4)。载体pBARKS1-MR-eGFP全长约8 241 bp,NotⅠ与SmaⅠ双酶切得到大小为5 220、3 021 bp的条带,结果均与预期大小相符(图5),玉米大斑病菌黑色素调控基因 的基因回复表达载体构建成功。
3 结论与讨论
目前,随着DNA测序技术的飞速进步,很多丝状真菌已经完成了基因组测序工作,对其研究已步入后基因组时代,分析和确定基因的功能及关联性正成为分子生物学及遗传学研究[CM(25]的热点 [13]。研究真菌基因功能的方法有很多种,如基因敲[CM)]
除/置换(gene knockout )、RNA干扰(RNA interference,RNAi)、基因标记(gene tagging)、基因超表达(over expression)、体外转座子标记(in vitro transposon tagging)、异源表达(heterologous expression)和酵母双杂交(yeast two-hybrid system)等。基因敲除技术是一种遗传工程修饰技术,某个基因一旦被确定有研究价值,往往最为直接的方式之一就是将其从基因组中敲除或置换,而后测定相关指标,明确其功能 [14]。该技术是通过同源重组的方法将外源基因定点整合入靶细胞基因组上某一确定的位置,经过外源DNA序列与靶细胞内染色体上同源DNA序列间的重组或置换,达到定点修饰改造染色体上某一基因的目的,从而改变细胞的遗传特性 [15]。回复突变(reverse mutation)指基因缺失突变体经过第2次突变又完全或部分恢复为原来的基因型和表现型,基因超表达指目的基因的全长序列与高活性组成型启动子或组织特异性启动子融合,通过转化,获得该基因编码产物大量积累,这2种技术的应用更丰富了基因功能研究的证据。研究方案中通常会设计创制基因敲除突变体、回复突变体和超表达突变体。笔者所在实验室前期克隆到玉米大斑病菌黑色素合成调控基因 序列,并创制了基因敲除突变体(结果待发表),在此基础上,本试验构建了含有色氨酸强启动子、绿色荧光蛋白编码基因GFP和草胺磷抗性基因bar的回复载体pBARKS1-MR-eGFP,可将重组的载体通过PEG介导转化玉米大斑病菌黑色素合成基因 缺失突变体的原生质体,或玉米大斑病菌野生型菌株的原生质体,利用草胺磷抗性培养基继代培养获得草胺磷抗性转化子,通过分析bar基因、GFP基因及2个同源臂DNA序列设计特异引物,对转化子进行PCR初步筛选,将筛选的转化子用bar基因和GFP基因为探针进行Southern blot验证是否为该基因的回复突变体或超表达突变体,并对该突变菌株进行各项研究分析,如表型分析,附着胞形成能力及穿透能力、毒素产生能力、分生孢子萌发及突变菌株的侵染能力等,从而对 基因功能进行深入研究。另外,该载体含有绿色荧光蛋白基因GFP,在生物体内可以表达绿色荧光蛋白,通过荧光显微镜(荧光共聚焦显微镜)定位目的蛋白的位置。
参考文献:
[1] [JP3]王会伟,李洪杰,朱振东,等. Ht2背景下玉米对大斑病菌1号小种抗[JP2]性基因的表达差异研究[J]. 植物病理学报,2010,2(2):135-143.
[2][JP3]郭丽媛,贾 慧,曹志艳,等. 玉米大斑病菌有性杂交后代的交配型与 寄生适合度分化[J]. 中国农业科学,2013,46(19):4058-4065.
[3] 范永山,谷守芹,董金皋,等. MAPK途径对玉米大斑病菌HT-毒素产生和生物学活性的调控作用[J]. 中国农业科学,2008,1(9):86-92.
[4]Tsuji G,Kenmochi Y,Takano Y,et al. Novel fungal transcriptional activators,[WTBX][STBX]Cmr1p[WTBZ][STBZ] of Colletotrichum lagenarium and [WTBX][STBX]Pig1p[WTBZ][STBZ] of Magnaporthe grisea,contain [WTBX][STBX]Cys2His2[WTBZ][STBZ] zinc finger and Zn(Ⅱ)2Cys6 binuclear cluster DNA-binding motifs and regulate transcription of melanin biosynthesis genes in a developmentally specific manner[J]. Molecular Microbiology,2000,38(5): 940-954.[HJ1.65mm]
[5]Kihara J,Moriwaki A,Tanaka N,et al. Characterization of the [WTBX][STBX]BMR1[WTBZ][STBZ] gene encoding a transcription factor for melanin biosynthesis genes in the phytopathogenic fungus Bipolaris oryzae[J]. FEMS Microbiology Letters,2008,281(2):221-227.
[6]Cho Y,Srivastava A,Ohm R A,et al. Transcription factor [WTBX][STBX]Amr1[WTBZ][STBZ] induces melanin biosynthesis and suppresses virulence in Alternaria brassicicola[J]. PLoS Pathogens,2012,8(10): e1002974.
[7]曹志艳,于 清,范永山,等. 玉米大斑病菌黑色素缺失突变体的获得及其生物学特性[J]. 植物保护学报,2007,34(3):268-272.
[8]张 鑫,曹志艳,刘士伟,等. 玉米大斑病菌聚酮体合成酶基因StPKS功能分析[J]. 中国农业科学,2011,44(8):1603-1609.
[9][JP2]Xue C S,Wu D L,Condon B J,et al. Efficient gene knockout in the maize pathogen Setosphaeria turcica using Agrobacterium tumefaciens-[JP3]mediated transformation[J]. Phytopathology,2013,103(6): 641-647.
[10] Saitoh Y,Izumitsu K,Morita A,et al. Cloning of [WTBX][STBX]Sal1[WTBZ][STBZ],a scytalone dehydratase gene involved in melanin biosynthesis in Cochliobolus heterostrophus[J]. Mycoscience,2012,53(4):330-334.
[11]Pukkila-Worley R,Gerrald Q D,Kraus P R,et al. Transcriptional network of multiple capsule and melanin genes governed by the Cryptococcus neoformans cyclic AMP cascade[J]. Eukaryotic Cell,2005,4(1):190-201.
[12]郭欣欣,贾 慧,曹志艳,等. 特异性抑制剂三环唑对玉米大斑病菌致病力的影响[J]. 植物保护学报,2012,39(4):364-368.
[13]许 杨,涂 追. 丝状真菌基因敲除技术研究进展[J]. 食品与生物技术学报,2007,26(1):120-126.
[14]Weld R J,Plummer K M,Carpenter M A,et al. Approaches to functional genomics in filamentous fungi[J]. Cell Research,2006,16(1):31-44.
[15]Capecchi M R. Altering the genome by homologous recombination[J]. Science,1989,244:1288-1292.
