鸭肝脏基因早期发育表达
2015-09-10宋迟宋卫涛胡艳等
宋迟 宋卫涛 胡艳等

摘要: [WTBX][STBX]IGF1 是重要的生长调控因子,在胚后生长发育过程中的主要来源为肝脏。以高邮鸭、金定鸭2个地方鸭品种为研究对象,对胚胎期和出雏早期鸭肝脏[WTBX][STBX]IGF1 mRNA的表达规律进行了比较研究。采用荧光定量PCR和原位杂交技术研究了鸭13、17、21、25、27胚龄和出雏后7 d肝脏[WTBX][STBX]IGF1 mRNA的表达情况。结果表明,2个品种鸭肝脏[WTBX][STBX]IGF1 mRNA在13胚龄均已有少量表达,到出雏前鸭肝脏[WTBX][STBX]IGF1 表达量显著增高,7 d时,[WTBX][STBX]IGF1 mRNA在高邮鸭肝脏的表达量显著高于金定鸭。原位杂交结果显示,肝脏循环系统中[WTBX][STBX]IGF1 mRNA的表达明显高于周边肝脏组织。肝脏[WTBX][STBX]IGF1 mRNA的表达可能在鸭早期发育过程中发挥着重要作用。
关键词: 鸭;肝脏;[WTBX][STBX]IGF1 基因;早期发育;原位杂交
中图分类号: S834.2 文献标志码: A
文章编号:1002-1302(2015)08-0042-03
动物骨骼肌的发生、生长在胚胎期即受到严格的调控,生长激素等可通过胰岛素样生长因子(insulin-like growth factors,IGFs)发挥对动物生长的调控作用 [1-3]。 IGF1可以通过与靶器官上的IGFs受体( insulin-like growth factor receptor, 结合,从而促进蛋白合成,影响肌肉干细胞增殖、成肌细胞分化以及肌管融合等,起到促进动物骨骼肌生长发育的作用 [4]。研究表明,在肌肉中过表达 IGF1 基因,会引起肌纤维肥大,蛋白合成增加,促进成肌细胞增殖。Mitchell等在鸡胚发育的24期通过逆转录病毒转入 IGF1 基因,使基因过表达,结果发现鸡腿肌明显增大,肌纤维数增多 [5]。Scanes 等研究发现,51 d时快长型雏鸡血清中 IGF1 水平显著高于慢长型鸡 [6]。除胚胎期外,肝脏是动物体内 IGF1 最主要的来源 [7]。目前,关于鸭胚胎期 IGF1 发育变化研究较少。葛盛芳等研究发现,12 d胚龄的高邮鸭鸭胚血清中可检测到 IGF1 ,生长速度较快的高邮鸭血清中 IGF1 浓度高于生长速度较慢的绍兴蛋鸭,但是鸭胚胎期及胚后发育早期肝脏中 IGF1 mRNA表达情况尚待研究 [8]。高邮鸭、金定鸭是我国地方鸭品种,这2个品种在生长速度上存在明显表型差异。本研究以高邮鸭、金定鸭为研究对象,采用实时荧光定量分析技术、原位杂交技术,对鸭胚胎期肝脏中 IGF1 mRNA表达进行探讨,研究我国不同地方鸭品种 IGF1 基因在生理水平上的差异,旨在为我国地方鸭品种资源合理利用提供依据。
1 材料与方法
1.1 材料
试验种蛋收集自相同日粮水平饲喂的同日龄高邮种鸭、金定种鸭群。2个品种的种蛋在相同条件下(温度为37.5~37.8 ℃,相对湿度为50%~70%)同时孵化,雏鸭出雏后饲喂相同饲料至7 d。种蛋入孵后24 h设定为1胚龄。分别于13、17、21、25、27 d胚龄以及出雏后7 d等6个时间点采集肝脏样品,迅速放于液氮中速冻,之后转入-80 ℃超低温冰箱保存,每品种在每个采样时间点采集16份样品。
1.2 主要试剂和仪器
原位杂交试剂盒购自湖北博士德公司,寡核苷酸探针序列为5′-AAGGAAGTACAAGAACGCAAGTAGA-3′。[JP2]TRNzol-A+总RNA提取试剂(DP421)、SuperReal PreMix(SYBR Green,FP204-01)、Quant cDNA 第一链合成试剂盒(QuantScript RT Kit,KR103-04)、pGM-T克隆试剂盒(VT302-02)、 质粒小提试剂盒(TIANprep Mini Plasmid Kit,DP103-02)、DNA产物纯化回收试剂盒(TIANquick Midi Purification Kit,DP204-02)等购自天根生化科技(北京)有限公司;DNA Marker DL 2000购自TaKaRa公司;9700PCR仪、Leica冰冻切片机、Mx3000p荧光定量PCR仪购自安捷伦公司。
1.3 总RNA提取和cDNA合成
按TRNzol-A+总RNA提取试剂操作说明书提取肝脏总RNA。RNA 样品经1.4%琼脂糖凝胶电泳分析和紫外分光光度计测定浓度,保证提取的RNA 样品质量合格。取2 μg总RNA,cDNA 第一链的合成按照天根生化科技(北京)有限公司的反转录试剂盒说明书进行操作,用内参基因β-actin检测cDNA合成质量以及是否有基因组DNA污染。RT产物于-20 ℃保存,用于PCR检测。
1.4 引物设计、目的片段标准品的制备
据GenBank中鸭EU031044序列设计 IGF1 定量试验引物,由生工生物工程(上海)股份有限公司合成。引物序列为:上游引物5′-CTGGTTGATGCTCTTCAGTTCGTAT-3′;下游引物 5′-GCAGACTTAGGTGGCTTTATTGGA-3′,扩增片段为182 bp。退火温度60 ℃,PCR产物经2%琼脂糖凝胶鉴定后回收目的片段,与pGM-T载体连接,转化,挑选阳性克隆过夜培养,测序。测序正确的克隆进行质粒提取,测定浓度后作标准品备用。
1.5 荧光实时定量PCR
荧光定量PCR采用SYBR Green I法,含 IGF1 基因的标准质粒做10n(n=7~13)梯度稀释。将梯度稀释的标准品和待测样品同时进行定量PCR,每次反应均设阴性对照,每个样品设置3次重复。根据由标准质粒构建的标准曲线进行计算,获得待测样品目的基因拷贝数。
1.6 原位杂交
肝脏组织样品的冰冻切片按照原位杂交试剂盒(博士德公司)使用说明进行杂交试验操作,最后进行DAB显色液显色并使用苏木精染液复染,封片,保存并拍照。
1.7 统计分析
运用SPSS软件分析基因在同一品种不同发育时期以及不同品种同一发育时期表达差异,所有数据以平均值±标准误表示,P< 0.05表示差异显著;P< 0.01表示差异极显著。
2 结果与分析
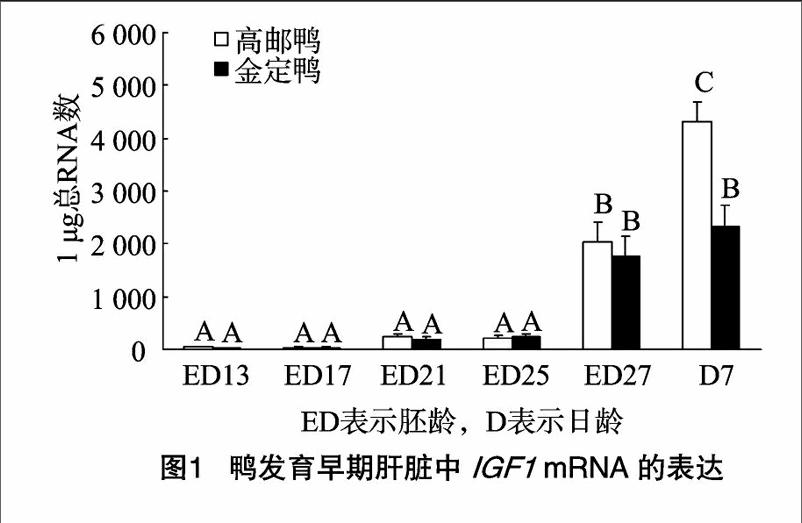
鸭早期发育过程中肝脏中 IGF1 mRNA的表达如图1所示, IGF1 基因在肝脏组织不同发育时段均表达,呈持续上升态势,并且在2个品种中的表达量变化趋势较为一致,在13、17胚龄时1 μg总RNA中拷贝数为101数量级,在21、25胚龄时拷贝数上升为102数量级,27胚龄时拷贝数上升为103数量级,出雏后表达量进一步上升。高邮鸭中,27胚龄的表达量极显著高于之前4个时间点,7 d的表达量极显著高于其他5个时间点;金定鸭中,27胚龄、7 d的表达量均极显著高于之前4个时间点,与高邮鸭不同的是,金定鸭27胚龄、7 d的 IGF1 mRNA表达量差异不显著。2个品种间7 d的表达量差异极显著,7 d高邮鸭肝脏IGF-I的拷贝数近似于金定鸭的2倍。
[FK(W11][TPSC1.TIF]
原位杂交结果显示,7 d与27胚龄2个时间点,高邮鸭和金定鸭原位杂交信号较强的部位均为血管组织,25、21胚龄2个时间点的原位杂交则没有明显的阳性信号(图2)。
3 结论与讨论
本研究探讨高邮鸭、金定鸭2个不同品种鸭胚胎期和出雏早期肝脏 IGF1 mRNA的表达规律,发现该基因在13胚龄已有少量表达,这种低表达状态持续至25胚龄,直到27胚龄时显著提高,并且出雏后 IGF1 mRNA的表达进一步提高。所
[FK(W22][TPSC2.TIF]
检测的2个品种鸭肝脏组织中 IGF1 mRNA在不同发育时段均表达,呈持续上升态势,说明不同品种鸭生命早期的肝脏组织中 IGF1 mRNA的表达发育模式基本一致。7 d高邮鸭肝脏 IGF1 的拷贝数极显著高于金定鸭,这可能是高邮鸭和金定鸭体质量差异较大的原因之一 [9]。Serrano等发现,在鸡中直到18胚龄时才可以检测到 IGF1 mRNA的微量表达 [10]。本研究荧光定量PCR检测结果显示,鸭胚肝脏中 IGF1 mRNA的表达要早于鸡胚,13胚龄时鸭胚肝脏已经有 IGF1 mRNA的微量表达,胚胎发育末期,肝脏中 IGF1 mRNA的表达已经显著提高,这一结果表明,禽类胚胎期肝脏 IGF1 mRNA的表达存在一定的种间差异。鸡胚胎发育期间 IGF1 主要来源于肝外组织,出雏后 IGF1 主要来源于肝组织,在鸭肝脏中 IGF1 在临近出雏时开始大量表达,为出雏后成为 IGF1 的主要来源打下基础 [11]。 IGF1 是动物体重要的生长调控因子,通过自分泌及旁分泌方式发挥作用 [12]。因此,对 IGF1 在组织器官中的局部表达部位和模式进行研究,有助于解释 IGF1 在动物体生长发育中的调控机制。Juengel等在牛、大鼠的血管壁细胞中检测到 IGF1 基因表达产物 [13]。Patrick等在负鼠卵巢血管壁细胞中发现 IGF1 表达 [14]。宋卫涛等在鸭胚胎腿肌中发现, IGF1 基因mRNA在血管壁周围的表达水平高于血管周边组织 [15]。这些杂交部位主要由纤维细胞或间充质细胞构成,广泛分布并融入各个组织和器官中,是 IGF1 通过旁分泌对周围靶细胞发挥作用的理想表达部位 [16]。小鼠模型结果显示,敲除肝脏 IGF1 基因的小鼠血液中 IGF1 浓度下降75%,小鼠仍能正常生长 [17],循环系统等肝外组织产生的 IGF1 对小鼠生长发育可能有重要影响。本研究所关注的发育时间点中, IGF1 在肝脏循环系统中的表达量要高于周边的肝组织,这一表达方式对鸭胚及出雏后生长发育的影响和具体的分子机制还需要进一步研究。
参考文献:
[1] 韦 敏,汝文文,吕 晔. 衰老情况下大鼠卵巢及子宫组织胰岛素样生长因子(IGFs)系统基因的表达变化[J]. 江苏农业科学,2013,41(6):21-24.
[2]Delafontaine P K E,Alexander R W. Insulin-like growth factor Ⅰ gene expression in vascular cells[J]. Hypertension,1991,17(5):693-699.
[3]俞亚波,王金玉,顾玉萍,等. 鸡IGFBP-3基因C1087T位点遗传多态性及其对京海黄鸡体重和产蛋性能的遗传效应[J]. 江苏农业学报,2013,29(2):359-364.
[4]Frost R A,Lang C H. Multifaceted role of insulin-like growth factors and mammalian target of rapamycin in skeletal muscle[J]. Endocrinology and Metabolism Clinics of North America,2012,41(2):297-322.
[5]P J Mitchell S E,Hannon K. Insulin-like growth factor I stimulates myoblast expansion and myofiber development in the limb[J]. Developmental Dynamics,2002,223(1):12-23.
[6]Scanes C G,Dunnington E A,Buonomo F C,et al. Plasma concentrations of insulin like growth factors (IGF-)Ⅰ and IGF-Ⅱ in dwarf and normal chickens of high and low weight selected lines[J]. Growth,Development,and Aging,1989,53(4):151-157.
[7]Otto A,Patel K. Signalling and the control of skeletal muscle size[J]. Experimental Cell Research,2010,316(18):3059-3066.
[8]葛盛芳,赵茹茜,陈伟华,等. 绍兴蛋鸭和高邮鸭胚胎发育过程中激素水平的变化[J]. 南京农业大学学报,2000,23(1):63-66.
[9]胡 艳,宋 迟,宋卫涛,等. 鸭发育早期肝脏 IGF-1 mRNA的表达特异性及其与体质量的相关性分析[J]. 南京农业大学学报,2013,36(6):95-99.
[10] Serrano J,Shuldiner A R,Roberts C T,et al. The insulin-like growth factor-Ⅰ (IGF-[QX(Y15]Ⅰ[QX)]) gene is expressed in chick-embryos during early organogenesis[J]. Endocrinology,1990,127(3):1547-1549.
[11][JP3]Depablo F,Robcis H L,Caldes T,et al. Insulin-like growth factor-Ⅰ and insulin as growth and differentiation factors in chicken embryogenesis[J]. Poultry Science,1991,70(8):1790-1796.
[12]Bondy C A,Cheng C M. Signaling by insulin-like growth factor Ⅰ in brain[J]. European Journal of Pharmacology,2004,490(1/2/3):25-31.
[13]Juengel J L,Haydon L J,Mester B,et al. The role of IGFs in the regulation of ovarian follicular growth in the brushtail possum (Trichosurus vulpecula)[J]. Reproduction,2010,140(2):295-303.
[14]Patrick C W J,Mcintire L V. Shear stress and cyclic strain modulation of gene expression in vascular endothelial cells[J]. Blood Purification,1995,13(3/4):112-124.
[15]宋卫涛,宋 迟,李慧芳,等. 鸭出雏前后腿肌IGF-1基因表达规律研究[J]. 云南农业大学学报,2014,29(1):54-57.
[16]Han V K,Dercole A J,Lund P K. Cellular localization of somatomedin(insulin-like growth factor)messenger RNA in the human fetus[J]. Science ,1987,236(4798):193-197.
[17]Holly J M. Still more questions than answers:report on the 5th International Symposium on insulin-like growth factors,Brighton,UK,31 October-4 November 1999[J]. Trends in Endocrinology and Metabolism,2001,11(4):151-153.
