邻苯二甲酸酯暴露的大鼠尿液生物标志物研究
2015-08-30柳春红张明明赖玉婷李健俊方敏婷华南农业大学食品学院广东广州50642华南农业大学广东省食品质量安全重点实验室广东广州50642
柳春红,张明明,赖玉婷,褚 玥,李健俊,方敏婷(.华南农业大学食品学院,广东 广州 50642;2.华南农业大学广东省食品质量安全重点实验室,广东 广州 50642)
邻苯二甲酸酯暴露的大鼠尿液生物标志物研究
柳春红1,2*,张明明1,赖玉婷1,褚 玥1,李健俊1,方敏婷1(1.华南农业大学食品学院,广东 广州 510642;2.华南农业大学广东省食品质量安全重点实验室,广东 广州 510642)
建立了检测尿液中邻苯二甲酸酯类化合物(PAEs)共同水解产物邻苯二甲酸(PA)的分析方法;通过雄性成年SD大鼠代谢试验,检测了邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)单独暴露、以及联合暴露条件下大鼠尿液中PA总量,并分析了PA与暴露总量之间的关系.结果显示,随着暴露剂量的增大,尿液中排出的PA总量也不断增大;DBP单独暴露、DEHP单独暴露以及两者联合暴露时尿液PAEs代谢物平均排泄总量占摄入量的百分比分别为65.04%、55.00%和38.35%;大鼠尿液中PA的摩尔总量与DBP、DEHP、以及两者联合暴露的摩尔量之间的相关系数分别为0.92(P<0.01)、0.56(P<0.01)、0.93(P<0.01).尿液水解后的PA能够反映PAEs类物质的总暴露水平,将来可能作为一种潜在的暴露生物标志物用于人群的PAEs暴露监测.
邻苯二甲酸酯;单独暴露;联合暴露;生物标志物;邻苯二甲酸
邻苯二甲酸酯(PAEs)作为增塑剂广泛应用于塑料材质中.环境和食品包装材料中的 PAEs可通过消化道、呼吸道和皮肤等途径进入人体或其他生物体,其主要危害表现为生殖、发育毒性以及其他毒性,并可通过尿液、乳汁、血液和精液等途径排出体外[1-5].进入人体的PAEs通过Ⅰ相反应迅速代谢为它们相应的单酯(一级代谢产物),能否进一步代谢为单酯的氧化产物则取决于侧链的长短.短链的 PAEs主要经酯水解为单酯排泄到尿液,长链的 PAEs被简单地水解为单酯后,大部分经烷基侧链氧化形成单酯的氧化产物(二级代谢产物).单酯和单酯的氧化产物经过Ⅱ相反应与葡萄糖醛酸结合,结合和未结合的代谢物大部分都能从尿中排出[6-8].因此,尿中代谢产物的含量能够间接反映个体PAEs的摄入量.
生物标志物是指示污染物危害效应的生物信号,可衡量环境污染物的暴露及效应的生物反应[9-11].生物标志物包括接触标志物(或暴露标志物)、效应标志物和易感标志物,其中接触标志物可定量确定个体的暴露水平. 各种生物样本中,尿液由于取样方便,被认为是比血液更好的生物标志物来源.如新近研究发现,人群尿液中 1-羟基芘的浓度可以很好的反应当地人群面临的空气中芘的污染状况[12].在PAEs的暴露评估中,一方面由于不同的暴露途径以及众多来源的暴露,一般很难估计个体每日 PAEs的摄入量[13];另一方面,由于环境中的PAEs无处不在,在分析PAEs含量的过程中也就避免不了样品的再次污染[14].为了克服上述不足,近年来,国外有学者以 PAEs的尿液代谢产物作为暴露标志物进行检测分析, 如Fromme等[15]研究发现,DEHP各种代谢产物与暴露量之间的相关系数在0.69~0.80之间,以二级代谢产物邻苯二甲酸(2-乙基-5 羟基己基)酯(5OH-MEHP)的相关系数最强,一级代谢产物邻苯二甲酸单(2-乙基己基)酯(MEHP)的相关系数最弱;而邻苯二甲酸(正)二丁酯(DBP或DnBP)、邻苯二甲酸二异壬酯(DiNP)摄入则分别与其代谢产物邻苯二甲酸正丁酯(MnBP)无相关、邻苯二甲酸异壬酯(MiNP)弱相关.这类研究主要是针对一种 PAEs暴露的代谢物进行检测,但实际上在环境与食品中更多见的是多种PAEs同时并存,如果以代谢产物作为标志物进行检测,则需要对各类PAEs的代谢产物一一检测才能最终判断是否有 PAEs的暴露.在这种情况下,迫切需要能够覆盖所有 PAEs类化合物的暴露监测方法.鉴于此,本文建立并评价了以潜在生物标志物邻苯二甲酸(PA)为基础的 PAEs暴露总量的分析方法.由于PAEs尿液代谢产物类型与母体侧链长短有关[16],因此本研究分别选择短链的 DBP和长链DEHP作为代表,将尿中不同类型的PAEs代谢产物全部转化为PA,建立尿液中PAEs代谢物总量的测定方法;通过检测分析DBP和DEHP单独暴露、以及两者联合暴露的大鼠尿液 PA含量与DBP、DEHP暴露量之间的关系,评价PA作为暴露标志物的可行性,为将来开展大规模人群暴露提供监测工具.
1 材料与方法
1.1实验动物及分组处理
清洁级成年雄性SD大鼠80只,体重(230± 30)g,由广东省实验动物中心提供,合格证号为SCXK(粤)2008-0002.大鼠适应性饲喂 1周后按体重随机分为10组,正常对照组,DBP单独暴露高、中、低剂量组,DEHP单独暴露高、中、低剂量组、DBP+DEHP高、中、低剂量组,每组8 只,组间体重无显著性差异(P>0.05).
采用一次性灌胃方式染毒,染毒前禁食 12h.根据GB15193.16-2014《国家食品安全标准 毒物动力学试验》的规定,实验中每个剂量水平应使其受试物或受试物的代谢产物足以在排泄物中测出,结合本项目前期研究,DBP3个组单独染毒的剂量分别设置为:300,100,30mg/(kg∙bw);DEHP3个组单独染毒的剂量分别为 450, 150, 50mg/(kg∙bw);DBP+DEHP3个组联合染毒的剂量 分 别 为 :DBP 300+DEHP450, DBP100+ DEHP150, DBP30+DEHP50mg/(kg∙bw),正常对照组给予等体积的玻璃瓶装芝麻油.饲养条件控制在湿度 50%~70%及温度 (21±2),12h℃光照, 12h黑暗,定量添加足量的饲料,自由饮水和摄食.受试动物于染毒后第4d称重,断颈椎处死.
1.2仪器与试剂
Waters2414-2487-1529高效液相色谱仪(美国Waters公司);HH-SH-4型电热恒温水浴锅(上海悦丰仪器仪表有限公司);MILLIPORE去离子水机(美国密理博公司);5417R型冷冻离心机(德国EPPENDORF公司);SPX-250-BD型号恒温振荡培养箱(广州市宇晨实验室设备);β-葡糖苷酸酶(≥17000U/mL,美国sigma公司).
1.3尿液样品的采集及前处理[17]
尿液采集:收集大鼠染毒前尿液及染毒后24,48,72,96h的尿液,于4℃条件下12000r/min离心15min,取上清液分装,置于-20℃冰箱保存.
尿液代谢物转成PA的处理:取尿液1mL(若已冰冻,则取出冻存尿样,室温下解冻,混合均匀)加入15μLβ-葡糖苷酸水解酶,37℃恒温震荡12h;酶解后, 12000r/min离心取上清,加入10mL甲醇混匀后,加 15mL浓度为 2mol/L的 NaOH溶液,85℃水浴加热 8h,期间不断补充甲醇,最后将甲醇蒸干,取出后冷却;用1:1硫酸将皂化液酸化, 调 pH值至 1~2,边加热边震荡,漩涡 2min,静置20min;加入3倍体积的正己烷萃取,振摇数分钟,静置20min,取正己烷层;加入3倍体积的乙酸乙酯,振摇数分钟,静置 20min,取乙酸乙酯层,剩余液体中再加入3倍体积的乙酸乙酯,2次萃取液,于旋转蒸发器中蒸发至尽干; 2mL甲醇溶解,过0.22μm有机滤膜后进行高效液相色谱分析.
1.4DBP及DEHP代谢物总量测定的色谱条件
XB-C18色谱柱(4.6×250mm,5μm);流动相:甲醇和磷酸盐缓冲溶液(25mmol/L,pH=2.5);流速:1mL/min;紫外吸收波长:230nmm;梯度洗脱:0-5min,甲醇比例由 10%升至 25%,5~20min,甲醇比例由25%升至30%,20~25min,甲醇比例由30%升至 80%,25~30min,甲醇比例由 80%降至10%;柱温:40;℃进样量:10μL.
1.5标准曲线的制作
用邻苯二甲酸标准储备液配制成PA浓度分别为0.05,1,5,10,25,50,100mg/L的标准溶液.分别吸取 10μL注入高效液相色谱进行分析,以保留时间定性、峰面积定量,制作PA标准物质峰面积-质量浓度标准曲线.
1.6统计方法
采用EXCEL数据库录入数据,用SPSS(13.0版本)统计软件进行实验数据的处理和分析,数据统计描述以平均值±SD形式表示, 采用单因素方差分析(one-way ANOVA),LSD进行多重比较,P<0.05表示差异有统计学意义.
2 结果与讨论
2.1标准品和尿液样本的色谱分离图
由图1可见,邻苯二甲酸的保留时间7.7min左右,峰型稳定,基线平稳,无杂质干扰峰,分离效果良好,9min内即可完成测定.
2.2标准曲线和检出限
邻苯二甲酸标准物质峰面积-质量浓度标准曲线如图 2所示,线性回归方程为:Y=63331X +47465,R2=0.9995,线性范围 0.05~100mg/L,最低检测限(S/N=3)为0.02μg/mL.依据图2峰面积及线性回归方程,推算图2中PA浓度为3.13μg/mL.
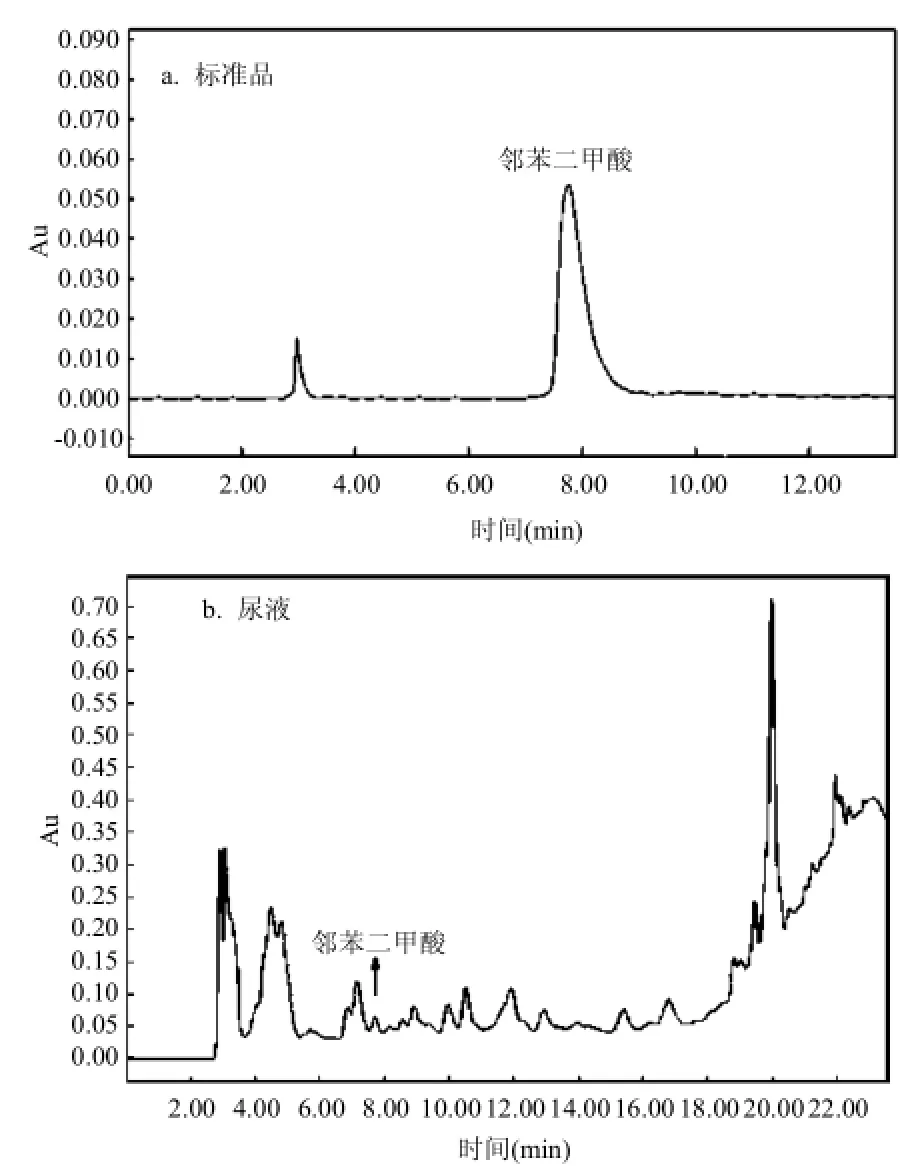
图1 标准品及尿液中邻苯二甲酸的高效液相色谱图Fig.4 High Performance Liquid chromatogram of phthalic acid standard and phthalic acid in urine
2.3大鼠尿液中PAEs代谢动力学
由表1可见,不论是DBP、DEHP单独暴露,还是DBP和DEHP联合暴露,随着大鼠暴露剂量的增加,尿液中 PA总摩尔浓度也随之增加.本次实验中灌胃前尿液中也有 PA检出,但各组间含量无显著性差异,推测其来源可能与塑料代谢笼饲养有关.由于PAEs的污染普遍存在,提示今后试验应采用全不锈钢代谢笼,尽力避免实验过程中的一切可能污染.
通过计算大鼠每日尿液中PAEs代谢物总摩尔量与实际摄入DBP或/和DEHP摩尔总量的比值,得到DBP或/和DEHP排泄率,见表2.由表2可知,DBP、DEHP单独染毒以及DBP和DEHP联合染毒各剂量组的大鼠尿液中PAEs代谢物排泄率呈现相同的趋势:即随着时间的延长,PAEs尿液中的排泄率逐渐降低,且大部分 PAEs代谢物在 24h随尿液排出体外,48h尿液中有少部分排出,而72h以及96h尿液中PAEs代谢物排泄率极低;同时,随着染毒剂量的增加,代谢量增加,但是尿中PAEs排泄率逐渐降低.
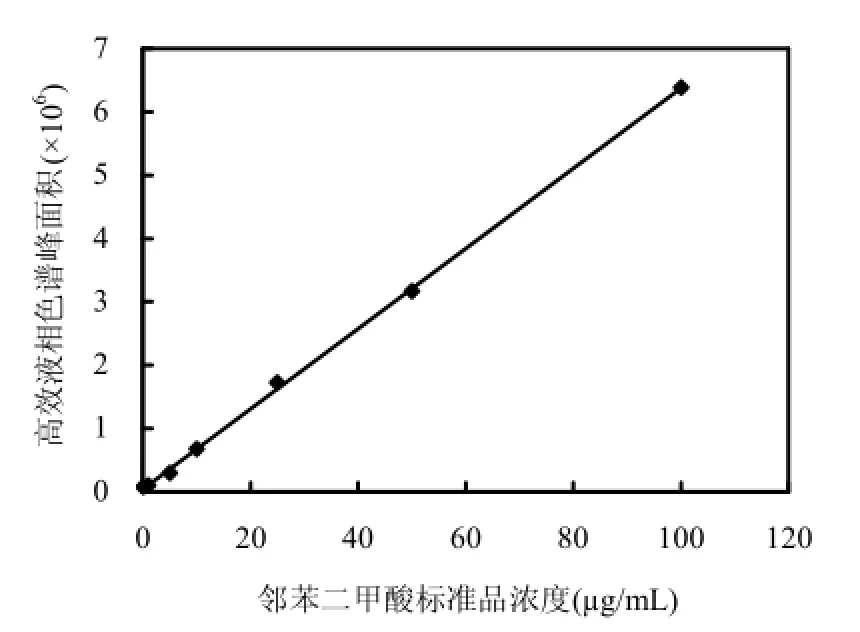
图2 邻苯二甲酸标准曲线Fig.4 Standard curve of phthalic acid for quantification
排泄是外来化合物及代谢产物向机体外转运的过程,是物质代谢在机体全过程中的最后一个环节,排泄的方式有很多种,但主要途径是通过肾脏随尿液排出和经过肝脏随同胆汁并混入粪便中排出.以前研究表明,DBP进入后可迅速被小肠的酯酶水解为单丁基邻苯二甲酸盐(MBP),24h内约55%经尿液排出、29%经粪便排出,没有蓄积性[18],其半衰期小于24h.Akira等[19]研究发现,大鼠经口摄入的DBP,48h后90%随尿液排出体外,粪便中的含量较少,可认为体内没有蓄积性.本文DBP单独暴露结果显示,尿液中3个剂量组的平均排泄总量为摄入量的 65.04%,其中在灌胃 24h内代谢最快,占摄入量的的57.49%,占4d平均累计代谢量的88.39%,与上述研究成果一致,说明尿液是 DBP排泄的主要途径.口服 DEHP24h后,约67%的DEHP代谢至尿液中,说明DEHP的半衰期也小于 24h;一项雄性猕猴的灌胃试验中,分别用100,500mg 14C-DEHP/kg2个剂量灌胃(每个剂量2只动物),结果显示,24h大部分代谢物都排泄出去了,96h后仅有0.2%潴留在组织中,低剂量动物尿液排泄率分别为20%、55%,高剂量动物排泄率为4% 和13%[20].本实验DEHP单独染毒时,尿液中平均排泄总量为摄入量的55.00%,其中24h的代谢量占44.84%,占4d平均累计代谢量的81.53%,说明DEHP在体内被迅速吸收、代谢和排泄;同时随着染毒剂量的增加,排泄率逐渐降低,与上述猕猴实验结果一致.关于DBP和DEHP联合染毒时的排泄情况缺乏相关的报道研究.本实验两者联合染毒时,尿液中平均排泄率为38.35%,其中24h排泄率为30.77%,占4d平均累计排泄量的80.23%,说明当DBP与DEHP联合暴露时,尿液中平均排泄率及 24h排泄率比单独染毒时降低,其中与DBP比降低幅度更大.
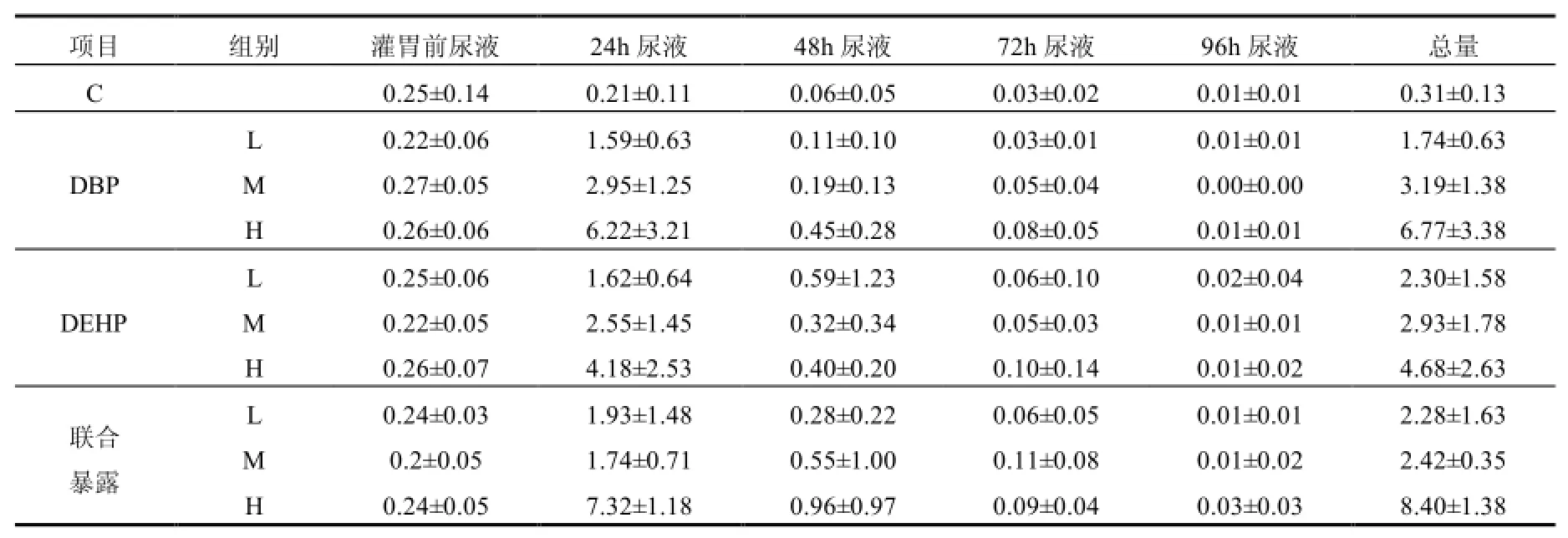
表1 DBP、DEHP单独及联合暴露组大鼠尿液中PA摩尔浓度(μmol/mL)Table 1 The molar concentration of the urine PA for DBP、DEHP and combined exposure (μmol/mL)
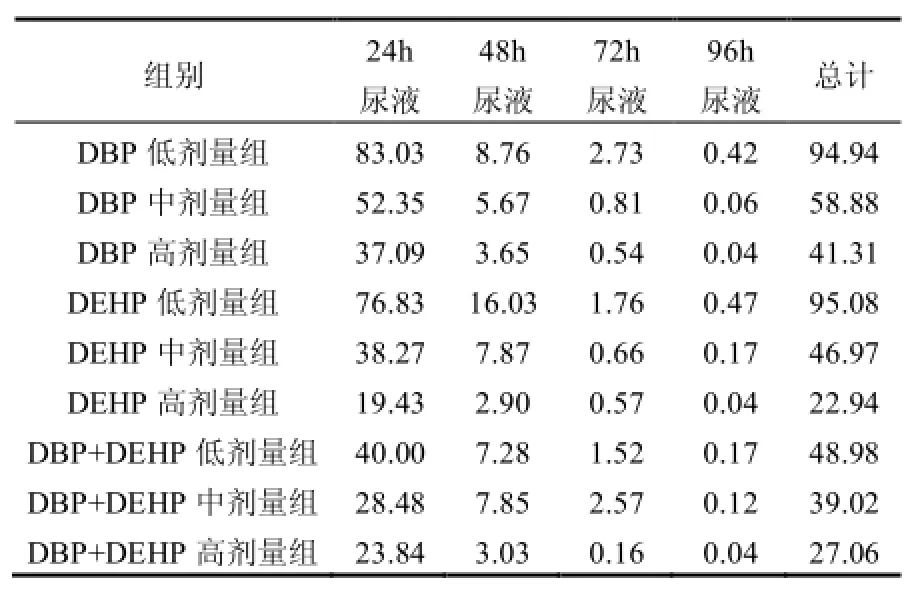
表2 不同时间各剂量组大鼠尿液中PAEs排泄率(%)Table 1 Excretion rates of PAEs in rat urine for different dose groups (%)
2.4尿液中PA浓度与PAEs暴露量的关系
为分析尿液中 PAEs排泄率与摄入量的剂量关系,以尿液处理后邻苯二甲酸PA的量(摩尔数)为X轴,PAEs摄入量(摩尔数)为Y轴,采用逐步回归分析拟合线性回归方程,结果如表3.相关分析中,相关系数 r<0.4为低度相关,0.4<r<0.7为中度相关, r>0.7为高度相关[21].因此,从相关系数大小来看,尿液中邻苯二甲酸的摩尔总量与DBP单独暴露、以及两者联合暴露的摩尔量之间均呈强相关,与DEHP单独暴露的摩尔量之间则为中等相关.

表3 大鼠尿液PA浓度与PAEs摄入量之间的相关性Table 1 The correlation of PAEs intake with phthalic acid in rat urine
3 结语
DBP、DEHP单独暴露以及DBP+DEHP联合暴露的大鼠实验结果表明,随着暴露剂量的增大,尿液中排出的代谢物水解物 PA总量也不断增大;回归分析结果显示,大鼠尿液中PA的摩尔总量与DBP、DEHP、以及两者联合暴露的摩尔量之间均具有良好的相关性,相关系数分别为0.92(P<0.01),0.56(P<0.01),0.93(P<0.01).本研究所确定以尿液水解后的PA作为PAEs暴露的生物标志物,可很好地反映邻苯二甲酸酯类物质的外暴露水平,即尿液邻苯二甲酸将来可能作为一种潜在的生物标志物用于人群的PAEs暴露监测或暴露评估研究.根据国内外一般人群尿液代谢产物检测水平数据,本项目代谢产物水解物 PA检测限可以满足人群尿样的含量分析,但仍需要继续提高方法的敏感性.
[1] Matsumoto M, Hirata-Koizumi M, Ema M, et al. Potential adverse effects of phthalic acid esters on human health: A review of recent studies on reproduction [J]. Regulatory Toxicology and Pharmacology, 2008,50(1):37-49.
[2] Hauser R, Calafat A. Phthalates and human health [J]. Occupational and Environmental Medicine, 2005,62(11):806-818.
[3] Fromme H, Bolte G, Koch H M, et al. Occurrence and daily variation of phthalate metabolites in the urine of an adult population [J]. International Journal of Hygiene and Environmental Health, 2007,210:21-33.
[4] Servaes K, Voorspoels S, Lievens J, et al. Direct analysis of phthalate ester biomarkers in urine without preconcentration: Method validation and monitoring [J]. Journal of Chromatography A, 2013,1294:25-32.
[5] Kavlock R, Boekelheide K, Chapin R, et al. NTP Center for the Evaluation of Risks to Human Reproduction: phthalates expert panel report on the reproductive and developmental toxicity of di(2-ethylhexyl) phthalate [J]. Reproductive Toxicology, 2002,16: 529-653.
[6] Koch H M, Rossbach B, Drexler H, et al. Internal exposure of the general population to DEHP and other phthalates determination of secondary and primary phthalate monoester metabolites in urine[J]. Environmental Research, 2003,93(2):177-185.
[7] Latini G. Monitoring phthalate exposure in humans [J]. Clinica Chimica Acta, 2004,361:20-29.
[8] Silva M J, Barr D B, Reidy J A, et al. Glucuronidation patterns of common urinary and serum monoester phthalate metabolites [J]. Archives of Toxicology, 2003,77:561-567.
[9] 余建新,吴采樱.生物标志物用于污染物的快速检测及毒性评价[J]. 分析化学, 2002,30(1):107-113.
[10] Shin H-M, McKone T E, Bennett D. Evaluating environmental modeling and sampling data with biomarker data to identify sources and routes of exposure [J]. Atmospheric Environment, 2013,69:148-155.
[11] Savitz D A, Stein C R, Bartell S M, et al. Perfluorooctanoic acid exposure and pregnancy outcome in a highly exposed community[J]. Epidemiology, 2012,23(3):386-392.
[12] 赵 波,任明忠,张素坤,等.南方某居民社区人群多环芳烃内暴露与环境空气污染的关系 [J]. 中国环境科学, 2013,33(S1):215-219.
[13] Doull J, Cattley R, Elcombe C, et al. 1999. A cancer risk assessment of di (2-ethylhexyl)phthalate: application of the new US EPA Risk Assessment Guidelines [J]. Regulatory Toxicology and Pharmacology, 1999,29(3):327-357.
[14] Wittassek M, Heger W, Koch HM, et al. Daily intake of di(2-ethylhexyl)phthalate (DEHP) by German children - A comparison of two estimation models based on urinary DEHP metabolite levels [J]. International Journal of Hygiene and Environmental Health, 2007,210:35-42.
[15] Fromme H, Gruber L, Schlummer M, et al. Intake of phthalates and di(2-ethylhexyl)adipate: Results of the Integrated Exposure Assessment Survey based on duplicate diet samples and biomonitoring data [J]. Environment International, 2007,33(8):1012-1020.
[16] Kato K, Silva MJ, Needham LL, et al. Determination of total phthalates in urine by isotope-dilution liquid chromatographytandem mass spectrometry [J]. Journal of Chromatography B, 2005,814:355-360.
[17] Wittassek M, Koch HM, Angerer J, et al. Assessing exposure to phthalates - The human biomonitoring approach. Molecular Nutrition and Food Research, 2011,55:7-31.
[18] 张蕴晖,林 玲,阚海东,等.邻苯二甲酸二丁酯的人群综合暴露评估 [J]. 中国环境科学, 2007,27(5):651-656.
[19] Tanaka A, Matsumoto A, Yamaha T. Biochemical studies on phthalic esters. III. Metabolism of dibutyl phthalate (DBP) in animals [J]. Toxicology, 1978,9:109-123.
[20] Short R D, Robinson E C, Lington A W, et al. Metabolic and peroxisome proliferation studies with di (2-ethylhexyl) phthalate in rats and monkeys [J]. Toxicology and Industrial Health, 1987,3: 185-195.
[21] 胡良平.检验医学科研设计与统计分析 [M]. 北京:人民军医出版社, 2004.
Urine biomarker of exposure to phthalate in rat.
LIU Chun-hong1,2*, ZHANG Ming-ming1, LAI Yu-ting1, CHU Yue1, LI Jian-jun1, FANG Min-ting1(1.College of Food Science, South China Agricultural University, Guangzhou 510642, China;2.The Key Laboratory of Food Quality and Safety of Guangdong Province, South China Agricultural University, Guangzhou 510642, China).
China Environmental Science, 2015,35(9):2868~2873
A high performance liquid chromatographic (HPLC) method was developed for the determination of phthalic acid (PA) in urine after alkaline hydrolysis of the phthalate metabolites to PA. The content of the total PA in male adult SD rat urine was measured after separated or combined exposure to dibutyl phthalate (DBP) and di 2-ethyl hexyl phthalate (DEHP), and then the relationships between exposed PAEs molar quantities and the molar concentration of the urine PA were analyzed by linear regression. The results showed that the total amount of urine PA increased as the exposure increased. The mean percentage of PAEs intake excreted in the urine was found to be 65.04% for DBP exposure alone and 55.00% for DEHP exposure alone and 38.35% for combined exposure to the two. The contents of urinary PA were well correlated with PAEs exposure levels with the correlation coefficient being 0.92 for DBP(P<0.01), 0.56 for DEHP (P<0.01) and 0.93 for combined DPB and DEHP (P<0.01). The findings suggested that PA in urine after alkaline hydrolysis of the phthalate metabolites could evaluate the total exposure level of PAEs, which may be a valid exposure biomarker of PAEs used in risk surveillance of human exposure to PAEs in future.
phthalate;separated exposure;combined exposure;biomarker;phthalic acid
X503.22
A
1000-6923(2015)09-2868-06
2015-02-12
广东省科技计划项目(2012B090600005);农业部农产品质量安全风险评估专项(GJFP2014011)
*责任作者, 教授, liuch@scau.edu.cn
柳春红(1968-),女,湖北武汉人,教授,博士,主要从事营养及食品安全研究.发表论文60余篇.
