游离氨对热水解联合中温厌氧消化处理剩余污泥的影响
2015-08-30彭永臻韩玉伟马文锦北京工业大学北京市污水脱氮除磷处理与过程控制工程技术研究中心北京市水质科学与水环境恢复工程重点实验室北京004北京工业大学建筑工程学院北京004北京排水集团北京00044
刘 阳,彭永臻*,韩玉伟,马文锦,曾 薇(.北京工业大学,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京市水质科学与水环境恢复工程重点实验室,北京 004;.北京工业大学建筑工程学院,北京004;.北京排水集团,北京 00044)
游离氨对热水解联合中温厌氧消化处理剩余污泥的影响
刘 阳1,彭永臻1*,韩玉伟2,马文锦3,曾 薇1(1.北京工业大学,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京市水质科学与水环境恢复工程重点实验室,北京 100124;2.北京工业大学建筑工程学院,北京100124;3.北京排水集团,北京 100044)
热水解预处理强化了污泥厌氧消化过程,但同时增加了微生物受游离氨抑制的风险.对比传统工艺,在有机容积负荷率1.74~4.27gVS/(L∙d)条件下,研究了游离氨(FA)对热水解联合中温厌氧消化工艺性能的影响.结果表明,组合工艺甲烷产量较传统反应器提高89%~121%,有机去除率提高1.21~1.46倍.但同时导致系统中游离氨浓度达89~382mgN/L,显著高于传统工艺中37~84mgN/L的范围.游离氨毒性测试显示,传统工艺中FA浓度从43mgN/L升至84mgN/L,没有抑制解乙酸产甲烷途径,而组合工艺中FA升至264mgN/L时,表现出抑制作用,尽管厌氧菌对高浓度FA表现更强的驯化趋势.结合氮负荷试验, FA浓度与基质利用能力,解乙酸产甲烷途径抑制程度和挥发性有机酸积累的关系表明,高有机负荷条件下组合工艺效率可通过控制氮负荷优化.
热水解;剩余污泥;厌氧消化;游离氨抑制
剩余污泥在厌氧消化过程中,由于细胞壁难以被生物破坏,造成降解性较差,热水解技术以强化厌氧消化工艺性能.研究表明热水解在 160~180℃,600~2500kPa压力,以及维持30~60min的条件下可以有效破坏剩余污泥细胞壁[1],加速水解限速步骤[2],从而提高剩余污泥的降解性和降解速率.但是,随着该工艺中有机固体的降解过程被热水解预处理强化,更高浓度的氨氮释放出来,对微生物的产甲烷能力构成了潜在威胁.尤其以游离态存在的氨(FA)在100~1100mgN/L范围时,对经驯化的厌氧菌系统的解乙酸产甲烷途径产生不同程度的抑制作用,而对于未驯化的系统,80~150mgN/L FA即会产生抑制作用[3-6].目前,关注组合工艺中高 FA浓度现象的报道较少.因此,本试验研究了 FA对热水解联合中温厌氧消化工艺的抑制问题,并探索了能够缓解 FA毒性的可行方法,旨在对提高生物质能源回收效率提供参考.
1 材料与方法
1.1材料
脱水剩余污泥泥饼来自北京一座MBR工艺城市污水处理厂(清河三期工程,处理能力:20万m3/d).脱水泥饼根据试验负荷稀释,锤式破碎机搅拌10s后用作原泥,热水解预处理后的剩余污泥在储存前稀释到试验负荷需求浓度.厨余取自某高校学生食堂,与原泥以1:1.5比例混合后进行热水解作为混合基质.混合基质用于氮负荷试验.全部进料储存在4℃环境下.表1提供了进料的具体性质.
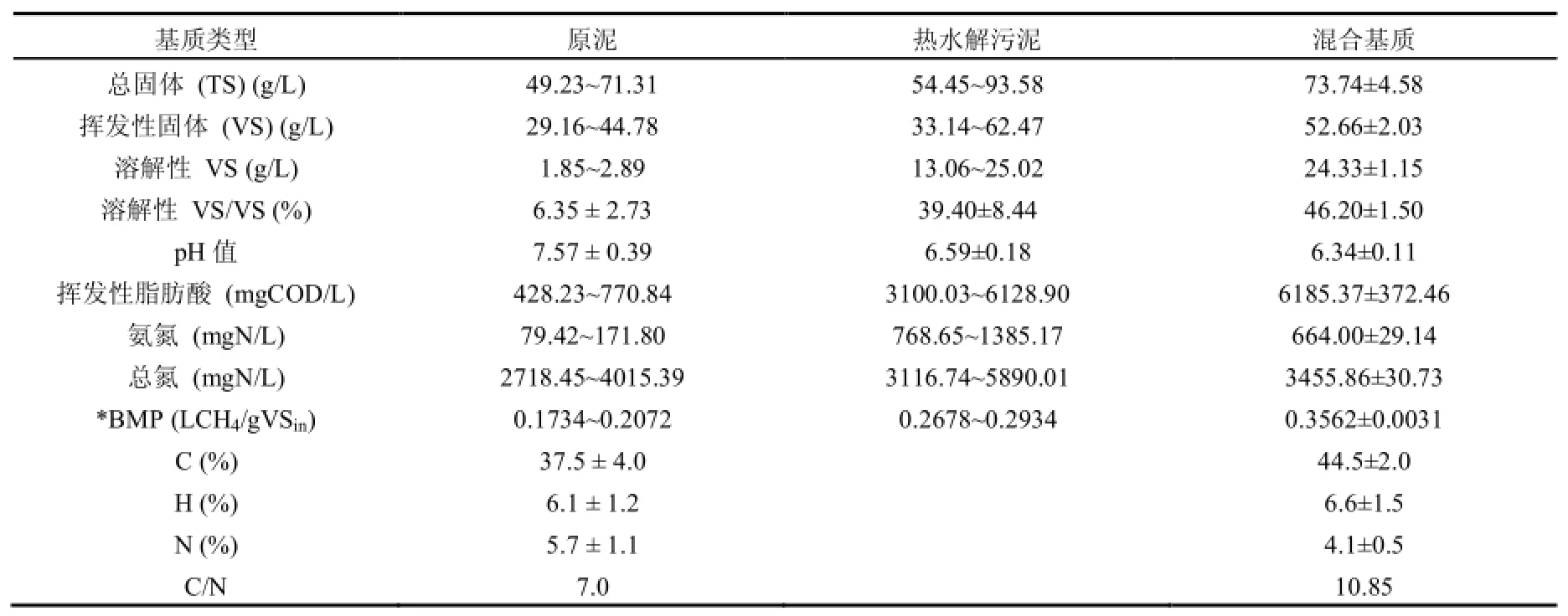
表1 进料性质Table 1 Characterization of feedstock
1.2中试厌氧消化系统的设置与运行
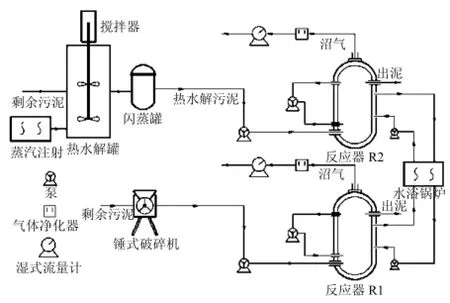
图1 试验设置流程示意Fig.4 Schematic of the experimental setups
热水解预处理在两段式装置内进行.脱水泥饼在主反应罐内 175℃,0.6~0.8MPa条件下保持30min,然后在闪蒸罐瞬间泄压.该装置采用蒸汽直接加热.厌氧消化在两座工作体积 190L的单相完全混合式反应器(CSTR,钢材型号0Cr18Ni9)中进行.反应器控制在(37±2)℃的中温条件下,并包裹聚氨酯作为保温层.固体负荷指标为有机容积负荷率(OLRs, gVS/(L∙d)).反应器R2处理热水解污泥,传统中温单相反应器 R1处理原泥作为对比.试验在1.74~4.27gVS/(L∙d)区间内的5个递增有机负荷(OLRI~OLRV)条件下进行,水力停留时间(HRT)和具体有机负荷见表2.每一个负荷梯度至少持续3个HRT以上.图1为试验反应器的示意.两CSTR反应器均接种自中试规模处理果蔬废物的厌氧消化反应器,接种 TS,SS,VS,VSS分别为22.43,20.77,15.51,13.76mg/L.
1.3FA毒性测试
本研究中,FA毒性测试采用了用于测试 FA对微生物抑制程度测试的反曲模型,该模型基于积累产气曲线的初始斜率:[7-8]
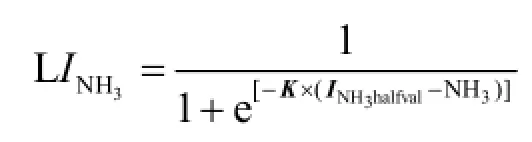
式中: INH3为抑制因子(IF),定义为受FA抑制系统积累产气曲线的初始斜率与FA极低情况下积累产气曲线的初始斜率之比.前缀L是逻辑模型的标识.INH3halfval和-K分别是INH3等于0.5时的FA的摩尔浓度和曲线斜率,这2个参数通过非线性最小二乘方法估计得到.积累产气量曲线的初始斜率通过Gompertz方程拟合得出:[9]
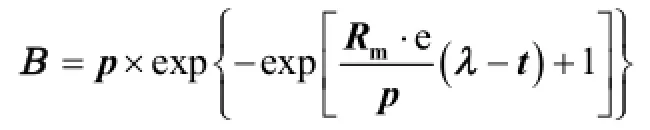
式中:Rm为积累产气曲线的初始斜率;p为最大积累产气量,mL;λ为迟滞期,d. 3个参数通过非线性最小二乘方法估计得到. B(mL)是在时间 t(d)时的积累产气量观测值.
FA毒性测试在血清瓶中通过测定R1,R2中产甲烷微生物样品(取样时间为试验的第 140d和第275d)和氮负荷试验中的额外测试,取自 R3中第395d时的微生物样品,以评价FA对于甲烷菌解乙酸产甲烷途径的抑制程度以及微生物对于提高的FA水平的驯化趋势. 20mL稀释至相同浓度的微生物接种液(VS:15.00mg/L),10mL 1.0mol/L PBS(相对于各反应器pH值),相应浓度的NH4HCO3储液(FA浓度梯度设置见补充材料)先后加入血清瓶中.根据各组试验背景反应器的pH值不同,初始乙酸浓度在 0.05~0.09mol/L区间, 以使游离乙酸维持在一个相对一致的浓度(6.80~6.95mg/L),因为游离态乙酸更具有动力学方面的意义[8-10],酸碱解离常数pKa值查自文献[11].
1.4组合工艺氮负荷试验
将取自第280d的R2中的混合液接种到2座工作体积25L的CSTR反应器中,进行氮负荷试验,运行HRT为14.6d,OLR为3.50gVS/(L∙d).其中, R3作为进行氮负荷试验调节的反应器,氮负荷的降低通过加入低C/N比的混合基质,氮负荷的提高通过人工投加NH4Cl实现. R2a作为平行反应器,其氮负荷保持不变.
1.5分析方法
TS,SS,VS,VSS,COD,NH3-N 和 TKN根据Standard Methods[12]中描述的方法测定.气体体积每24h通过湿式气体流量计记录一次.C,H和N通过CE-440快速元素分析仪测定.VFAs通过一台装备有FID检测器和Porapak-N色谱柱的日本岛津GC-2010A气相色谱仪测定,进样器,柱箱和检测器的温度分别为200,170,220℃.CH4含量通过一台装备有TCD检测器和RT-Q 色谱柱的岛津GC-2010A气相色谱仪测定,进样器,柱箱和检测器的温度分别为 200,60,200℃.所有样品均设置 3个平行.生物产甲烷潜力(BMP)在每批剩余污泥运至时和进行预处理之后测定.本研究中,生物产甲烷潜力利用率(BMP)定义为由试验反应器性能数据计算得到的甲烷产率(Methane Yield)与该批次进料在 BMP试验中测得的最大甲烷产率之比,用以描述能量潜力被厌氧消化反应器开发利用的程度.
2 结果与讨论
2.1工艺污泥减量与能源回收性能
中试试验始于2013年6月,持续约390d.启动期在40d左右,由于期间系统不稳定,所以数据不在文中讨论.每个试验阶段的运行试验数据见表 2.热水解强化反应器 R2的运行负荷从1.74gVS/(L∙d)开始升至 4.27gVS/(L∙d),除了第158d出现过加热器断电之外,其性能稳定,没有工艺崩溃现象.传统单相工艺 R1在 OLR达到2.95gVS/(L∙d)之后,反应器性能持续恶化,因此未再进一步提高其负荷.尽管R2随着OLR的增加,在整个试验期间 VS去除能力从51.35%降到了38.18%,但其工艺性能在高负荷条件下较传统工艺提升更显著.在试验持续的390d时间内,R2的容积产甲烷速度(VMP)从 0.445LCH4/(L∙d)升高至0.870LCH4/(L∙d),较R1高出89%~121%.产气性能的提升得益于经过热水解预处理,R2的 VS去除率高于 R1 1.21~1.46倍,比甲烷产量(SMP)提升了40%. SMP的提高与BMP试验中41%~54%的潜力提高基本一致(表1).SMP是一个衡量基质自身可生物降解性的指标,而与负荷无关,提高的SMP表明进料的可生物降解能力被强化了.
同时,热水解预处理通过强化解离和水解步骤,使复杂固体颗粒解离,并破坏细胞壁从而使有机物从剩余污泥细胞中释放,加速了厌氧消化过程的进行[13].经过预处理之后,VS溶解率从6.35%上升到35.07%.VFAs浓度从3.1gCOD/L升至6.1gCOD/L,较原泥进料中提高了7倍左右,表明大量的复杂颗粒和细胞复合物被分解为小分子物质并进入了液相.其他学者也报道了通过热水解预处理,甲烷产量可增加34.8%~100%,TS去除率可提高 25%~45%的,VS水解率可提升27.5%~60%[14-18].
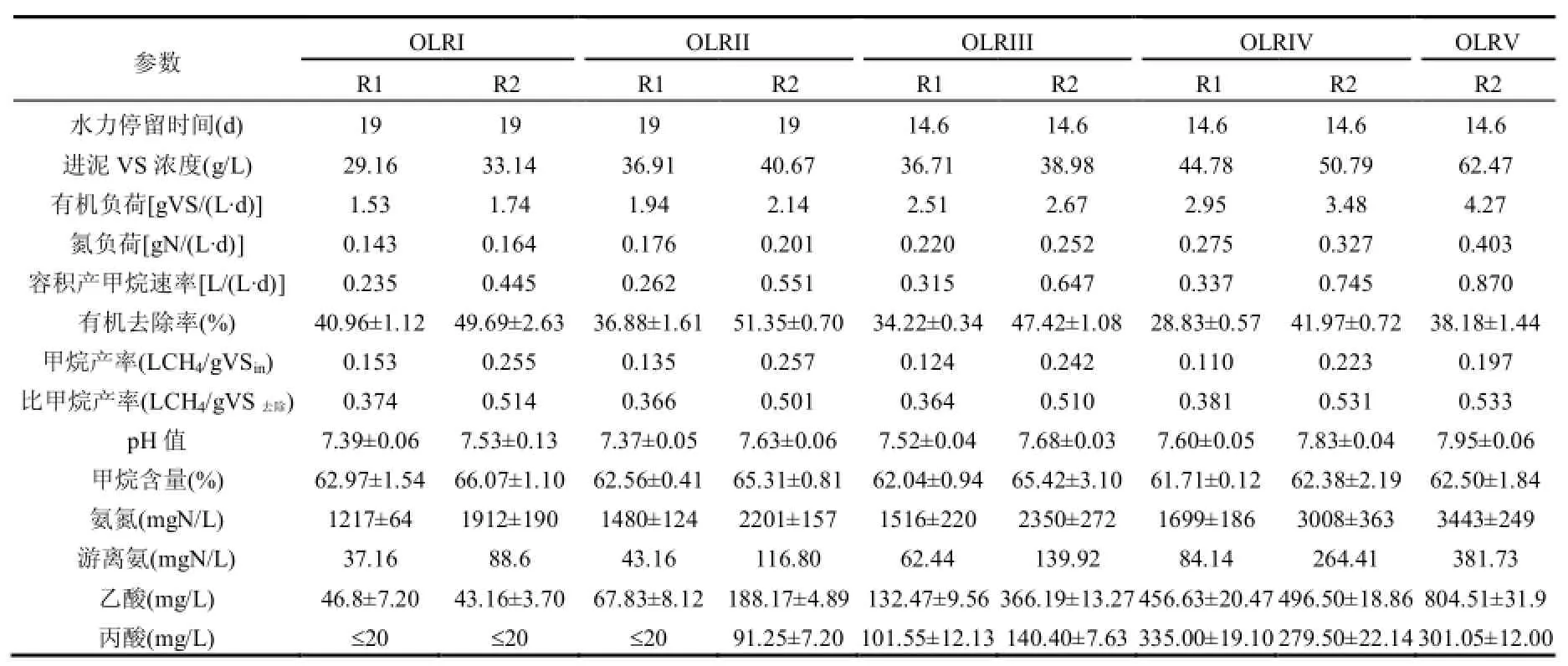
表2 稳定期运行参数Table 1 Detailed operational parameters during steady state of the digesters.
2.2FA对热水解联合工艺的影响
BMP利用率表示了在反应器中有机物被转化为甲烷的程度(图2).在前70d内,即使在最低负荷下,R1中的有机物也未能被充分利用.相反,R2 的BMP 利用率在前210d一直高于90%,表明在此过程中,负荷的提升以及 HRT的降低,并未影响到R2的产甲烷能力.在整个试验阶段,由于预处理过程的存在以及更高的有机物去除率,R2中氨氮的浓度(1.9~3.4gN/L)是 R1中(1.2~1.7gN/L)的2倍左右.两反应器中的氨氮浓度基本均在报导过的抑制范围内[19].FA浓度受总氨氮浓度影响, R2中的FA浓度从89mgN/L升至382mgN/L, R1中FA浓度从37mgN/L升至84mgN/L.BMP利用率在R2中,仅在最后2个负荷梯度开始从90%以上降低至70%,而在R1中,它是持续降低的.如果在OLRII阶段,R1中的BMP利用率的降低是由于FA抑制的话,但此阶段R2中的FA浓度更高,却没有表现出明显的抑制.在第 209~284d, BMP利用率在2个反应器中均开始下降,与之相应的是R2的FA浓度显著提高了,而R1 的 FA浓度提升平缓且依然处于较低水平.这些结果表明,FA抑制是否存在不能仅从浓度判断,其还与工艺有关.
图3描述了从FA毒性测试得到的抑制因子(IF值)以及拟合曲线的趋势.R2均高于0.93(表3)表明观测值与所应用的反曲模型有较好的相关性.参考R1的2条拟合曲线,其解乙酸产甲烷途径的 IF值保持在 0.88左右,尽管 FA浓度从43mgN/L升至 84mgN/L(图3),表明随着负荷的提升,FA对 R1产甲烷能力的抑制有限.对于R2,IF从0.77降至0.62,表明当系统内FA浓度从117mgN/L升至264mgN/L的过程中,FA降低了以乙酸为基质产甲烷菌群的活性,这可能是 R2在高FA条件下,BMP利用率降低的原因,因为解乙酸型甲烷菌,如Methanosaeta常常被认为是厌氧消化反应器中的优势菌[20].
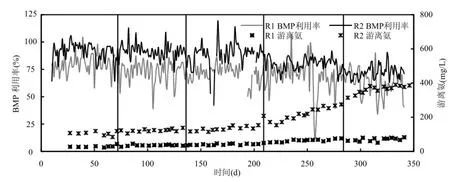
图2 厌氧消化系统对进料的能源化潜力的利用程度Fig.4 Degree of the energetic potential of the feedstock developed by the AD system
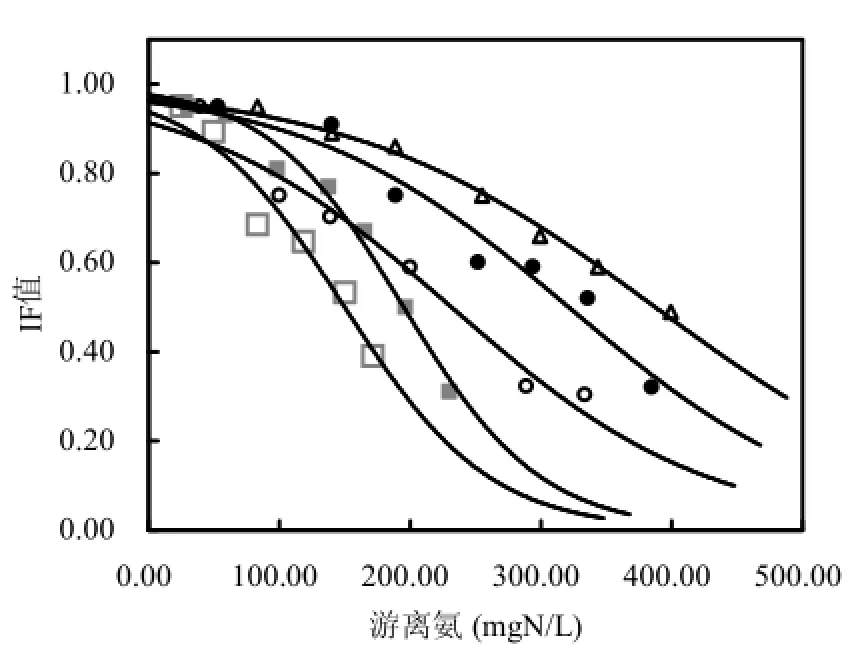
图3 FA毒性测试结果Fig.4 Results obtained in FA toxicity tests

另外,图2还显示,甲烷菌均对提高的FA浓度表现出了驯化的趋势.驯化趋势与估计参数INH3halfval一致:微生物样品取自 FA浓度更高的反应器,则INH3halfval值更高,不论微生物是来自FA表现出抑制的R2,还是FA并未表现明显抑制的R1.例如,对于OLRII或者OLRIV阶段的测试,同一FA水平下,FA对R2的抑制程度要小于R1,表明其对 R2中微生物的驯化程度更高.甲烷菌群高FA浓度的毒性环境的驯化被认为与甲烷途径由解乙酸型到包括乙酸氧化菌和氢营养型甲烷菌共同作用的互养型乙酸氧化的转变有关[21-24]. Jang等[25]发现,对氨敏感的优势中温解乙酸型甲烷菌Methanosaetaceae,在氨氮升至2.34~5.60gN/L之后开始消失,而不直接利用乙酸的甲烷菌开始显示优势.通过16S rDNA技术,Wilson发现[26]在受 FA抑制的反应器中氢营养型甲烷菌占优势.这些菌群更替的趋势与之前报导的氢营养型甲烷菌对FA更具耐受性的结果一致[27].
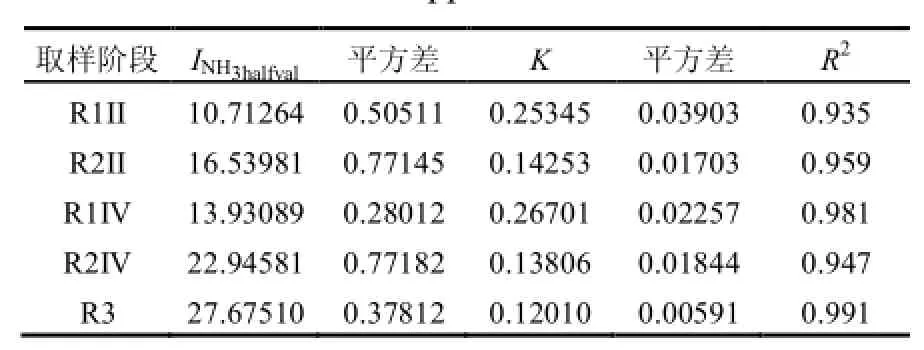
表3 逻辑模型的参数估计Table 1 Estimated parameters of the logistic model applied
通过FA毒性测试,发现FA在两种不同工艺中作用不同.对于传统工艺R1,较低的FA浓度范围(43~84mgN/L)驯化了微生物,并且在 OLR提高的过程中表现出了有限的抑制作用.其工艺性能的下降应该归因于过负荷或者HRT不足.对于组合工艺R2,高FA浓度(264mgN/L及以上)抑制了反应器的解乙酸产甲烷途径,尽管微升物表现出了更高程度的驯化,但这不足以抵消 FA的抑制作用.
2.3组合工艺氨氮负荷试验
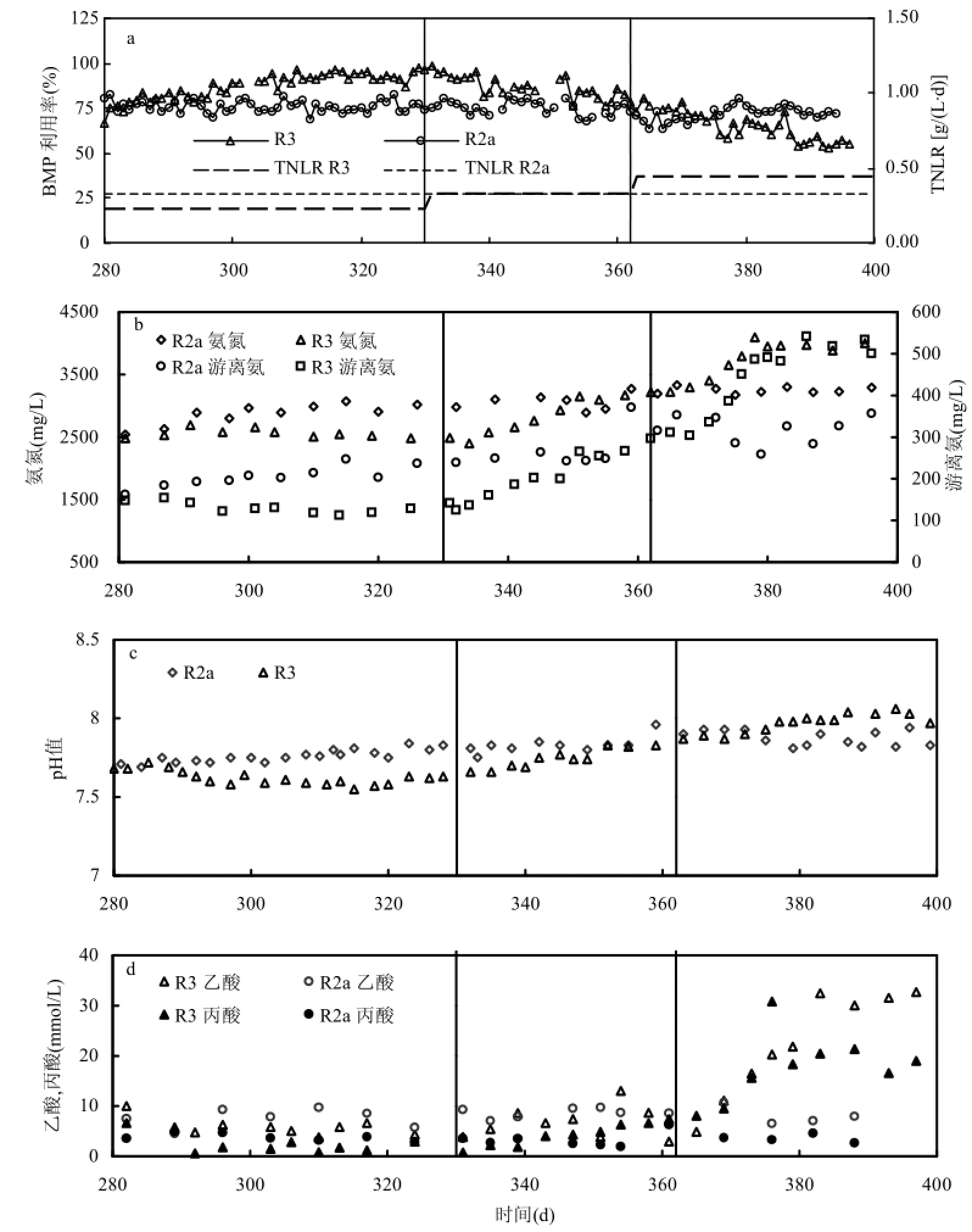
图4 不同氮负荷条件下的FA对反应器性能的影响结果Fig.4 Results of reactor experiments on FA inhibition under various nitrogen loading rates
FA毒性测试表明,热水解联合厌氧消化工艺在高有机容积负荷率下运行时产生了达到抑制浓度的FA.将可快速酸化的高C/N比废物厨余加入到 R3(OLR, 3.52gVS/(L∙d),NLR,0.231gN/ (L∙d))进料中,用以将其FA浓度调整至更有利于解乙酸型甲烷菌活性的范围内.在 280~330d,BMP利用率逐渐恢复至90%左右(图4a),此时pH值和氨氮浓度分别为 7.60和 2581mgN/L,相应FA浓度为139mgN/L.相比于R2a,R3中的FA浓度降低了89%.显著降低的FA浓度缓解了其对微生物的抑制作用,使产甲烷基质的降解速度得到提高[8],从而使反应器的产甲烷能力得到一定程度的提高.当在试验的 330~362d,通过在进料中投加 6g/L NH4CL使 R3的氮负荷(NLR, 0.336gN/(L∙d))和R2a回到同一水平之后,观测到R3的BMP利用率逐渐下降.虽然仍然高于R2a,这可能是由于生物降解能力更强的厨余强化了整个厌氧消化过程[15-16],但进一步证明了反应器对产甲烷基质的利用能力受到FA浓度的影响.
在 362~400d,通过在进料中投加 12g/L NH4CL,在R3中模拟了氮过负荷条件下反应器的运行情况.此时进料氮负荷为 0.441gN/(L∙d),含氮量等于 140gTS/L条件下的热水解污泥.观察到BMP利用率降至50%~60%,此时氨氮和FA浓度分别为4gN/L和500mgN/L左右.以乙酸和丙酸为主的VFAs大量积累,这是厌氧消化过程中产甲烷步骤被部分抑制或严重抑制而产酸步骤较为正常时的典型特征,因为产酸菌对 FA的耐受性较高[19,28].取自395d时R3中的微生物样品进行FA毒性测试,当FA达到500mgN/L时IF值为0.28(图3),表明解乙酸产甲烷途径受到了显著的抑制,可能是导致VFAs积累和反应器产甲烷能力降低的原因.尽管有研究指出,氮负荷过高往往伴随固体超负荷发生,产生较高浓度 VFAs,从而降低体系pH值,这有助于降低FA浓度,使反应器达到稳定运行但甲烷产率较低的“抑制稳定”阶段[19].但是,高浓度的末端VFAs意味着能量的浪费以及额外的处理花费,这都会提高整体运行投入.
通过调控R3的氮负荷并进行FA毒性测试,揭示了热水解强化的厌氧消化工艺中 FA浓度,BMP利用率,IF值和VFAs积累的关系.它们之间的关系也更好的解释了中试反应器中FA从不抑制到出现抑制这个过程中反应器的性能降低的原因.并且, R2和R3的pH随负荷变化的特点(表2, 图4)表明,该工艺中,NH4+/NH3平衡是影响pH值的主要原因,而非反应器内VFAs的浓度,这说明,随着负荷的进一步增高,R2发生严重FA抑制的可能性要大于因pH值剧降而发生酸化的可能性.所以, 在高固体负荷条件下,组合工艺的性能受到了氮负荷的影响.相比于传统工艺,热水解的高性能优势使生产应用中以更小的反应器体积处理更高负荷的剩余污泥,提高了能源回收效率并且节约了基建成本.但是,传统工艺中鲜为提及的FA抑制问题对于组合工艺的效率产生了威胁.当组合工艺运行在较高有机负荷下处理剩余污泥这种富含氮物质时,通过在进料中加入高碳氮比的厨余废物控制氮负荷,不仅使 FA可以被控制在相对轻度抑制范围优化工艺效率, 而且也可以将厨余废物进行有效的能源回收利用.
3 结论
3.1热水解强化了厌氧消化处理剩余污泥工艺的效率,甲烷产量较传统反应器提高89%~121%,有机去除率提高1.21~1.46倍.却同时导致系统中游离氨浓度达89~382mgN/L,显著高于传统工艺中37~84mgN/L的范围,抑制了解乙酸型甲烷菌的活性.
3.2氮负荷试验中FA浓度与基质利用能力,解乙酸产甲烷途径抑制和 VFAs积累的关系表明,在高有机容积负荷率的条件下控制氮负荷是优化组合工艺效率的可行途径.
[1] Carlsson M, Lagerkvist A, Morgan-Sagastume F. The effects of substrate pre-treatment on anaerobic digestion systems: a review [J]. Waste Manage, 2012,32(9):1634-1650.
[2] Eastman J A, Ferguson J F. Solubilization of particulate organic carbon during the acid phase of anaerobic digestion [J]. Journal of Water Pollution Control Federation, 1981,53:352-366.
[3] Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: a review [J]. Bioresource Technol., 2008,99(10): 4044-4064.
[4] Angelidaki I, Ahring B K. Thermophilic anaerobic digestion of livestock waste: the effect of ammonia [J]. Appl. Microbiol. Biotechnol., 1993,38(4):560-564.
[5] Hansen K H, Angelidaki I, Ahring B K. Anaerobic digestion of swine manure: inhibition by ammonia [J]. Water Res., 1998,32(1):5-12.
[6] DeBaere L A, Devocht M, VanAssche P, et al. Influence of high NaCl and NH4Cl salt levels on methanogenic associations [J]. Water Res., 1984,18(5):543-548.
[7] Wett B, Murthy S N, Takács I, et al. Simulation of thermal hydrolysis at the blue plains AWT: a new toolkit developed for full-plant process design [J]. Proceedings of the Water Environment Federation, 2009(14):2688-2698.
[8] Wilson C A, Novak J, Takacs I, et al. The kinetics of process dependent ammonia inhibition of methanogenesis from acetic acid [J]. Water Res., 2012,46(49):6247-6256.
[9] Cano R, Nielfa A, Fdz-Polanco M. Thermal hydrolysis integration in the anaerobic digestion process of different solid wastes: Energy and economic feasibility study [J]. Bioresource Technol., 2014,168:14-22.
[10] Karakashev D, Batstone D J, Trably E, et al. Acetate oxidation is the dominant methanogenic pathway from acetate in the absence of Methanosaetaceae [J]. Applied Environ. Microbiol., 2006,72(7): 5138-5141.
[11] CRC Handbook of chemistry, physics [M]. 9th ed. Florida, Boca Raton: CRC press, 2009.
[12] APHA, AWWA, WEF. Standard methods for the examination of water and wastewater [M]. 20th ed. Washington, DC: American Public Health Association/American Water Works Association/ Water Environmental Federation, 2005.
[13] Souza T S O, Ferreira L C, Sapkaite I, et al. Thermal pretreatment and hydraulic retention time in continuous digesters fed with sewage sludge: Assessment using the ADM1 [J]. Bioresource Technol., 2013,148:317-324.
[14] Chauzy J, Cretenot D, Bausseron A D S. Anaerobic digestion enhanced by thermal hydrolysis: first reference BIOTHELYS®at Saumur, France. Facing sludge diversities: challenges, risks and opportunities [Z]. Antalya, Turkey, 2007.
[15] Liu X, Wang W, Gao X B, et al. Effect of thermal pretreatment on the physical and chemical properties of municipal biomass waste [J]. Waste Manage, 2012,32(2):249-255.
[16] Wilson C A, Novak J T. Hydrolysis of macromolecular components of primary and secondary wastewater sludge by thermal hydrolytic pretreatment [J]. Water Res., 2009,43(18):4489-4498.
[17] Bougrier C, Delgenes J P, Carrere H. Effects of thermal treatments on five different waste activated sludge samples solubilisation, physical properties and anaerobic digestion [J]. Chem. Eng. J., 2008,139(2):236-244.
[18] Fdz-Polanco F, Velazquez R, Perez-Elvira S I, et al. Continuous thermal hydrolysis and energy integration in sludge anaerobic digestion plants [J]. Water. Sci. Technol., 2008,57(8):1221-1226.
[19] Nielsen H B, Angelidaki I. Strategies for optimizing recovery of the biogas process following ammonia inhibition [J]. Bioresource Technol., 2008,99(17):7995-8001.
[20] Yilmaz V, Ince-Yilmaz E, Yilmazel Y D, et al. Is aceticlastic methanogen composition in full-scale anaerobic processes related to acetate utilization capacity? [J] Applied Microbiol. Biotechnol., 2014,98(11):5217-5226.
[21] Hattori S, Kamagata Y, Hanada S, et al. Thermacetogenium phaeum gen. nov., sp. nov., a strictly anaerobic, thermophilic, syntrophic acetate-oxidizing bacterium [J]. Int. J. Syst. Evol. Micr., 2000,50(4):1601-1609.
[22] Petersen S P, Ahring B K. Acetate oxidation in a thermophilic anaerobic sewage-sludge digestor: the importance of nonaceticlastic methanogenesis from acetate [J]. FEMS Microbiol. Lett., 1991,86(2):149-152.
[23] Lovley D R, Ferry J G. Production and consumption of H2during growth of Methanosarcina spp. on acetate [J]. Appl. Environ. Microbiol., 1985,49(1):247-249.
[24] Schnürer A, Zellner G, Svensson B H. Mesophilic syntrophic acetate oxidation during methane formation in biogas reactors [J]. FEMS Microbiol. Ecol., 1991,29(3):249-261.
[25] Jang H M, Cho H U, Park S K, et al. Influence of thermophilic aerobic digestion as a sludge pre-treatment and solids retention time of mesophilic anaerobic digestion on the methane production, sludge digestion and microbial communities in a sequential digestion process [J]. Water Res., 2014,48:1-14.
[26] Wilson C A. Mechanisms of Methanogenic Inhibition in Advanced Anaerobic Digestion [D]. Virginia Polytechnic Institute and State University, 2009.
[27] Garcia J L, Patel B K C, Ollivier B. Taxonomic, Phylogenetic, and Ecological Diversity of Methanogenic Archaea [J]. Anaerobe, 2000,6(4):205-226.
[28] Hansen K H, Angelidaki I, Ahring B K. Anaerobic digestion of swine manure: inhibition by ammonia [J]. Water Res., 1998, 32(97):5-12.
致谢:本研究得到了北京排水集团小红门污水处理厂,北京排水集团科技研发中心的巨大帮助,在此表示感谢.
The inhibition of free ammonia on combined thermal hydrolysis and mesophilic anaerobic digestion for treating waste activated sludge.
LIU Yang1, PENG Yong-zhen1*, HAN Yu-wei2, MA Wen-jin3, ZENG Wei1(1.Engineering Research Center of Beijing, Key Laboratory of Beijing For Water Quality Science and Water Environment Recovery Engineering, Beijing University of Technology, Beijing 100124, China;2.College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China;3.Beijing Drainage Group, Beijing 100044, China).
China Environmental Science, 2015,35(9):2650~2657
Thermal hydrolysis facilitates anaerobic digestion process, but raises the possibility of free ammonia inhibition. This study evaluated the effect of free ammonia on the methanogenic ability of the thermal hydrolysis and mesophilic combined process treating waste activated sludge (WAS) with conventional single phase process as comparision. At the volumetric organic loading rates of 1.74~4.27gVS/(L∙d), the combined process had 89%~121% methane production and 1.21~1.46 times volatile solids reduced than the conventional process. But it produced free ammonia (FA) ranging 89~382mgN/L, much higher than that (37~84mgN/L) in the conventional process. Anaerobic microorganisms in both processes acclimated to high FA concentrations. The aceticlastic methanogenesis pathway was barely affected in the conventional process with FA increasing from 43 to 84mgN/L, while the activity of aceticlastic methanogens was inhibited in the combined process with FA concentration higher than 264mgN/L. The interaction of FA concentration, BMP utilization ratio, the inhibition of aceticlastic methanogenesis and volatile fatty acid (VFA) accumulations indicated the combined process was mainly affected by nitrogen loading, which was different from organic loading limited conventional process. At high solid concentration, nitrogen loading rates should be considered as an limiting operational parameter for thermal hydrolysis anaerobic digestion process.
thermal hydrolysis;waster activated sludge;anaerobic digestion;free ammonia inhibition
X703
A
1000-6923(2015)09-2650-08
2015-01-16
国家863计划项目(2012AA063406);北京市教委资助项目
*责任作者, 教授, pyz@bjut.edu.cn
刘 阳(1989-),男,河北省石家庄人,北京工业大学硕士研究生,主要从事剩余污泥厌氧消化工艺理论与应用研究.
