黏结方法对PLA血管内支架力学性能的影响
2015-08-24姜晓彤王聪儿王巧依张佩华
姜晓彤, 王聪儿, 王巧依, 张佩华
(东华大学 a. 纺织面料技术教育部重点实验室; b. 纺织学院,上海 201620)
黏结方法对PLA血管内支架力学性能的影响
姜晓彤a, b, 王聪儿a, b, 王巧依a, b, 张佩华a, b
(东华大学 a. 纺织面料技术教育部重点实验室; b. 纺织学院,上海 201620)
将聚乳酸(polylactic acid, PLA)编织线经手工编织成环形网状结构血管内支架,冠峰连接处分别采用聚己内酯(poly-caprolactone, PCL)管封套黏结和4014医用胶水黏结.通过测试两种支架的扩张性能、黏结点牢度、径向压缩性能及体外降解性能,探讨黏结点工艺对血管内支架生物力学性能的影响.试验结果表明:PCL管封套黏结的PLA血管内支架的黏结点牢度与压缩回复率较高,且扩张性较好,但径向压缩力较低,径向压缩性能及体外降解性能与4014医用胶水黏结的PLA血管内支架相似,PCL管封套黏结的PLA血管内支架更适用于临床.
聚乳酸(PLA); 血管内支架; 黏结点; 力学性能
随着现代生活方式的改变,心血管疾病成为当今威胁人类健康的重要隐患.血管内支架的植入能够为血管提供支撑,使已经堵塞或者狭窄的血管完成血运重建,实现其正常生理功能.随着血管内治疗技术的发展,血管内支架植入术已经成为治疗心血管疾病最有效的方法之一[1].生物可降解血管内支架在血管内皮化完成后降解,保持了血管结构的完整,稳定了血管的内环境,克服支架自身的血栓源性及异物性,正受到材料学和医学界的广泛关注[2].聚乳酸(PLA)具有良好的力学性能和降解性能,已被美国食品与药物管理局(FDA)批准为植入人体的生物工程材料[3],是目前常用的生物可降解支架材料.
已有文献报道了对生物可降解血管内支架的结构和性能的研究.文献[4]以左旋聚乳酸(PLLA)为原料,开发了生物可降解血管内支架Igaki-TamaiTM,其是最早被用于人体的生物可降解血管内支架,但其顺应性比较差,且径向支撑强度不足,会引起较高的血管内再狭窄发生率[5-6].文献[7]研发了生物可降解药物洗脱血管内支架BVS 1.0,支架材料为PLLA,抗恶性细胞增生药物依维莫司由可降解聚合物外消旋聚乳酸(PDLLA)包覆并控制释放,支架的径向支撑强度较高,并降低了血管内再狭窄的发生率,但在植入人体6个月后,其径向支撑强度不足,造成后期管腔缺失.文献[8]在此基础上进行结构改进,开发出新一代生物可降解药物洗脱血管内支架BVS 1.1.文献[9]对BVS 1.1的性能进行了研究,表明其径向支撑强度较高,足以支撑起狭窄的冠脉血管.目前,国内外学者对生物可降解血管内支架结构单元进行设计以改进支架性能的研究较多,但支架结构单元连接方式的研究未见报导.本文采用PLA长丝制备环形网状结构支架,在支架结构单元连接处采用封套黏结工艺改善PLA血管内支架的力学性能,并对封套黏结和胶水黏结两种黏结结构的PLA血管内支架的扩张性能、黏结点牢度、径向压缩性能及体外降解性能进行研究探讨.
1 试 验
1.1材料及样品制备
1.1.1编织线的制备
采用东华大学材料科学与工程学院提供的PLA长丝,直径为0.13 mm,线密度为15.50 tex,拉伸断裂强力为375.88 cN,断裂伸长率为31.47%.将PLA长丝在立式锭子编织机上进行无芯合股编织,4根PLA长丝分别放置在4个锭子上,通过齿轮转动,锭子绕编织机“8”字运动,制得PLA编织线.齿轮齿数比为82∶18,编织线直径为0.37 mm,线密度为59.00 tex,拉伸断裂强力为1325.00 cN,断裂伸长率为41.77%.
1.1.2血管内支架的制备
截取长约40 cm的PLA编织线,借助于自制圆柱铜管模具(直径为5.0 mm、长度为15.0 mm)进行手工编织[10],模具表面分布6行直径为0.6 mm的小孔,相邻两行小孔交错排列,如图1所示,小孔内插入直径为0.5 mm、长度为5.0 mm的金属销,将PLA编织线沿销子缠绕编织成波浪形.图2为支架沿轴向展开的结构示意图,相邻两行对称设置,每个冠峰与其相邻行中与之对称的冠峰每间隔两个冠峰连接处形成一个冠峰黏结点,对上下两行编织线交叉重叠处进行黏结.黏结点的交错配置可使支架在较大直径变化时长度变化不大,有利于血管内支架借助于输送装置进行植入.

图1 圆柱铜管模具示意图Fig.1 Sketch of cylindrical copper pipe mold
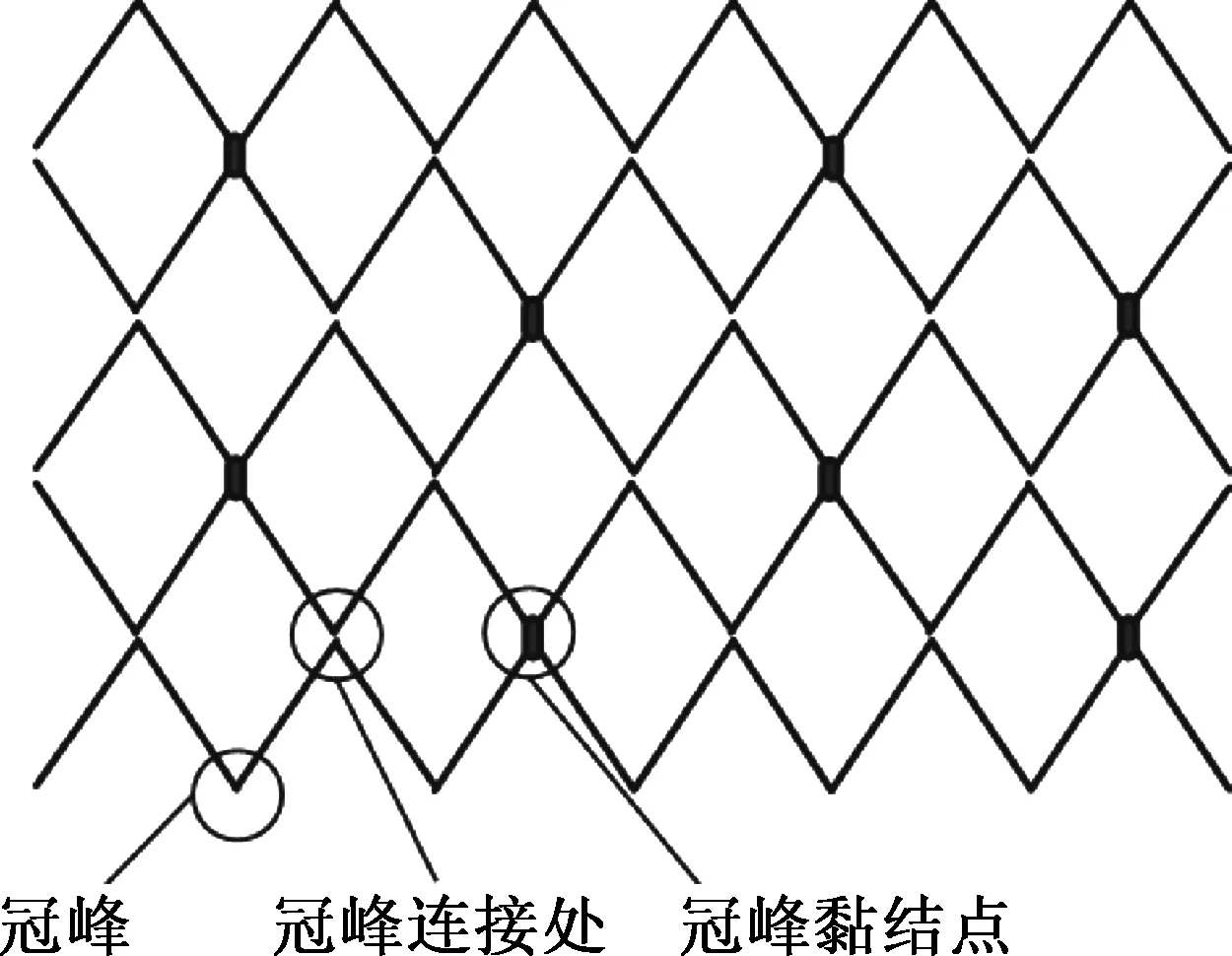
图2 支架结构示意图Fig.2 Sketch of stent structure
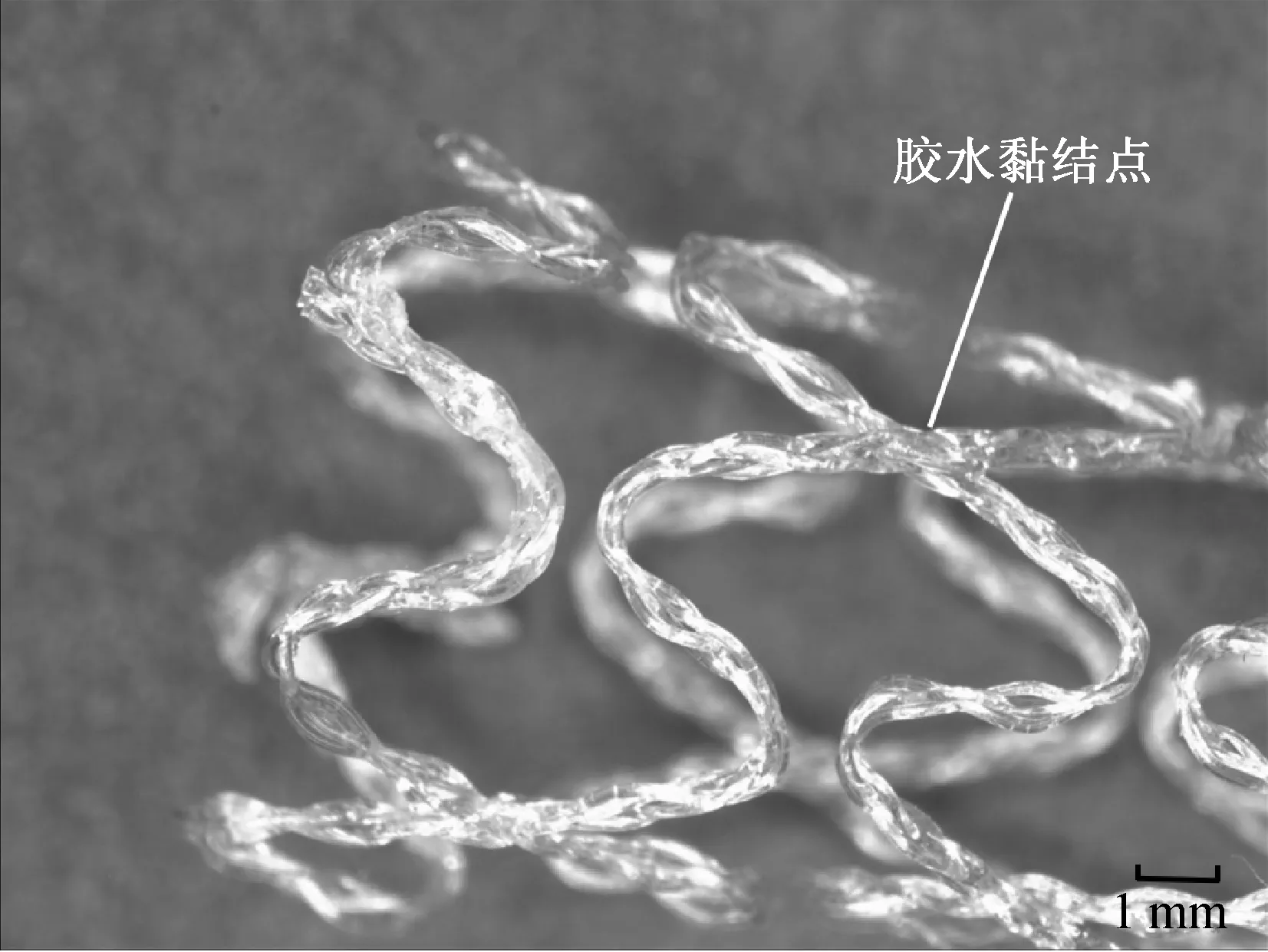
将编织成型的PLA血管内支架进行热定形处理,定形温度为100 ℃,定形时间为30 min,待支架冷却脱模,即可得到外径为7.0 mm、长度为11.7 mm的环形网状结构PLA血管内支架.分别采用聚己内酯(poly-caprolactone, PCL)管(直径为0.8 mm、长度为1.0 mm)封套黏结和4014医用胶水黏结,其中4014医用胶水黏结点直径为0.5 mm、长度为1.0 mm,制备两种不同黏结结构的PLA血管内支架,两者在PXS8-T型体视显微镜下放大20倍的照片如图3所示.
1.1.3黏结点牢度测试对比试样的制备
将PLA编织线交叉呈X型,在交接点处分别用PCL管封套黏结和4014医用胶水黏结,试样黏结状态与PLA血管内支架上的黏结状态相同,如图4所示,测试其黏结点牢度.

(a) PCL管封套黏结点
(b) 4014医用胶水黏结点

图4 黏结点牢度测试试样示意图Fig.4 Sketch of test sample of adhesion fastness
1.2测试指标与方法
1.2.1支架扩张性能
以支架的柔韧性和尺寸稳定性作为扩张性能的评价指标.将压缩至直径为3.0 mm的两种黏结结构的PLA血管内支架,安装在直径为3.0 mm的球囊导管上,球囊加压扩张至直径为7.0 mm,对球囊卸压,抽出球囊.对比扩张前后支架形态的变化,可得出两种支架的柔韧性.比较径向反弹率的大小,可得出两种支架扩张后的尺寸稳定性.根据式(1)计算支架的径向反弹率,每种支架测试3个试样,取平均值.

(1)
式中:D1为扩张后支架直径最大值;D2为球囊撤出后支架直径.
1.2.2黏结点牢度
采用XL-1型纱线强伸度仪,隔距为250 mm,拉伸速度为250 mm/min,将两种黏结方式的样品进行拉伸断裂测试,每种黏结方式样品测试3次,取平均值.
1.2.3支架径向压缩性能
采用支架表面包覆橡胶膜的方法对PLA血管内支架进行测试,以径向压缩力及压缩回复率作为支架径向压缩性能的评价指标.由于橡胶膜厚度约为0.06 mm,相对于支架直径(7.0 mm)很小,可忽略不计.使用YG 061型径向压缩仪定距离测试,支架沿轴向静置于待测平台上,压脚直径为20 mm,压缩速度为20 mm/min,径向最大压缩距离为支架直径的50%.压脚以恒定压缩速度下降,压缩至最大压缩距离时测得其径向压缩力,压脚停滞5 s后,以原速返回到初始位置.根据式(2)计算支架的压缩回复率,每种支架测试3个试样,取平均值.

(2)
式中:D0为支架初始直径;D3为压缩后支架直径;D4为压缩回复后支架直径.
1.2.4支架体外降解性能
将3个PLA血管内支架浸泡在温度为37 ℃、pH值为7.4的磷酸盐缓冲液(PBS)中,并置于HH.CP-T型二氧化碳培养箱内进行16星期的体外降解试验.试样降解系统保持静态,所用的PBS每星期更换一次.每2星期取出试样,经去离子水冲洗,用滤纸吸干表面水分,将试样置于-18 ℃冰箱中冷冻24 h后,置入真空冷冻干燥机干燥2 h,取出试样,进行支架径向压缩性能测试.测试完成后,将支架浸泡在PBS中,并置于二氧化碳培养箱中继续降解.
2 结果与讨论
2.1支架扩张性
PCL管封套黏结和4014医用胶水黏结的PLA血管内支架扩张后形态发生变化,图5为支架在PXS8-T型体视显微镜下放大的照片.扩张前两者结构均匀,扩张后PCL管封套黏结的PLA血管内支架结构保持良好,但4014医用胶水黏结的PLA血管内支架结构不均匀,并且支架头端黏结点处断裂.PCL管封套黏结和4014医用胶水黏结的PLA血管内支架的径向反弹率分别为5.30%和7.83%,说明前者扩张后的尺寸稳定性优于后者.支架被压缩至小直径时,在径向压缩力作用下,支架发生了较大的塑性变形和屈曲,在支架内部产生残余应力,对支架扩张后的应力应变产生影响[11].在支架扩张的过程中,施加在球囊内表面的压力首先把球囊扩张开,然后进一步把支架扩张开.支架在整个扩张过程中要经历弹性变形和塑性变形.支架的塑性变形主要发生在支架冠峰和支架黏结点处[12].PCL管封套黏结点表面积大,将冠峰连接处包裹,增强了支架抵抗塑性变形的能力,并且PCL柔韧性好,改善了支架的柔韧性,所以PCL管封套黏结的PLA血管内支架扩张后的形态保持及尺寸稳定性比较好.随着球囊扩张,支架两端末梢部分扩张得最快,而4014医用胶水黏结点表面积较小,且黏结牢度较小,所以4014医用胶水黏结的PLA血管内支架头端的黏结点断裂.

(a) 扩张前(×10)

(b) 扩张后(×6.7)
2.2黏结点牢度
PCL管封套黏结点和4014医用胶水黏结点牢度如表1所示.由表1可知,PCL管封套黏结点的拉伸断裂强力高于4014医用胶水黏结点,这是由于PCL管封套黏结比4014医用胶水黏结有更大的接触面积,在热定形过程中,PCL熔融,更好地渗透到PLA编织线中,因此增强了黏结点拉伸断裂强力.由于破坏处为编织线与黏结点的结合处,黏结点材料的柔韧性对其断裂伸长率影响很小,因此两者的断裂伸长率基本相同.两种黏结点在显微镜下放大40倍的形态如图6所示.由图6可知,PCL管封套黏结点对编织线包裹黏结,其黏结面积比4014医用胶水黏结点大.
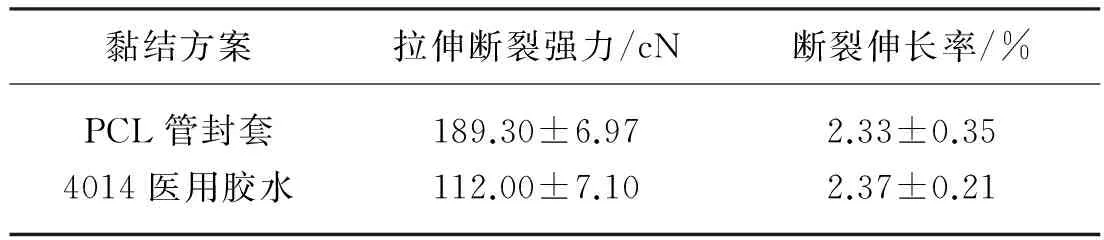
表1 黏结点牢度Table 1 Fastness of adhesion point

(a) PCL管封套黏结点

(b) 4014医用胶水黏结点
2.3支架径向压缩性能
PCL管封套黏结和4014医用胶水黏结的PLA血管内支架的径向压缩回复曲线如图7所示.由图7可知,两种支架的变化趋势相似.压脚停滞5 s,压缩力稍有下降,说明发生了压缩应力松弛.压缩回复曲线未回到初始压缩点,说明在压缩过程中发生了一定的塑性变形.PCL管封套黏结的PLA血管内支架在压缩和回复过程中压缩力变化速度比较稳定,且在压脚停滞时压缩力下降不明显;4014医用胶水黏结的PLA血管内支架弹性模量比较大,且在压缩量达到50%时径向压缩力比较大.

(a) PCL管封套黏结

(b) 4014医用胶水黏结
PLA血管内支架的径向压缩力和压缩回复率如表2所示.由表2可知,PCL管封套黏结的PLA血管内支架的径向压缩力比较小,但其压缩回复率比较大.这是因为血管内支架所能承受的径向最大压缩力主要是依靠PLA编织线自身的抗弯曲变形能力及黏结点处的黏结.两种黏结结构支架的PLA编织线相同,黏结方式的不同引起两种支架径向压缩性能的不同.封套黏结对冠峰连接处包裹并渗透黏结,增强了支架抵抗变形的能力,且PCL柔韧性较好,当所受压缩力减小时,支架能较快回复,因而PCL管封套黏结的PLA血管内支架的压缩回复率较大.而4014医用胶水的固化,增强了其分子间的相互作用,增大了黏结点所能承受的径向压缩力,故4014医用胶水黏结的PLA血管内支架有较高的径向压缩力.

表2 PLA血管内支架径向压缩性Table 2 Radial compression property of PLA intravascular stent
2.4体外降解性能
2.4.1支架径向压缩力
PCL管封套黏结和4014医用胶水黏结的PLA血管内支架在体外降解中径向压缩力发生了变化,两者的径向压缩力随降解时间的变化曲线如图8所示.由图8可知,随着降解的进行,前4星期径向压缩力快速下降,第6星期径向压缩力明显升高,8星期后径向压缩力再次缓慢下降,12星期后径向压缩力低于初始值,且在降解过程中4014医用胶水黏结的PLA血管内支架的径向压缩力始终高于PCL管封套黏结的PLA血管内支架.PLA血管内支架径向压缩性能受编织线刚度和黏结方式的影响,由于两者编织线相同,4014医用胶水黏结的PLA血管内支架径向压缩力高于PCL管封套黏结的PLA血管内支架,降解过程中两种黏结点形态保持良好,因此降解过程中4014医用胶水黏结的PLA血管内支架的径向压缩力始终高于PCL管封套黏结的PLA血管内支架.支架径向支撑作用的丧失主要由编织线的断裂使支架分解导致,而编织线的断裂是由单丝降解引起的,因此,PLA长丝降解性能决定了血管内支架的支撑作用时间[13].聚乳酸降解存在两个阶段:第一阶段,水分子扩散到聚乳酸的无定型区域,导致酯键的随机断开,随着降解的进行,无定型区逐渐减少,结晶度增加;第二阶段,水解从结晶区边缘开始,朝着结晶中心进行,但速度比无定型区慢得多[14].降解过程中水分子首先进入聚乳酸无定型区域进行水解,酯键断裂,使PLA长丝刚度下降,引起血管内支架径向支撑力在前4星期降低.降解第一阶段结束后,聚乳酸结晶度增加使结构更加规整紧密,PLA长丝抵抗变形能力增强,即刚度增加,导致第6星期PLA血管内支架径向支撑力升高.降解第二阶段的聚乳酸结晶区域水解,结晶度下降,其缓慢的水解速度使PLA长丝刚度下降较慢,因此8星期后血管内支架径向支撑力再次缓慢下降.
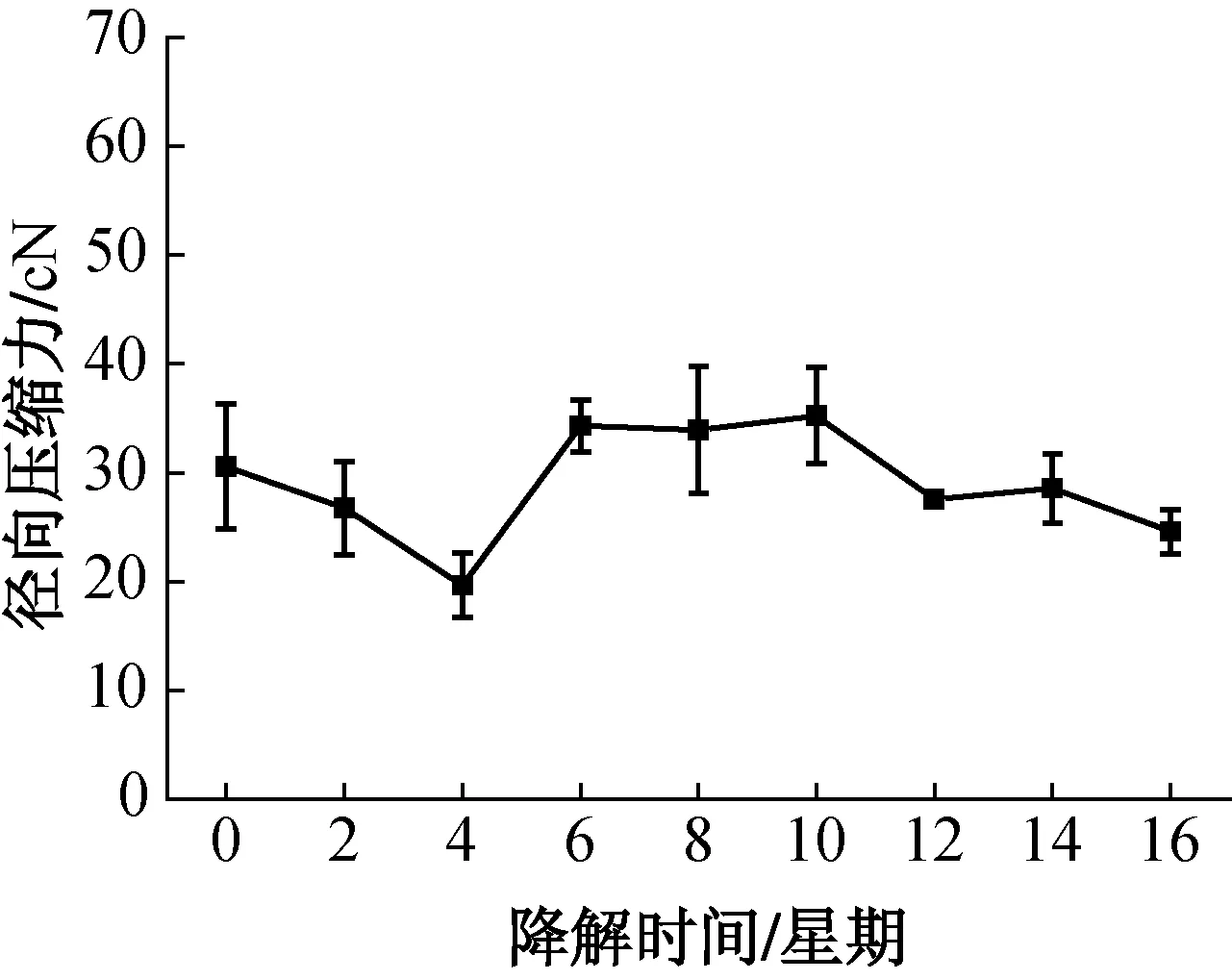
(a) PCL管封套黏结

(b) 4014医用胶水黏结
2.4.2支架压缩回复率
PCL管封套黏结和4014医用胶水黏结的PLA血管内支架在降解过程中压缩回复率发生了变化,两者的压缩回复率随降解时间的变化曲线如图9所示.由图9可知,两者的压缩回复率基本保持稳定,为80.4%~98.7%,但PCL管封套黏结的PLA血管内支架更稳定.这可能是由于在16星期的体外降解测试期间PCL与PLA降解速度一致,并且PCL较好的柔韧性改善了PLA脆性大的特点,因此,PCL管封套黏结的PLA血管内支架的压缩回复率比较稳定,并大于4014医用胶水黏结的PLA血管内支架.

(a) PCL管封套黏结

(b) 4014医用胶水黏结
3 结 论
(1) 封套和胶水都可以对环形网状结构PLA血管内支架的冠峰连接处进行黏结,PCL管封套黏结点牢度比4014医用胶水黏结点牢度大.
(2) PCL管封套黏结的PLA血管内支架的扩张性能与压缩回复率优于4014医用胶水黏结的PLA血管内支架,两者径向压缩回复曲线趋势相似,但前者径向压缩力小于后者.
(3) 体外降解期间,PCL管封套黏结和4014医用胶水黏结的PLA血管内支架的径向压缩力变化趋势一致,前4星期降低,第6星期上升,8星期后又缓慢下降,两者的压缩回复率基本保持稳定.
[1] 吴远浩, 周晓晨, 李楠, 等.可降解金属血管支架研究进展[J].中国材料进展, 2012, 31(9):27-34.
[2] 毛琳, 章晓波, 袁广银, 等.生物可降解血管支架的研究进展[J].材料导报, 2010, 24(19):66-70.
[3] KIM H, ISHIHARA K, LEE S, et al.Tissue response to poly(L-lactic acid)-based blend with phospholipid polymer for biodegradable cardiovascular stents[J].Biomaterials, 2011, 32(9): 2241-2247.
[4] TAMAI H, IGAKI K, TUSJI T, et al.A biodegradable poly-L-lactic acid coronary stent in the porcine coronary[J].Journal of Interventional Cardiology, 1999, 12(6): 443-450.
[5] TAMAI H, IGAKI K, KYO E, et al.Initial and 6-month results of biodegradable poly-L-lactic acid coronary stents in humans[J].Circulation, 2000, 102(4): 399-404.
[6] NISHIO S, KOSUGA K, IGAKI K, et al.Long-term (>10 years) clinical outcomes of first-in-human biodegradable poly-L-lactic acid coronary stents: Igaki-tamai stents[J].Circulation, 2012, 125(19): 2343-2353.
[7] ORMISTON J, SERRUYS P, REGAR E, et al.A bioabsorbable everolimus-eluting coronary stent system for patients with single de-novo coronary artery lesions(ABSORB): A prospective open-label trial[J].Lancet, 2008, 371(9616): 899-907.
[8] SERRUYS P, ONUMA Y, ORMISTON J, et al. Evaluation of the second generation of a bioresorbable everolimus drug-eluting vascular scaffold for treatment of de novo coronary artery stenosis: Six-month clinical and imaging outcomes[J].Circulation, 2010, 122(22): 2301-2312.
[9] GOMEZ-LARA J, BRUGALETTA S, DILETTI R, et al.A comparative assessment by optical coherence tomography of the performance of the first and second generation of the everolimus-eluting bioresorbable vascular scaffolds[J].European Heart Journal, 2011, 32(3): 294-304.
[10] 张佩华, 王聪儿, 杨庆, 等.一种生物可降解血管内支架及其制造方法: 中国, 103830026A[P]. 2014-06-04.
[11] 冯海权, 江旭东, 胡志勇, 等.CoCr合金冠脉支架扩张变形的生物力学性能研究[J].功能材料, 2012, 43( 2): 182-186.
[12] 倪中华, 王跃轩, 程洁.球囊扩张式冠脉支架扩张变形机理数值模拟方法[J].机械工程学报, 2008, 4(1): 102-108.
[13] 王勤, 刘吉勇, 王传栋, 等.不同降解材料制备的分解食道支架体外降解研究[J].生物医学工程研究, 2011, 30(4): 211-215.
[14] FISHCHER E, STERZEL H, WEGNER G.Investigation of the structure of solution grown crystals of lactide copolymers by means of chemical reaction[J].Polymer, 1973, 251(11): 980-990.
Influence of Adhesion Method on Mechanical Property of PLA Intravascular Stent
JIANGXiao-tonga, b,WANGCong-era, b,WANGQiao-yia, b,ZHANGPei-huaa, b
(a. Key Laboratory of Textile Science & Technology, Ministry of Education; b. College of Textiles, Donghua University, Shanghai 201620, China)
A hand-made biodegradable intravascular stent with zig-zag structure was developed, which is made from polylactic acid (PLA) braided thread. Two kinds of PLA intravascular stent were prepared, and the crown peak adhesion of them was achieved by poly-caprolactone (PCL) tube and 4014 medical glue respectively. To study the influence of adhesion method on the mechanical properties of intravascular stent, expansion property, fastness of adhesion point, radial compression property and in vitro degradation were tested. The experimental results showed that the PLA intravascular stent with PCL tube adhesion had higher fastness and better expansion uniformity as well as higher radial compression recovery rate, but lower radial compression strength. Both stents had similar trend of radial compression performance in vitro degradation. PLA intravascular stent with PCL tube adhesion was more suitable for clinic.
polylactic acid (PLA); intravascular stent; adhesion point; mechanical property
1671-0444(2015)06-0743-07
2014-08-20
上海市科委资助项目(10411953300);高等学校学科创新引智计划资助项目(B07024)
姜晓彤(1989—),女,河北石家庄人,硕士研究生,研究方向为血管内支架的结构与性能.E-mail:jiangbianwutong@163.com
张佩华(联系人),女,教授,E-mail:phzh@dhu.edu.cn
R 318.08; R 318.11
A
