慢病毒介导SOX9基因转染小鼠脂肪干细胞的实验研究
2015-08-22李爱林
王 楷, 谢 亮, 李爱林
慢病毒介导SOX9基因转染小鼠脂肪干细胞的实验研究
王 楷, 谢 亮, 李爱林
目的 构建携带SOX9基因的慢病毒载体,转染小鼠脂肪干细胞,观察SOX9基因在脂肪干细胞中的表达。方法 将实验分为3组,体外培养、分化小鼠ADSCs,行免疫荧光鉴定后,使用RT-PCR的方法获取小鼠SOX9基因编码区片段,将该片段克隆入质粒Pwpxl-MOD2中产Pwpxl-MOD2-SOX9,将四质粒Pwpxl-MOD2-SOX9、pRsv-REV、pMDlg-pRRE、pMD2G共转染包装细胞293T,获得目的基因SOX9基因的重组病毒(实验组A);同时转染Pwpxl-MOD2,pRsv-REV,pMDlg-pRRE,pMD2G进另一组293T细胞包装产生空载体慢病毒作为阴性对照(实验组B);未转染组为实验组C。收集病毒后,通过基因测序和限制性核酸内切酶酶切的方法对质粒进行鉴定。将包装好的慢病毒Pwpxl-MOD2-SOX9体外转染脂肪干细胞,利用倒置荧光显微镜观察转染是否成功,并通过流式细胞仪测定转染效率。同时,利用RT-PCR和Western blot 检测小鼠 SOX9 基因的表达。结果 成功分离、培养大鼠的脂肪干细胞;酶切、PCR及测序鉴定证实,慢病毒载体质粒Pwpxl-MOD中插人片段为基因SOX9,包装产生的病毒能较为高效转染小鼠脂肪干细胞。RT-PCR 和 Western blot 检测显示,经 SOX9 基因转染的小鼠脂肪干细胞表达目的基因产物。结论 成功构建SOX9基因的慢病毒载体并感染脂肪干细胞后能够稳定表达SOX9,这为慢病毒及 SOX9 基因在软骨组织工程学中的进一步研究奠定了基础。
慢病毒; 脂肪干细胞; SOX9基因
随着物质生活水平的提高,人们对于美学的要求越来越高,而在整形美容中,利用假体材料进行整形美容手术,往往难以取得令人满意的结果,并会出现术后并发症。而软骨作为最早应用组织工程技术成功构建的组织之一[1],却发展较为缓慢,原因是缺乏软骨种子细胞。2001年,Zuk等[2]发现,脂肪抽吸物中存在具有骨、软骨、脂肪、肌肉等多向分化潜能的细胞。Gronthos等[3]进一步证实,脂肪组织中确实存在具有间充质干细胞特性的细胞。脂肪干细胞(adipose stromal cells, ASCs)为多向分化潜能的干细胞[4]。Furumatsu等[5]研究发现,SOX9基因在间充质细胞浓集和软骨形成阶段起关键作用。目前,慢病毒载体以其具有高效、安全和稳定表达等优点成为基因治疗的理想载体。自2012年5月开始,我们研究构建含SOX9基因的慢病毒载体,并感染ADSCs,进而检测SOX9基因在ADSCs中的稳定表达。
1 材料与方法
1.1 仪器与动物 实验动物 ICR小鼠(25 g),由武汉大学动物实验中心提供。仪器:倒置显微镜、荧光显微镜(日本OLYMPUS公司),DYY-6C型电泳电源(北京六一仪器厂),PCR仪(美国STRATAGENE公司),胶成像系统(上海天能科技有限公司)。
1.2 主要试剂 慢病毒载体Pwpxl-MOD由中国科学院上海生命科学研究院提供,其中载体质粒Pwpxl-MOD2能表达绿色荧光蛋白(GFP),小、大量抽提试剂盒,凝胶回收试剂盒购自湖北百奥斯公司;慢病毒包装细胞293T购自美国GENECOPOEIA公司;KOD-PLUS购自日本TOYOBO公司;Trizol、胎牛血清、胰蛋白酶均购自湖北百奥斯公司;引物由美国GENECOPOEIA公司合成;逆转录试剂盒购于国家日本TAKARA公司;抗小鼠SOX9一抗、抗小鼠collagen-Ⅱ购自北京博奥森公司;抗小鼠B-aetin-抗购自天津三箭公司;二抗购自北京博奥森公司。
2 方法
2.1 细胞传代培养 采用细胞体外培养颈椎脱臼法处死ICR小鼠,在无菌条件下切取小鼠腹部脂肪组织,仔细清除组织中肉眼可见的小血管和结缔组织,PBS冲洗5遍后剪碎,加人3倍体积0.1%的Ⅰ型胶原酶,37 ℃、水浴震荡消化50~70 min;加入等体积的高糖DMEM(含15%FBS),1500 r/min离心10 min,倾去上层脂肪及上清液,沉淀;用含15%FBS的高糖DMEM培养基稀释,200目滤网过滤、离心,将细胞收集到25 ml培养瓶中,置于37 ℃、5%CO孵箱中培养;48~72 h首次换液,去除未贴壁细胞;之后每2~3 d换液,5~7 d细胞长满80%~90%时,用0.25%胰酶+0.02%EDTA消化传代培养。
2.2 细胞培养后观察 向4孔内滴加CD44、CD29、CDl06、CD34兔抗小鼠多克隆抗体(1∶100)300 μl弃去一抗,PBS清洗3遍后,向每孔加入300 μl羊抗兔FITC标记的二抗(1∶100),室温孵育2 h后,弃二抗PBS,清洗3遍,荧光显微镜下观察并照相。
2.3 PCR方法获取基因片段 自Gene bank中获得小鼠SOX9的cDNA序列(NM_011448.4),上游引物选用BamH I,下游引物选用EcoR I。上游引物序列为:5′-AATICGGGATCCATGAATCTCCTGGACCCC-3′ ,下游引物序列为:5′-ATTGACCGAATTCGATCAAGGTCGAGTGAGC-3′,扩增出的PCR产物约为1530 bp。从小鼠肝脏中抽提总RNA,并利用RT-PCR反转录成cDNA,以该cDNA为模板,利用上述引物PCR扩增得到SOX9基因片段。PCR反应体系为:模板l μl,10×Buffer 2 μl,dNTP2 μl,KOD-2PLUS 1.0 μl,Primers l.0μl,dH2O加至20 μl反应体系。PCR反应条件为:95 ℃10 min,95 ℃10 s,60 ℃ 20 s,72 ℃ 20 s,共40个循环,最后经72 ℃总延伸10 min。目的产物经琼脂糖凝胶电泳分离、回收,获得SOX9基因片段。
2.4 慢病毒载体构建 将产物进行凝胶电泳后回收,对回收产物分别用BamH I和EcoR I进行双酶切,用DNA纯化试剂盒进行纯化,再用T4连接酶将双酶切载体和目的基因片段进行连接反应。
2.5 慢病毒包装、转染和滴度检测 将293T细胞胰蛋白酶消化,接种于25 ml的细胞培养皿中,将慢病毒包装系统中4种质粒DNA溶液和磷酸钙混合,转移至含单层细胞的培养液中,混匀;培养12 h后,弃去含有转染混合物的培养液,加入PBS 15 ml,轻摇后弃去,重复该步骤3次;收集转染72 h的293T细胞上清液;将收集的上清液于4 ℃,4000 r/min离心10 min,收集上清液;72 000 r/min离心120 min;4 ℃溶解过夜。病毒-70 ℃储存待用。于检测前1 d,向24孔板中各加入1×105个293T细胞待转染。次日取10 μl的病毒原液,逐次稀释10倍,共获得8个梯度的病毒液,然后分别转染293T 细胞。4 d后,用Trizol 提取总RNA 进行qPCR测定。按TaKaRa公司逆转录试剂盒说明,将RNA逆转录为cDNA。通过比较对照组与实验组的Ct 值差异,判断滴度值。
2.6 慢病毒载体感染ADSCs 取第3代生长状态良好的ADSCs,细胞达到70%~80%融合时,分别加入SOX9慢病毒载体及空慢病毒载体,以未感染慢病毒的ADSCs作为对照组。感染复数为50,轻轻混匀,培养箱中37 ℃过夜培养,48 h后荧光显微镜观察绿色荧光的表达。同时提取蛋白进行Western Blot检测SOX9的表达情况。
2.7 RT-PCR及检测SOX9的表达 提取细胞总RNA,β-aetin作内参。SOX9上游引物序列为:5′-TTCATGAAGATGACCGACGAGCAG-3′,下游引物序列为:5′-ACTTAATCCGGGTGGTCCTTCT-3′,扩增产物长度为490 bp;β肌动蛋白上游引物序列为:5′-AGATGTGGATCAGCAAGCAGGAGT-3′,下游引物序列为:5′-TCTCCGTTTCTGCGCCGTTAGGTTT-3′,扩增产物长度为198 bp。PCR产物用2%琼脂糖凝胶电泳进行鉴定,凝胶成像系统成像拍照。
3 结果
3.1 ASCs的分离培养 原代培养的ASCs 24 h即可见细胞贴壁,多数贴壁细胞呈圆形,其中散在少量的梭形细胞或多角细胞;3 d后梭形细胞逐渐增多,可见核分裂相;5 d后细胞呈团簇状生长,形成集落;约7 d细胞融合超过90%时,传代3代后细胞形态比较均一,成长梭形(图1)。
3.2 慢病毒载体的构建 构建出的慢病毒载体用BamH I/EcoR I双酶切,取酶切产物10 μl检测鉴定,经上海GENECHEM 公司进行DNA 测序和比对分析,结果发现,测序结果与目标序列完全一致(1530 bp),说明SOX9过表达载体构建成功(图2)。
3.3 慢病毒质粒在293T细胞中的表达 目的质粒转染293T细胞24 h后,观察荧光的表达情况。未经目的质粒转染的293T细胞作为对照。经目的质粒转染24 h后的293T细胞,可以观察到绿荧光的表达(图3)。
3.4 慢病毒滴度测定 在本实验滴度检测中,实验组和对照组样品的Ct值存在1个左右差异,认为在实验组样品中存在病毒颗粒。又因为RNA 逆转录获得9 μl cDNA,而进行qPCR测定只用了1 μl,因此滴度为:9/(1×10-4~1×10-3)=9×107TU/ml。
3.5 RT-PCR检测结果 基因转染48 h后,提取细胞总RNA进行RT-PCR分析,结果显示,转染组出现一大小约490 bp的条带,符合预期结果,而未转染组未发现SOX9基因的表达(图4)。
3.6 Western Blot 结果 转染2周后提取细胞总蛋白进行印记分析,结果显示SOX9基因可以检测到阳性条带,其大小与SOX9融合蛋白相吻合,对照组未检测到明确的阳性条带(图5)。
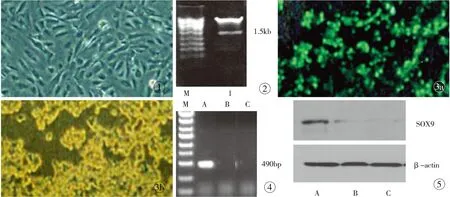
图1 细胞形态学观察发现ADSCs呈梭型、多角形和扁平型(×40) 图2 BamHl/EcoR l酶切鉴定(1号克隆为阳性克隆; M为标准参照物) 图3 慢病毒载体转染293T细胞24 h a. 经转染293T b. 未经转染293T 图4 基因转染48 h后RT-PCR检测 图5 基因转染48 h后Western Blot 检测
Fig 1 Cell morphology showed spindle shaped, polygonal and flat type ADSCs (×40). Fig 2 The BamHl/EcoR l enzyme cutting identification (Clone 1: positive clones; M: the standard reference material). Fig 3 Transfected 293T cells by Lentiviral vector at 24 hours.a. Transfected 293T cells. b. non-transfected 293T cells. Fig 4 Transfected gene detected by RT-PCR at 48 hours. Fig 5 Transfected gene detected by Western Blot at 48 hours.
4 讨论
软骨细胞是构建软骨组织效果最理想的种子细胞,但人体内可使用的软骨细胞数量极为有限,存在取材创伤大、多次传代后又极易发生老化与去分化等问题,丧失软骨形成能力,因此,应用软骨细胞构建软骨组织在临床上难以推广应用。ASCs具有分布广泛、可利用细胞量大、取材容易等优点[6],为ASCs作为种子细胞应用于组织工程研究提供了可能。
Sox9基因是一种重要的早期胚胎发育相关基因,拥有位于羟基端HMG结构域及位于氨基端转录激活结构域,参与诸如性别决定、软骨形成等多种早期胚胎发育过程,在除肥大的软骨细胞外的所有软骨前体细胞和软骨细胞中均有表达,SOX9属于SOX基因家族E亚组,具有典型的转录因子结构。研究证明,SOX9主要在软骨细胞中表达,是软骨发育形成过程中的关键转录因子,对软骨的发育成熟等过程起着重要的调节作用,在胚胎发育过程中,SOX9基因决定间充质干细胞的聚集和向软骨细胞的分化[7-9],如果SOX9失活,其软骨分化被遏制。SOX9可以与SOX5、SOX6 等分子共同作用,促进软骨细胞的增殖,激活软骨细胞特征分子如Ⅱ型胶原、aggrecan蛋白等的表达,从而调控软骨分化[10-11]。
慢病毒载体属于一种新型的逆转录病毒载体,其感染宿主细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒,故该病毒具有极高的生物安全性[12]。慢病毒载体的最大优势在于可以同时高效感染分裂期和非分裂期的细胞, 而且目的基因可以在宿主细胞中持续稳定表达[13-14],因此,慢病毒成为目前基因治疗技术中较理想的载体。
本实验中,我们通过将获得的SOX9基因与Pwpxl-MOD2质粒经酶切后,成功形成重组慢病毒载体Pwpxl-MOD2-SOX9。经DNA 测序和比对分析,结果发现,测序结果与目标序列完全一致,说明SOX9过表达载体构建成功。慢病毒载体Pwpxl-MOD2-SOX9转染小鼠ASCs 48 h后,经 RT-PCR 检测,A 组细胞出现SOX9 mRNA 的表达,而对照组未见SOX9基因的表达。Western blot 结果显示,A组细胞开始表达目的蛋白SOX9,证实SOX9目的基因已成功转染 ADSCs 并获得表达。A组倒置荧光显微镜下观察,发现绿色荧光的表达,流式细胞仪检测结果显示转染效率约为73.1%。
综上所述,本实验中携带小鼠SOX9 基因的慢病毒载体被成功构建,并且高效转染小鼠脂肪干细胞获得稳定表达SOX9 的宿主细胞。这为进一步研究SOX9 基因促进脂肪干细胞成软骨分化及慢病毒载体在软骨组织工程中的应用奠定了一定的实验基础。目前,软骨组织工程各方面的研究发展迅速,但距其在临床方面的实际应用还有较大差距。整合外来基因的种子细胞,形成了组织工程软骨,能否应用于组织替代或重建尚需进一步研究。
[1] Langcr R, Vaeanti JP. Tissue engineering[J]. Science, 1993,260(5110):920-926.
[2] Zuk PA, Zhu Min, Mizuno H, et al. Multilineage cells from human adipose tissue:implications for cell·based therapies[J]. Tissue Eng, 2001,7(2):211-228.
[3] Gronthos S, Franklin DM, Leddy HA, et al. Surface protein characterization of human adipose tissue-derived stromal cells[J]. J Cell Physiol, 2001,189(1):54-63.
[4] 赵珮娟, 程 辰, 谢 芸, 等. 脂肪来源干细胞相关生长因子及其作用的研究进展[J]. 组织工程与重建外科杂志, 2013,(5):285-288.
[5] Furumatsu T, Shukunami C, Amemiya-Kudo M, et al. Sderaxis and E47 cooperatively regulate the SOX9 dependent transcription[J]. Int J Biochem Cell Biol, 2010,42(1):148-156.
[6] 安荣泽, 赵俊延, 王兆杰, 等. 脂肪干细胞与骨髓间充质干细胞成软骨能力的比较[J]. 中国组织工程研究, 2013,(32):5793-5798.
[7] Kadaja M, Keyes BE, Lin M, et al. SOX9: a stem cell transcriptional regulator of secreted niche signaling factors[J]. Genes Dev, 2014,28(4):328-341.
[8] Huang BL, Brugger SM, Lyons KM, et al. Stage-specific control of connective tissue growth factor (CTGF/CCN2) expression in chondrocytes by Sox9 and beta-catenin[J]. J Biol Chem, 2010,285(36):27702-27712.
[9] Yamashita S, Miyaki S, Kato Y, et al. L-Sox5 and Sox6 proteins enhance chondrogenic miR-140 MicroRNA expression by strengthening dimeric Sox9 activity[J]. J Biol Chem, 2012,287(26):206-215.
[10] Konishi E, Nakashima Y, Iwasa Y, et al. Immunohistochemical analysis for SOX9reveals the cartilaginous character of chondroblastoma and chondromyxoid fibroma of the bone[J]. Hum Pathol, 2010,41(2):208-213.
[11] 许 运, 陈 亮, 史 勇, 等. SOX9基因修饰骨髓间充质干细胞并诱导其向髓核样细胞分化的实验研究[J]. 重庆医学, 2013,42(1):8-12.
[12] 白洁玉, 梁大川, 程 鹏, 等. 慢病毒介导SOX9基因转染骨髓间充质细胞中的基因表达[J]. 中国骨伤, 2013,26(7):597-600.
[13] 徐广峰, 赵亚萍, 史春梅, 等. miR-26b慢病毒载体构建及其在人前体脂肪细胞中的表达验证[J]. 江苏医药, 2014,40(3):249-251.
[14] 周 瑜, 夏长所, 王昌耀, 等. 慢病毒介导TGF-β3/BMP-2联合基因转染诱导兔骨髓间充质干细胞成软骨细胞分化[J]. 中华临床医师杂志(电子版), 2014,(4):688-694.
Experimental study of lentiviral vector of SOX9 gene transducing adipose stromal cells
WANGKai,XIELiang,LIAi-lin.
(DepartmentofCosmeticSurgery,WuhanHuayaPlasticHospital,Wuhan430060,China)
Objective To construct the lentiviral vector containing SOX9 gene and to detect its expression in ADSCs derived from mouse fat and observe the expression of target gene. Methods ADSCs divided into 3 groups were isolated, cultured, and then identified by immunofluorescence assay, mice SOX9 gene coding region fragment was obtained by RT-PCR and then cloned into the plasmid of Pwpxl-MOD2 to form Pwpxl-MOD2/SOX9. Pwpxl-MOD2/SOX9, pRsv-REV, pMDlg-pRRE and pMD2G were co-transfected into 293T cells to obtain recombinant virus containing SOX9 gene (Group A). Meanwhile Pwpxl-MOD2, pRsv-REV, pMDlg-pRRE and pMD2G were transfected into another group of 293T cells as a control group packing into blank Lentiviral vector (Group B), the untransfected group as the experimental group C. Then the packed Lentiviral vector was transfected into ADSCs which derived from mouse fat, and the Lenti-SOX9-ADSCs was selected by inversion fluorescence microscope. The expression of SOX9 gene was detected by RT-PCR and Western blot. Results We succeeded in separating and culturing mice ADSCs; the sequencing and restriction analysis showed that SOX9 gene fragment was correctly connected and cloned into the plasmid Pwpx1-MOD in Lentiviral vectors. The expression of Sox9 gene was confirmed by RT-PCR and Western blot. Conclusion Lenti-SOX9-ADSCs has the phenotypes of chondrocytes, and providing reliable genetic basis for the tissue-engineering in plastic applications.
Lentivirus; Adipose stromal cells; SOX9 gene
湖北省自然科学基金资助项目(2012FFB04425)
430060 湖北 武汉,武汉华亚美容医院 美容外科(王 楷);湖北医药学院附属人民医院 烧伤整形科(谢 亮);武汉大学人民医院 整形外科(李爱林)
王 楷 (1988-),男,湖北人,医师,硕士.
李爱林,430060,武汉大学人民医院 整形外科,电子信箱:superlin123@126.com
10.3969/j.issn.1673-7040.2015.04.012
R-332
A
1673-7040(2015)04-0224-04
2014-12-26)
