IrrE重组大肠杆菌的构建和性能分析
2015-08-09工业发酵微生物教育部重点实验室天津市工业微生物重点实验室天津科技大学生物工程学院天津300457
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457)
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457)
利用 pET-28a(+)质粒将来源于耐辐射异常球菌(Deinococcus radiodurans)R1的 irrE基因在大肠杆菌(Escherichia coli)BL21(DE3)中进行异源表达,在IPTG终浓度 2,mmol/L、诱导温度37,℃、诱导培养6,h条件下进行了蛋白诱导.进一步考察 IrrE异源表达对大肠杆菌生长性能和耐受能力的影响,结果表明:IrrE的表达能够提高大肠杆菌正常条件下的生长速率和最终生物量;同时,能够不同程度提高大肠杆菌在压力冲击下的存活能力,其中,高渗条件下存活能力的提高最为明显.而重组菌株在压力冲击下的生长速率和最终生物量均明显高于对照菌株.这说明 IrrE在提高大肠杆菌的压力耐受性方面表现出良好的效果.
IrrE;大肠杆菌;异源表达;全局转录;耐受性
采用微生物细胞工厂生产各种化学品的过程中,有机化学品产物或有害的环境(高温和低温、极端pH、渗透压、营养饥饿、有害的底物、有毒的污染物、高浓度的代谢产物或者副产物等)往往会对微生物细胞或胞内酶产生严重的毒害效应,从而导致细胞死亡或酶催化剂失活,进而严重影响生物催化转化过程的生产效能.因此,越来越多的研究者开始关注如何获得满足各种工业应用属性的微生物菌种.与自然分离的方法相比,利用现代分子生物学技术对微生物进行遗传改造是提高其环境耐受性的更为有效方法[1].
近年来,单个外源与抗逆性相关基因的异源表达已成为提高宿主微生物耐受性的重要途径[2-3].但生物的代谢途径呈网络体系,细胞表型与基因之间并非简单的线性对应关系,细胞的耐受性往往由多个基因共同控制.因此,单个或几个基因的改造和修饰对于目标表型整体水平上的提高表现出一定的局限性[4-5].2006年,美国麻省理工学院的Alper等[6]提出了全局转录机制工程(也称全转录工程,global transcription machinery engineering,gTME)的概念,该技术通过基因工程方法改造全局转录调控因子使得整个转录调控过程发生变化,是一种在整体水平上改变细胞基因组转录,获得有益细胞表型的全新的定向进化方法.
IrrE是来源于耐辐射异常球菌(Deinococcus radiodurans)R1的一个全局转录因子.2010年,Ying等[7]将耐辐射异常球菌中的 irrE基因在运动发酵单胞菌(Zymomonas mobilis)异源表达,有效地提高了微生物对乙醇、酸、渗透压和热冲击等多重压力的耐受性,使得菌种在发酵过程高醇和高酸的压力下仍然保持旺盛的生长和代谢活力,乙醇产量达到 14.59,g/L,比改造前菌株的生产能力提高了 66.7%.同年,高加旺等[8]利用穿梭质粒pRADZ3将irrE转入枯草芽孢杆菌中进行稳定表达.对数期和稳定期内重组菌对H2O2氧化压力的耐受能力分别提高了10%和7%,紫外线辐照下的存活率提高2倍左右.这些结果表明,IrrE作为一个全局转录因子在微生物耐受性表型的定向进化中表现出广泛的应用潜力.
本文利用pET-28a(+)质粒将来源于耐辐射异常球菌(D.,radiodurans)R1的 irrE基因在大肠杆菌(Escherichia coli)BL21(DE3)中进行异源表达,通过调整 IPTG浓度和诱导温度等参数对诱导条件进行优化.考察了 IrrE异源表达对大肠杆菌生长性能及其对各种条件耐受能力的影响.该工作为深入研究全局转录因子 IrrE在微生物耐受性表型定向进化中的作用奠定了基础.
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
大肠杆菌(Escherichia coli)BL21(DE3)由本研究室保存;耐辐射异常球菌(Deinococcus radiodurans)R1购买自普通微生物菌种保藏中心.
质粒pET-28a(+)由本研究室保存.
1.1.2 主要试剂和工具酶
限制性内切酶 NcoI、EcoRI,Takara公司;HiFi DNA Polymerase;T4连接酶,Promega公司;卡那霉素、IPTG,生工生物工程(上海)股份有限公司.
蛋白电泳主要溶液、蛋白上样缓冲液等均按Takara公司商品说明书配制.
SanPrep柱式PCR产物纯化试剂盒,生工生物工程(上海)股份有限公司;Easy Pure plasmid Miniprep Kit,TransGen Biotech;柱式 DNA胶回收试剂盒,北京天恩泽基因科技有限公司;Ni-Agarose His标签蛋白纯化试剂盒(可溶型蛋白),康为世纪公司.
1.1.3 培养基
LB(Luria-Bertani)培养基(g/L):胰蛋白胨10、酵母浸出粉5、NaCl 5,pH 7.0.
LA培养基(g/L):胰蛋白胨 10、酵母浸出粉 5、NaCl 5、琼脂粉20,pH 7.0~7.2.
1.2 方法
1.2.1 IrrE重组大肠杆菌的构建
从NCBI中获得irrE基因的序列信息,由Primer 5软件设计引物 P1:TGCCATGGAAATGCCCAGTG CCAACGTC和P2:TCGAATTCCTGTGCAGCGTCC TGCGG(下划线部分分别为NcoI和EcoRI的酶切位点).以耐辐射异常球菌 R1总 DNA为模板,使用HiFi DNA Polymerase酶进行PCR(扩增条件:94,℃预变性 5,min,94,℃变性 30,s,63,℃退火 30,s,72,℃延伸1,min,30个循环,72,℃延伸10,min).扩增得到的irrE用NcoI和EcoRI双酶切后插入pET-28a(+)的NcoI和EcoRI位点之间,采用热激法转入大肠杆菌BL21,通过菌液PCR(菌液扩增条件:94,℃预变性10,min,94,℃变性30,s,55,℃退火30,s,72,℃延伸1,min,30个循环,72,℃延伸10,min)和测序对IrrE重组大肠杆菌进行筛选和鉴定.
1.2.2 IrrE在大肠杆菌中的表达条件的优化
将重组菌 E. coli BL21(DE3)/pET-28a(+)-irrE和含有空质粒的E.,coli BL21(DE3)/pET-28a(+)(对照菌株)分别接种于50,mL含有卡那霉素(50,µg/mL)的 LB液体培养基中,37,℃、180,r/min振荡过夜培养.以 1%接种量接入 50,mL 含有卡那霉素(50,µg/mL)的LB培养液中,37,℃、180,r/min培养至A600约为 0.6,加入不同终浓度的 IPTG,在不同温度下诱导6,h,6,000,r/min离心5,min收集适量菌体,加入蛋白上样缓冲液,沸水浴 5,min,10,000,r/min离心5,min后取上清液,进行SDS-PAGE电泳.
1.2.3 IrrE表达对大肠杆菌生长特性的影响
挑取 IrrE重组大肠杆菌和含有空质粒的 E.,coli BL21(DE3)/pET-28a(+)(对照菌株)分别接种于50,mL含有卡那霉素(50,µg/mL)的 LB液体培养基中,37,℃、180,r/min振荡过夜培养,将两个菌的培养液 A600调为相同,然后以 0.5%接种量转接到新鲜的含有2,mmol/L IPTG、50,µg/mL卡那霉素的LB液体培养基中,37,℃、180,r/min振荡培养,每间隔 2,h取样测定A600,绘制生长曲线.
1.2.4 IrrE表达对大肠杆菌压力耐受能力的影响
将 IrrE重组大肠杆菌和含有空质粒的 E.,coli BL21(DE3)/pET-28a(+)(对照菌株)分别接种于50,mL含有卡那霉素(50,µg/mL)的 LB液体培养基中,37,℃、180,r/min振荡过夜培养.以 1%接种量接入 50,mL含有卡那霉素(50,µg/mL)的 LB液体培养基中,37,℃、180,r/min培养至A600约为0.6,此时,加入终浓度为 2,mmol/L的 IPTG,37,℃下诱导培养6,h.取1,mL培养液,6,000,r/min离心10,min收集菌体,将两个菌的菌体质量调为相同后分别转接到50,mL含有不同压力冲击条件(3,mol/L山梨醇、极端pH 2或12、体积分数10%甲醇、体积分数12%乙醇、体积分数 1%H2O2)和卡那霉素(50,µg/mL)的 LB培养基中冲击30,min.冲击后的培养液采用10倍逐级稀释法在含卡那霉素(50,µg/mL)的 LA平板上进行涂布,37,℃培养 16,h后观察不同稀释度下平板上的菌落数量,按照式(1)计算存活率.

挑取IrrE重组大肠杆菌和含有空质粒的E.,coli BL21(DE3)/pET-28a(+)(对照菌株)分别接种于50,mL含有卡那霉素(50,µg/mL)的 LB液体培养基中,37,℃、180,r/min振荡过夜培养,将两个菌的培养液 A600值调为相同,以 0.5%接种量分别转接到新鲜的含有2,mmol/L IPTG、50,µg/mL卡那霉素的LB液体培养基中,向培养基中分别加入终浓度为 1,mol/L的山梨醇溶液、4%乙醇和 5%甲醇继续培养,37,℃、180,r/min振荡培养,每间隔2,h取样测定A600值,绘制生长曲线,考察不同压力冲击条件下野生型 IrrE重组大肠杆菌的生长能力.
2 结果与讨论
2.1 IrrE重组大肠杆菌的构建
以 pET-28a(+)载体上的通用引物 T7/T7ter进行菌液 PCR验证,筛选阳性克隆,结果如图 1所示.由图 1可知:电泳条带约 1,200,bp,与预计大小相符.将该阳性克隆中的质粒重提后进行测序,测得的序列信息与GenBank(登录号AE000513)中发表的耐辐射异常球菌(Deinococcus radiodurans)R1来源的 irrE基因(DR0167)[8]进行比对,结果显示具有99%同源性,说明IrrE重组大肠杆菌构建成功.
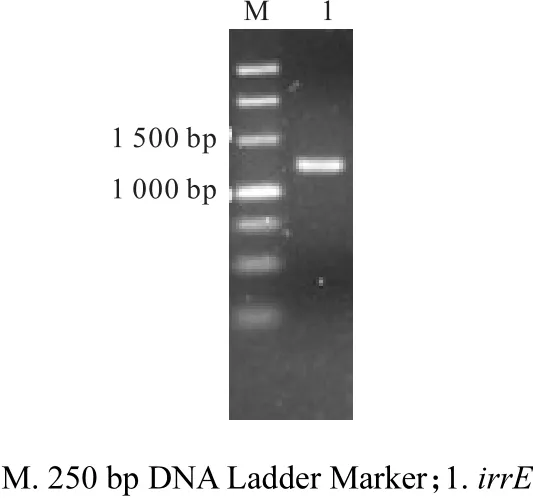
图1 E.,coli BL21(DE3)/pET-28a(+)-irrE的菌液PCR结果Fig. 1 PCR products of E.,coli BL21(DE3)/pET-28a(+)-irrE
2.2 IrrE在大肠杆菌中的表达条件的优化
将含有重组质粒 pET-28a(+)-irrE的 E.,coli BL21(DE3)菌株在不同的条件下进行诱导培养,收集细胞,制备蛋白样品.利用SDS-PAGE检测目的蛋白的表达情况,结果如图2所示.
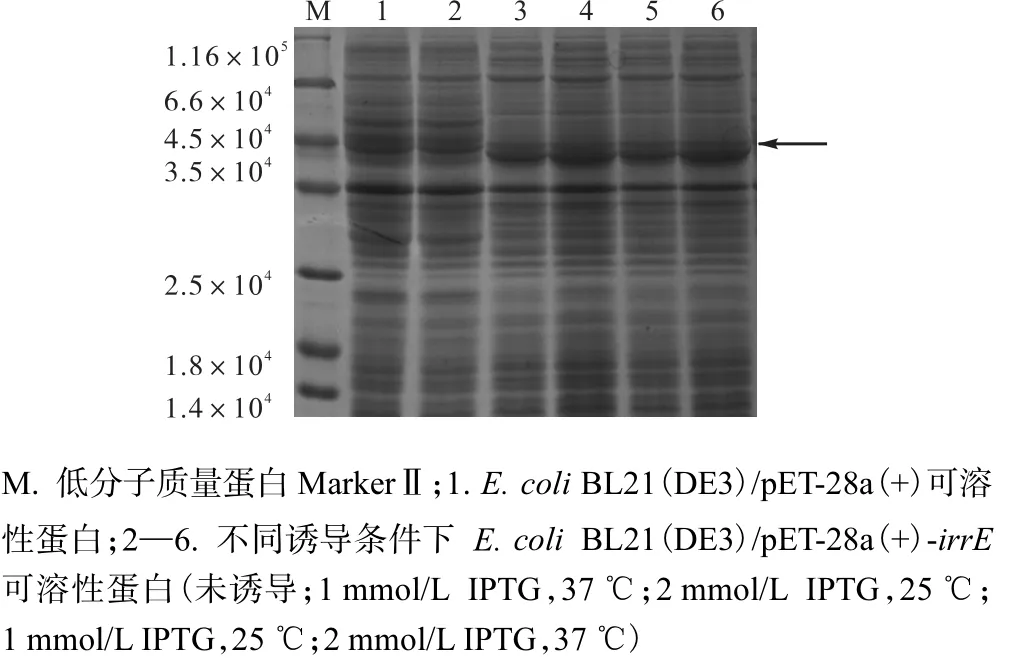
图2 E.,coli BL21(DE3)/pET-28a(+)-irrE和E.,coli BL21(DE3)/pET-28a(+)的蛋白电泳图Fig. 2 The SDS-PAGE of E.,coli BL21(DE3)/pET-28a(+)-irrE and E.,coli BL21(DE3)/pET-28a(+)
由图2可知:不同浓度的IPTG均能够诱导目的蛋白的表达,当IPTG浓度达到2,mmol/L,37,℃培养6,h时,目的蛋白的可溶性表达最为明显.因此,确定IrrE蛋白的最佳诱导条件为IPTG终浓度2,mmol/L、诱导温度37,℃、诱导时间6,h.
2.3 IrrE表达对大肠杆菌生长特性的影响
在不添加压力的培养基中IrrE重组大肠杆菌和对照菌的生长曲线如图 3所示.在不添加压力的培养基中,野生型IrrE重组大肠杆菌和对照菌株在8,h左右进入对数期,14,h时开始进入稳定期.两个菌株的生长阶段的划分情况基本一致,但是 IrrE重组大肠杆菌的生长速率和最终生物量均高于对照菌株.这说明IrrE的表达能够提高大肠杆菌的生长特性.
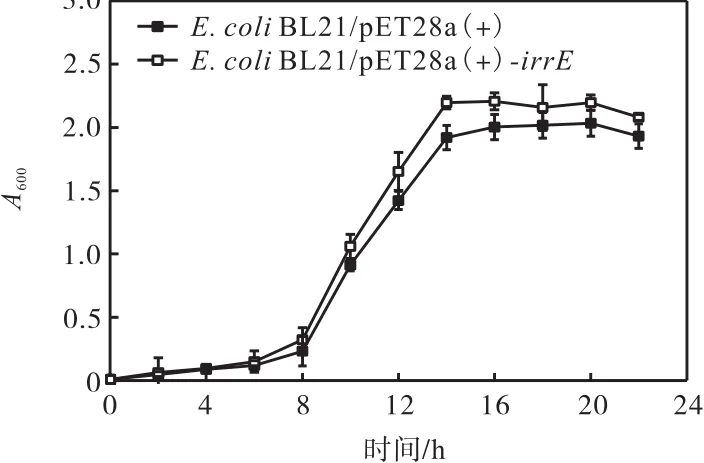
图3 IrrE重组大肠杆菌和对照菌的生长曲线Fig. 3 Growth curves of recombinant strain E.,coliandthe control strain E. coli
2.4 IrrE表达对大肠杆菌压力耐受能力的影响
2.4.1 IrrE表达对大肠杆菌压力冲击条件下存活情况的影响
各种压力冲击下 IrrE重组大肠杆菌和对照菌的存活情况如图 4所示.IrrE重组大肠杆菌在 1% H2O2、极端pH、12%乙醇这3种压力冲击下的存活率差别不大,在 10%左右波动,但均高于对照菌株.在10%甲醇和 3,mol/L山梨醇的压力冲击下,IrrE重组大肠杆菌存活率分别为 37.5%和 44.9%,比对照菌分别提高了5%和10%左右.以上结果说明IrrE的表达能够不同程度地提高大肠杆菌在压力冲击下的存活能力.
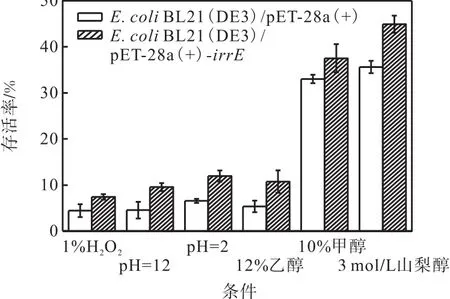
图4 各种压力冲击下 IrrE 重组大肠杆菌和对照菌的存活情况Fig. 4 Cell viability of recombinant strain E.,coliand the control strain E.,coli under various kinds of stress shock
2.4.2 IrrE表达对大肠杆菌压力冲击条件下生长情况的影响
IrrE重组大肠杆菌和对照菌在不同压力冲击条件下的生长曲线如图5所示.在4%乙醇压力冲击条件下 IrrE重组大肠杆菌和对照菌株的适应期约为10,h,而在5%甲醇和1,mol/L山梨醇的压力冲击条件下,两个菌株的适应期为 8,h,表现出更好的适应能力.3种压力冲击条件下,IrrE重组菌株的生长速率和最终生物量均明显高于对照菌株.其中,在1mol/L山梨醇条件下,IrrE重组菌株进入稳定期后的A600达到1.70左右,比对照菌株提高了21%.这说明IrrE的表达能够有效提高大肠杆菌对有机溶剂和渗透压这两种压力的耐受性.
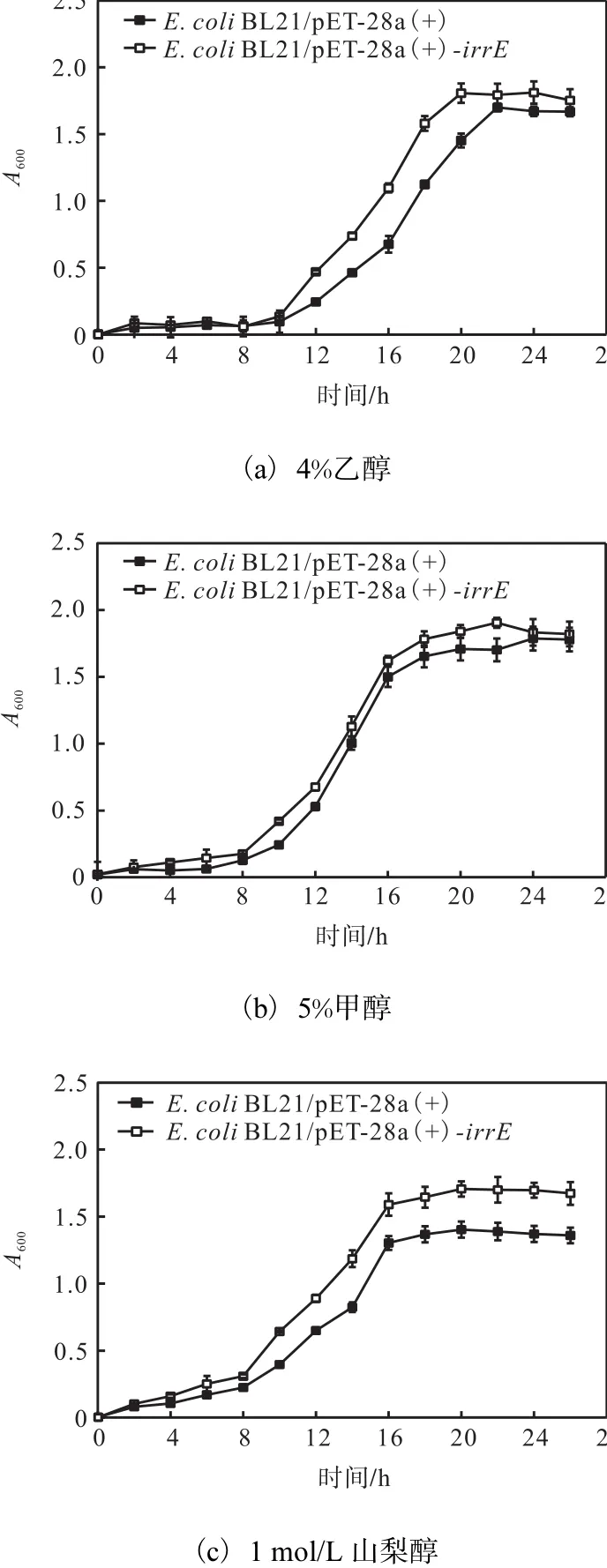
图5 IrrE重组大肠杆菌和对照菌在不同压力冲击下的生长曲线Fig. 5 Growth curves of recombinant strain E.,coliand the control strain E.,coli under various kinds of stress
3 结 语
本文将来源于耐辐射异常球菌(Deinococcus radiodurans)R1的 irrE基因在模式微生物大肠杆菌(E.,coli)中进行异源表达,分析了 IrrE表达对大肠杆菌不同压力耐受能力的影响.结果表明 IrrE能够不同程度地提高大肠杆菌在 3,mol/L山梨醇、pH=2、pH=12、10%甲醇、12%乙醇和1%H2O2压力冲击下的存活能力,同时改善大肠杆菌在 4%乙醇、5%甲醇及1,mol/L山梨醇压力下的生长情况.这些结果表明,IrrE在微生物复杂表型的定向进化方面表现出良好的效果.
[1] Nicolaou S A,Gaida S M,Papoutsakis E T. A comparative view of metabolite and substrate stress and tolerance in microbial bioprocessing:From biofuels and chemicals,to biocatalysis and bioremediation[J]. Metabolic Engineering,2010,12(4):307-331.
[2] 刘瑞杰,陈婷,曹军卫. 渗透压调节基因proBA的融合表达对大肠杆菌耐高渗胁迫能力的影响[J]. 微生物学报,2005,45(1):23-26.
[3] Mahin A A,Sugimoto S,Higashi C,et al. Improvement of multiple-stress tolerance and lactic acid production in Lactococcus lactis NZ9000 under conditions of thermal stress by heterologous expression of Escherichia coli dnaK[J]. Applied and Environmental Microbiology,2010,76(13):4277-4285.
[4] Alper H,Miyaoku K,Stephanopoulos G,. Construction of lycopene-overproducing E. coli strains by combining systematic and combinatorial gene knockout targets[J]. Nature Biotechnology,2005,23(5):612-616.
[5] Alper H,Jin Y S,Moxley J F,et al. Identifying gene targets for the metabolic engineering of lycopene biosynthesis in Escherichia coli[J]. Metabolic Engineering,2005,7(3):155-164.
[6] Alper H,Stephanopoulos G,. Global transcription machinery engineering:A new approach for improving cellular phenotype[J]. Metabolic Engineering,2007,9(3):258-267.
[7] Ying Z,Ma R Q,Zhao Z L,et al. irrE,an exogenous gene from Deinococcus radiodurans,improves the growth of and ethanol production by a Zymomonas mobilis strain under ethanol and acid stresses[J]. Journal of Microbiology and Biotechnology,2010,20(7):1156-1162.
[8] 高家旺,谢水波,唐振平,等. 奇球菌 pprI基因增强枯草芽孢杆菌细胞抗性的研究[J]. 南华大学学报:自然科学版,2010,24(1):78-82.
IrrE重组大肠杆菌的构建和性能分析
骆健美,郑媛媛,王 敏
The Construction of Recombinant Escherichia coli by IrrE and Cell Performance Analysis
LUO Jianmei,ZHENG Yuanyuan,WANG Min
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
The heterologous expression of irrE,from Deinococcus radiodurans R1,in E. coli BL21(DE3)was carried out using the vector pET-28a(+). The optimal protein expression conditions of IrrE were as follows.The final concentration of IPTG was 2,mmol/L,and the induction temperature and time were 37,℃ and 6,h,respectively. The influence of IrrE on cell growth and tolerance was further investigated. The results indicated that IrrE could enhance the growth rate and produce more final biomass of Escherichia coli under normal conditions,and improve the survival ability of the cell under stress shock to different extent,especially the tolerance to osmotic shock. The growth rate was higher and significantly morefinal biomasses of the recombinant strain containing pET-28a(+)-irrE under stress were found than in the control strain(harboring the empty vector pET-28a(+)). It can be concluded that the expression of IrrE could enhance the tolerance of E. coli to stress.
IrrE;Escherichia coli;heterologous expression;global transcription;tolerance
Q786 文献标志码:A 文章编号:1672-6510(2015)02-0006-05
10.13364/j.issn.1672-6510.20140064
2014-04-25;
2014-05-27
国家自然科学基金资助项目(21306138);天津市自然科学基金资助项目(13JCYBJC20600)
骆健美(1978—),女,湖南人,教授,luojianmei@tust.edu.cn.
周建军
