苦参素对人肺腺癌A549细胞放射敏感性的影响及其机制
2015-08-08史卫林李坚陆建保陈萍周玉涛
史卫林,李坚,陆建保,陈萍,周玉涛
(1.溧阳市人民医院呼吸内科,江苏溧阳213300;2.江苏大学附属医院呼吸内科,江苏镇江212001)
苦参素对人肺腺癌A549细胞放射敏感性的影响及其机制
史卫林1,李坚2,陆建保1,陈萍2,周玉涛1
(1.溧阳市人民医院呼吸内科,江苏溧阳213300;2.江苏大学附属医院呼吸内科,江苏镇江212001)
目的:观察苦参素联合放射线照射对人肺腺癌A549细胞增殖率以及DNA依赖性蛋白酶(DNA dependent protein kinase,DNA-PK)的两类结构亚基DNA-PKcs及Ku80 mRNA表达的影响。方法根据不同的处理条件,将A549细胞分为对照组,单纯照射组,单纯药物组,药物联合照射组。通过CCK-8法检测细胞增殖率,并应用实时荧光定量PCR技术检测DNA-PKcs及Ku80 mRNA的相对表达水平。结果:苦参素明显抑制A549细胞的增殖,呈时间和剂量依赖性(P<0.05),其24 h和48 h的半数抑制浓度(IC50)值分别为3.2 g/L和2.4 g/L。单纯照射组随着照射时间的延长和放射线剂量的增加,细胞增殖率明显下降(P<0.05);药物联合照射组细胞随着照射时间的延长,细胞增殖率也随之明显下降(P<0.05);在同一时间点,药物联合照射组细胞增殖率下降比单纯照射组更为明显(P<0.05)。此外,在单纯照射组中,A549细胞DNA-PKcs及Ku80 mRNA的相对表达水平随着照射时间的延长和放射线剂量的增加而增高(P<0.01);较对照组而言,单纯药物组DNA-PKcs及Ku80 mRNA的相对表达水平明显下调(P<0.01);与对应的单纯照射组比较,药物联合照射组DNA-PKcs及Ku80 mRNA相对表达水平明显下调(P<0.01)。结论:苦参素对肿瘤细胞具有放射线增敏作用。辐射可明显增加肺癌细胞DNA-PKcs及Ku80 mRNA的相对表达水平,苦参素对A549细胞的放射线增敏效应至少部分是与抑制DNA-PKcs及Ku80 mRNA的表达,从而抑制DNA损伤修复有关。
肺癌;苦参素;放射敏感性;DNA依赖性蛋白酶
放疗是中晚期肺癌患者的一个重要治疗手段。肿瘤细胞受到放射线照射后主要发生碱基损伤、DNA单链断裂、DNA双链断裂以及DNA-蛋白质交联等损伤,其中最主要是双链断裂,而细胞可以修复双链断裂从而对放射线产生放疗耐受。现有研究认为DNA依赖性蛋白酶(DNA dependent protein kinase,DNA-PK)通过修复双链断裂,影响细胞对放射线的敏感性[1]。DNA-PKcs及Ku80是DNA-PK的结构亚基,参与DNA非同源末端连接(non-homologous end joining,NHEJ)修复,是研究肿瘤细胞放疗敏感性的重要靶点。近年来,虽然肿瘤放疗技术已取得较大进展,但仍有部分患者放射治疗失败。而且对放射治疗有效的患者复发后再放疗效果常常不明显,究其原因主要与肿瘤细胞对放射线耐受有关。苦参素是中药苦参的主要活性成分之一,具有放疗增敏作用[2],但机制尚未阐明。本实验通过观察苦参素联合放射线照射对肺癌A549细胞增殖率以及DNA-PKcs、Ku80 mRNA表达的影响,探讨苦参素放疗增敏的作用机制。
1 材料与方法
1.1 主要试剂与仪器
DMEM培养基和0.25%胰蛋白酶(美国Gibco公司),苦参素标准品(北京中科仪友化工技术研究院),CCK-8试剂盒(生工生物工程上海股份有限公司),Trizol试剂盒(美国Invitriogen公司),反转录试剂盒和荧光定量PCR试剂盒(日本TaKaRa公司),倒置式生物显微镜(日本奥林巴斯公司),Clinac 600c 6MV直线加速器(美国Varian公司),HT-2型酶标仪(Austria公司),荧光定量PCR分析仪(美国Stratagene公司),人肺腺癌A549细胞株由江苏大学医学院提供。
1.2 苦参素作用于A549细胞后细胞增殖率的测定
取对数生长期的A549细胞,接种至96孔板,每孔100μL(细胞数约5×103/孔),每一实验组(按苦参素浓度)设6个复孔,培养12 h后移液枪小心吸取上清液,分别将含有苦参素质量浓度为0,0.5,1.0,2.0以及4.0 g/L的培养基100μL加入对应的孔中,其中0 g/L设为阴性对照组,同时设立空白组。然后置于37℃、5%CO2培养箱孵育,分别在培养24 h和48 h后于对应的各孔中加CCK-8试剂10 μL,继续于37℃恒温条件下培养1 h,酶标仪上测定450 nm处光密度(D)值。实验重复3次。用空白组调零后,计算各组细胞增殖率(细胞增殖率=实验组D值/对照组D值×100%)。
1.3 单纯照射和药物联合放射线作用后细胞增殖率的测定
根据细胞抑制率,利用SPSS 17.0软件计算出半数抑制浓度(IC50)值,选择48 h 20%抑制浓度(IC20)值0.9 g/L作为加药浓度。将处于对数生长期的A549细胞分为对照组,单纯照射组,药物联合照射组,照射剂量分为1,2,4和8 Gy。在24 h和48 h分别测定细胞增殖率,测定方法同上。
1.4 实时荧光定量PCR法检测细胞DNA-PKcs及Ku80 mRNA的表达
将处于对数生长期的A549细胞分为对照组,单纯照射组,单纯药物组,药物联合照射组,照射剂量分为1,2,4和8 Gy,单纯药物组与药物联合照射组中苦参素质量浓度选定为0.9 g/L。根据实验分组,接种细胞,在药物及射线干预后的24,48 h收集细胞,使用Trizol试剂提取RNA,测定RNA浓度,然后进行反转录,最后进行PCR扩增。扩增条件:95℃5 min预变性,95℃变性30 s,58℃退火30 s,72℃延伸30 s,共40个循环。引物序列由上海捷瑞生物工程有限公司合成。GAPDH:上游引物5′-CGCTGAGTACGTCGTGGAGTC-3′,下游引物5′-GCTGATGATCTTGAGGCTGTTGTC-3′,产物长度172 bp;DNA-PKcs:上游引物5′-ATCTGTCATCTGCTGTGTCTTCAAT-3′,下游引物5′-CTGCTTCTCTGGCTTCTTTCCTAA-3′,产物长度197 bp。Ku80:上游引物5′-GCTAATCCTCAAGTCGGCGT-3′,下游引物5′-ATGGAGTCAATCAAAGCATCAACA-3′,产物长度182 bp。以GAPDH作为内参照,定量分析DNAPKcs及Ku80 mRNA的相对表达水平。目的基因相对表达水平的计算公式:2-ΔΔCt=2-(ΔCt目的基因-ΔCt标准值)。
1.5 统计学分析
2 结果
2.1 苦参素对A549细胞增殖率的影响
不同质量浓度的苦参素处理A549细胞后,细胞增殖率随苦参素作用时间的延长及浓度的增大而下降,呈时间(P<0.05)和剂量依赖性(P<0.05)。4种质量浓度的苦参素作用后细胞的增殖率见图1。24 h的IC50值为3.2 g/L,48 h的IC50值为2.4 g/L,48 h的IC20值为0.9 g/L。
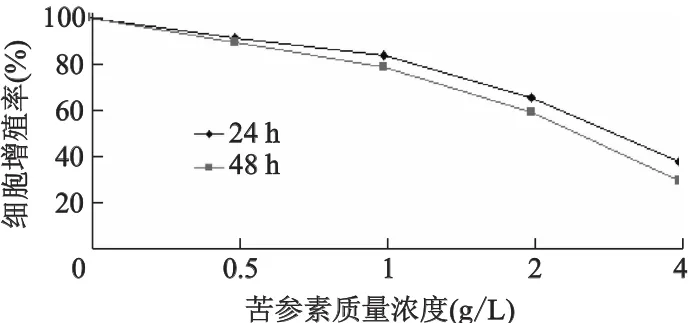
图1 不同质量浓度苦参素作用后A549细胞的增殖率
2.2 单纯照射和药物联合照射处理对A549细胞增殖率的影响
如图2所示,当药物联合照射组中苦参素质量浓度设定为0.9 g/L时,随着照射时间的延长和照射剂量的增加,单纯照射组和药物联合照射组的A549细胞增殖率明显下降(P<0.05);在同一时间点,与对应的照射组比较,药物联合照射组的细胞增殖率明显下降(P<0.05)。以上结果表明,苦参素可明显增加A549细胞对放射线的敏感性。

图2 不同放射线剂量对两组A549细胞增殖率的影响
2.3 单纯照射和药物联合照射作用后A549细胞DNA-PKcs和Ku80 mRNA的相对表达水平
与对照组(对照组中DNA-PKcs和Ku80 mRNA的表达量设定为1)比较,单纯照射组DNA-PKcs和Ku80 mRNA的相对表达水平随着时间的延长和照射剂量的增加明显增高(P<0.01),见表1、表2。单纯药物组的DNA-PKcs和Ku80 mRNA相对表达水平比对照组明显下降(P<0.01);在同一时间及同一放射线剂量,药物联合照射组的DNA-PKcs和Ku80 mRNA相对表达水平较单纯照射组显著降低(P<0.01),见表3、表4。结果提示,放射线可以诱导A549细胞DNA-PKcs和Ku80基因表达的增加,而苦参素可下调A549细胞的DNA-PKcs和Ku80 mRNA表达水平。

表1 4种剂量X射线处理后A549细胞DNA-PKcsm RNA的相对表达水平

表2 4种剂量X射线处理后A549细胞Ku80 m RNA的相对表达水平

表3 5种剂量X-射线联合苦参素(0.9 g/L)处理后A549细胞DNA-PKcsmRNA的相对表达水平

表4 5种剂量X射线联合苦参素(0.9 g/L)处理后A549细胞Ku80 m RNA的相对表达水平
3 讨论
苦参素(氧化苦参碱)来源于豆科植物苦参的干燥根,是中药苦参的主要生物碱。近年来研究发现,苦参素有多方面的药理活性,其中抗肿瘤作用受到了广泛关注。它能够抑制肿瘤细胞增殖,诱导肿瘤细胞分化和凋亡,抑制肿瘤新生血管形成和肿瘤侵袭[3-8]。也有少量报道表明其有放疗增敏作用[2],但机制不甚清楚。本实验结果显示,苦参素能够抑制A549细胞的增殖,这一作用呈时间和剂量依赖性。而且与单纯照射组比较,苦参素联合照射组的A549细胞增殖率明显降低,表明苦参素可增加肺腺癌细胞对放射线的敏感性。
DNA是放射线作用的主要靶点,放射线的直接作用和电离效应产生的自由基共同导致DNA单、双链断裂损伤,其中以双链断裂为放射线杀伤肿瘤细胞最重要的机制。当DNA双链受到损伤时,细胞将通过不同的途经启动应答进行DNA修复以克服损伤。在哺乳动物细胞中,双链断裂修复有两条途径:同源性重组(homologous recombination,HR)和NHEJ,其中NHEJ途径是主要修复途径[9]。DNAPKcs基因位于染色体8q11,编码相对分子质量为469 000的蛋白质,其C-末端结构域和参与信号传导的磷脂酰肌醇3-激酶(PI3-K)有同源性[10]。人Ku80基因位于染色体2q33-34,编码相对分子质量约为86 000的蛋白,参与DNA-PK与其他蛋白的相互作用,它与Ku70紧密结合,形成Ku蛋白[11]。当DNA双链损伤时,2个Ku分子特异性地连接到DNA双链损伤处,分别识别并结合于每一条DNA链末端,然后以ATP依赖的方式沿DNA链分别向两端滑动一小段距离,同时Ku本身具有的弱解旋酶活性使两个断端局部解链,从而形成Ku-DNA复合物吸引DNA-PKcs到损伤部位,位于两个断裂末端的DNA-PK蛋白复合体通过各自的氨基端相互作用搭桥,拉近DNA损伤末端,并激活DNA-PKcs的丝/苏氨酸激酶活性,磷酸化参与NHEJ的一系列蛋白质,对DNA损伤位点进行恰当的剪切和连接,当修复完成后DNA-PK发生自身磷酸化,使2个亚单位从DNA链上解离[12-13]。作为DNA-PK复合物的主要功能单位,DNA-PKcs与Ku80是研究肿瘤细胞放疗敏感性的重要靶点。
大量研究显示,DNA-PKcs和Ku80基因或者蛋白高表达的肿瘤细胞对放射线耐受,而低表达则对放射线高度敏感[14-15]。有研究显示,通过抑制肿瘤细胞DNA-PKcs的表达或抑制其磷酸化,或者抑制Ku80的表达,均可提高肿瘤细胞对放射线的敏感性[16-21],说明DNA-PKcs和Ku80的表达水平是影响细胞对放射线敏感性的重要因素。本实验结果显示,单纯用放射线照射后随着照射时间的延长,照射剂量的增强,肺腺癌细胞DNA-PKcs和Ku80 mRNA的相对表达水平相应增加。这一结果表明,放射线在杀伤肺癌细胞的同时也诱导了DNA-PKcs和Ku80基因的表达增加,NHEJ通路的DNA损伤修复功能被激活,以抵抗放射线对肺癌细胞DNA的损伤作用,同样证明了DNA-PKcs和Ku80在肺腺癌细胞对放疗的耐受中起着重要作用,其表达水平可以作为预测肿瘤对放疗敏感性的标志。我们的实验结果还显示,单纯药物组中DNA-PKcs和Ku80 mRNA的表达水平下调,药物联合照射组与对应的单纯照射组相比较,其相对表达水平明显下调,这也表明了苦参素可下调肺腺癌细胞DNA-PKcs和Ku80的表达水平,通过抑制DNA的修复功能,增加细胞对放射线的敏感性,这也可能是其放疗增敏机制之一。
综上所述,苦参素具有放射线增敏作用,其增敏机制之一可能是通过下调DNA-PKcs和Ku80的表达,抑制细胞DNA损伤的修复功能。苦参素放射线增敏作用的确切机制仍需进一步深入研究。
[1] Mi J,Dziegielewski J,Bolesta E,et al.Activation of DNA-PK by ionizing radiation is mediated by protein phosphatase 6[J].PLoSOne,2009,4(2):e4395.
[2] 田瑞华,陈祥明,杨雪.苦参素葡萄糖注射液联合放疗治疗食管癌的临床研究[J].实用临床医药杂志,2010,14(23):67-68.
[3] Wu XS,Yang T,Gu J,et al.Effects of oxymatrine on the apoptosis and proliferation of gallbladder cancer cells[J].Anticancer Drugs,2014,25(9):1007-1015.
[4] Ho JW,Ngan Hon PL,Chim WO.Effects ofoxymatrine from Ku Shen on cancer cells[J].Anticancer Agents Med Chem,2009,9(8):823-826.
[5] Guo B,Zhang T,Su J,et al.Oxymatrine targets EGFR(p-Tyr845)and inhibits EGFR-related signaling pathways to suppress the proliferation and invasion of gastric cancer cells[J].Cancer Chemother Pharmacol,2015,75(2):353-363.
[6] Chen H,Zhang J,Luo J,et al.Antiangiogenic effects of oxymatrine on pancreatic cancer by inhibition of the NF-κB-mediated VEGF signaling pathway[J].Oncol Rep,2013,30(2):589-595.
[7] 彭向前,张文会,李军.氧化苦参碱逆转多药耐药细胞系K562/A02耐药性的研究[J].中国肿瘤临床,2008,35(19):1127-1130.
[8] 王锐,姜小军,郑婕,等.氧化苦参碱增强环磷酰胺对小鼠Lewis肺癌生长的抑制作用[J].第二军医大学学报,2008,29(4):399-403.
[9] Lieber MR,Ma Y,Pannicke U,et al.Mechanism and regulation of human non-homologous DNA end-joining[J].Nat Rev Mol Cell Biol,2003,4(9):712-720.
[10] Rivera-Calzada A,Maman JD,Spagnolo L,et al.Threedimensional structure of the human DNA-PKcs/Ku70/ Ku80 complex assembled on DNA and its implications for DNA DSB repair[J].Structure,2005,13(2):243-255.
[11] Singleton BK,Torres-Arzayus MI,Rottinghaus ST,et al.The C terminus of Ku80 activates the DNA-dependent protein kinase catalytic subunit[J].Mol Cell Biol,1999,19(5):3267-3277.
[12] Collis SJ,DeWeese TL,Jeggo PA,et al.The life and death of DNA-PK[J].Oncogene,2005,24(6):949-961.
[13] Spagnolo L,Rivera-Calzada A,Pearl LH,et al.Three-dimensional structure of the human DNA-PKcs/Ku70/ Ku80 complex assembled on DNA and its implications for DNA DSB repair[J].Mol Cell,2006,22(4):511-519.
[14] 张宇卉,折虹,王艳阳,等.宫颈癌组织LIG4、XRCC4、XRCC5、XRCC6、XRCC7的mRNA表达及与放疗敏感性的关系[J].宁夏医科大学学报,2013,35(4):398-401.
[15] Harima Y,Sawada S,Miyazaki Y,et al.Expression of Ku80 in cervical cancer correlates with response to radiotherapy and survival[J].Am JClin Oncol,2003,26(4):e80-e85.
[16] 庄亮,于世英,黄晓园,等.DNA-PKcs、Ku80及ATM备选宫颈癌放疗增敏靶点的体外研究[J].癌症,2007,26(7):724-729.
[17] 牛道立,蒋昌斌,甄俊杰,等.DNA-PKCS反义寡核苷酸转染肺腺癌细胞系A549提高放射敏感性的实验研究[J].中华放射肿瘤学杂志,2009,18(1):73-75.
[18] Sun X,Yang C,Liu H,etal.Identification and characterization of a small inhibitory peptide that can target DNAPKcs autophosphorylation and increase tumor radiosensitivity[J].Int JRadiat Oncol Biol Phys,2012,84(5):1212-1219.
[19] Zhou X,Zhang X,Xie Y,et al.DNA-PKcs inhibition sensitizes cancer cells to carbon-ion irradiation via telomere capping disruption[J].PLoSOne,2013,8(8):e72641.
[20] Zhang T,Zhang L,Zhang T,et al.Metformin sensitizes prostate cancer cells to radiation through EGFR/p-DNAPKCS in vitro and in vivo[J].Radiat Res,2014,181(6):641-649.
[21] 任振义,金儿,叶健,等.用Ku80 siRNA抑制Ku80基因表达以提高肺癌细胞放射敏感性的实验研究[J].中国呼吸与危重监护杂志,2010,9(3):291-294.
Effect of oxymatrine on radiosensitivity of A549 cells and its possiblemolecular mechanism
SHIWei-lin1,LI Jian2,LU Jian-bao1,CHEN Ping2,ZHOU Yu-tao1
(1.Department of Respiratory Medicine,the People′s Hospital of Liyang City,Liyang Jiangsu 213300;2.Department of Respiratory Medicine,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To investigate the mechanism of oxymatrine in enhancing the sensitivity of lung cancer cells to radiation.M ethods:The A549 cellswere divided into control group,radiation group,drug group,drug plus radiation group according to treatment condition.The cell counting kit-8 assay was used to determine proliferation rate.The real-time quantitative PCR assays were conducted tomeasure DNA-PKcs and Ku80 mRNA expression levels at 24 h and 48 h following treatment with oxymatrine,or radiation,or oxymatrine plus radiation.Results:Oxymatrine significantly inhibited the proliferation of A549 cells in a dose and time dependentmanner(both P<0.05).IC50of A549 cells for oxymatrine at24 h and 48 h were 3.2 g/L and 2.4 g/L,respectively.The proliferation rates of A549 cells in the radiation group were decreased in a time and dose dependentmanner(both P<0.05).At the same time points,the cell proliferation rates in the drug plus radiation group were dropped markedly when compared with the radiation group(P<0.05).Additionally,the relative expression levels of DNA-PKcs and Ku80 mRNA were increased in a dose and time dependentmanner in the radiation group(both P<0.01).The relative expression levels of DNA-PKcs and Ku80mRNA in the drug plus radiation group were reduced significantly as compared with inthe radiation group(P<0.01).Conclusion:Oxymatrine enhanced the sensitivity of A549 cell to radiation,at least partially,by inhibiting DNA-PKcs and Ku80 mRNA expression and damage of DNA damage repairmechanisms.
lung cancer;oxymatrine;radiosensitivity;DNA dependent protein kinase
R734.1 [文献标志码] A [文章编号] 1671-7783(2015)03-0207-05
10.13312/j.issn.1671-7783.y150083
溧阳市科技计划项目(溧科发[2013]5);江苏大学医学临床科技发展基金资助项目(JLY20120116)
史卫林(1982—),男,江苏溧阳人,主治医师,主要从事肺癌分子诊断研究。
2015-04-04 [编辑]陈海林
