白藜芦醇对酒精性肝损伤大鼠保护作用的研究
2015-08-05窦博鑫关天琪石彦国KALENIKTatyana
刘 颖,张 璐,窦博鑫,关天琪,王 秋,石彦国,KALENIK Tatyana K
(1.哈尔滨商业大学食品工程学院,哈尔滨150076;2.俄罗斯远东联邦大学生物医学学院,海参崴690091)
乙醇的大量摄入会使肝脏受到不同程度的损伤,随着人民生活水平的提高,酒精性肝病已经成为继病毒性肝炎后的另外一种多发的肝损伤疾病[1].但目前对于酒精性肝损伤的治疗并不是十分理想,尚没有一种高效的方法可以减轻饮酒带来的肝损伤.白藜芦醇是一种广泛存在于自然界多种植物中的多酚类化合物,化学名为 3,5,4'-三羟基 -1,2 - 二苯乙烯(3,5,4'-trihydroxystilbene),分子式C14H12O3,具有抗氧化、降低血脂、抗血小板聚集、诱导肿瘤细胞凋亡、提高免疫功能等生理活性,已成为人们研究的热点[2-4].近年来研究表明,白藜芦醇可能有治疗酒精性肝损伤的作用[5-6].本实验研究以酒精性肝损伤大鼠为模型,观察白藜芦醇对酒精性肝损伤的保护作用,为酒精性肝损伤发病机制的研究提供实验与理论依据.
1 实验材料
1.1.1 药物与试剂
白藜芦醇购自陕西慈缘生物技术有限公司,纯度为98%;玉泉白酒购自黑龙江省玉泉酒业有限责任公司,40%酒精度;护肝片购自人民同泰药店,哈药集团世一堂制药厂产品;实验所用试剂盒购自南京建成生物工程研究所.
1.1.2 实验动物
Wistar雄性大鼠72只,购自长春市亿斯实验动物技术有限责任公司,体重180~220 g,无特定病原体(SPF级),许可证号:SCXK(吉)-2011-0004.大鼠饲料购自长春亿斯实验动物技术有限责任公司.适应性饲养1周后,给与正常饮食.
1.1.3 实验仪器
SY-2-4电热恒温水浴锅 天津欧诺仪器代表有限公司;DHG-9203A型电热恒温鼓风干燥箱上海恒科学仪器有限公司;BS224S电子天平赛多利斯科学仪器有限公司;TDL-5-A离心机 上海安亭科学仪器厂;恒温箱上海一恒科技有限公司;Mindray MR-96A酶标仪 迈瑞公司;粉碎机 天津市泰斯特仪器有限公司;eppendorf移液枪;722E分光光度计等.
2 实验方法
2.1 饲养环境
温度20~25℃左右,自然光照,让动物自由饮食和饮水.适应性饲养一周后,将72只大鼠随机分为6组,每组12只.空白对照组按照1 mL/100 g灌胃0.9%生理盐水,8g/kg/d.白藜芦醇低、中、高剂量组分别给予25、50、100 mg/kg剂量的白藜芦醇+40%酒精8 g/kg/d溶液.模型对照组给予40%酒精8 g/kg/d.阳性对照组40%酒精8 g/kg/d+治疗酒精性肝损伤的药物(护肝片4 g/kg).喂养期间,进食进水不限,共30 d,每周称2次体重,根据体重调整灌胃剂量.
2.2 血清指标测定
连续灌胃30 d,各组大鼠于30 d末次灌胃给药后,禁食不禁水12 h,对各组动物称重,眼球取血,3 500 r/min离心10 min分离血清,并予以编号,保存备用.
2.3 脏器指数的测定
采血后,断头处死动物,立即取出大鼠肝脏、肾脏、脾脏,4℃生理盐水洗净,滤纸吸干表面水分后称其湿重,计算:肝指数(%)=肝脏湿重(g)/大鼠体重(g)×100%;肾指数(%)=肾脏湿重(g)/大鼠体重(g)×100%;脾指数(%)=脾脏湿重(g)/大鼠体重(g)×100%
2.4 观察内容
在动物的饲养过程中,观察大鼠的精神状态、肢体活动情况、体毛的光泽度、食欲、大便情况等.
2.5 统计学处理
数据用SPSS17.0统计软件进行方差齐性检验、单因素方差分析(one-way ANOVA),方差齐性时各组之间多重比较采用LSD检验,实验结果以均数±标准差(±S)表示,P <0.05表明有显著性差异,具有统计学意义.
3 实验结果
3.1 大鼠活动情况
实验期间模型组大鼠毛发光泽度较差(特别是灌胃刚结束后,毛发光泽度异常差,大鼠身体发软),体重增长较慢,多数大鼠食欲差、不活跃、嗜睡、行动迟缓、大便溏泻等现象.白藜芦醇高中低剂量组和药物组则有明显的改善.空白对照组大鼠则精神状态很好,毛发有光泽,无嗜睡现象,食欲佳,大便正常.实验过程中,白藜芦醇高剂量组和低剂量组共死亡2只大鼠,原因是由于灌胃时操作不当,灌胃时将药物误灌入气管.
3.2 肝脏组织大体观察
模型组大鼠肝脏质地较硬,表面粗糙,较脆易碎,色泽度较暗淡.有5只大鼠肝脏被膜与相邻近组织有轻度的粘连.空白对照组大鼠肝脏表面光滑,颜色呈红褐色,质地中等.
3.3 白藜芦醇对酒精性肝损伤大鼠肝脏、肾脏、脾脏指数的影响
见表1.实验结束后称取大鼠体重,各组间体重比较,差异无统计学意义(P>0.05).由表1可以看出模型组的大鼠肝指数明显升高,与正常组比较有显著性差异(P<0.05);与模型组比较,白藜芦醇高、中剂量组能降低大鼠肝指数(P<0.05).而白藜芦醇对大鼠肾脏指数和脾脏指数的影响无统计学意义(P >0.05).
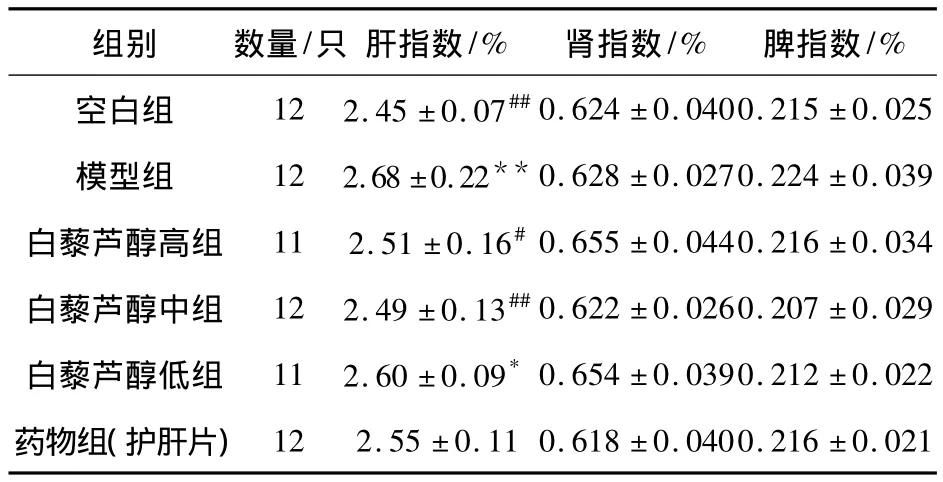
表1 各组大鼠肝指数、肾指数、脾指数的比较
3.4 白藜芦醇对酒精性肝损伤大鼠血清中ALT、AST水平的影响
由表2可以看出,模型组大鼠 ALT、AST、TG水平明显升高,与空白对照组比较有显著性差异(P<0.01),提示造模成功.白藜芦醇三个剂量组均能显著降低ALT、AST、TG的水平,与模型组比较具有显著性差异(P<0.01),呈计量相关性.
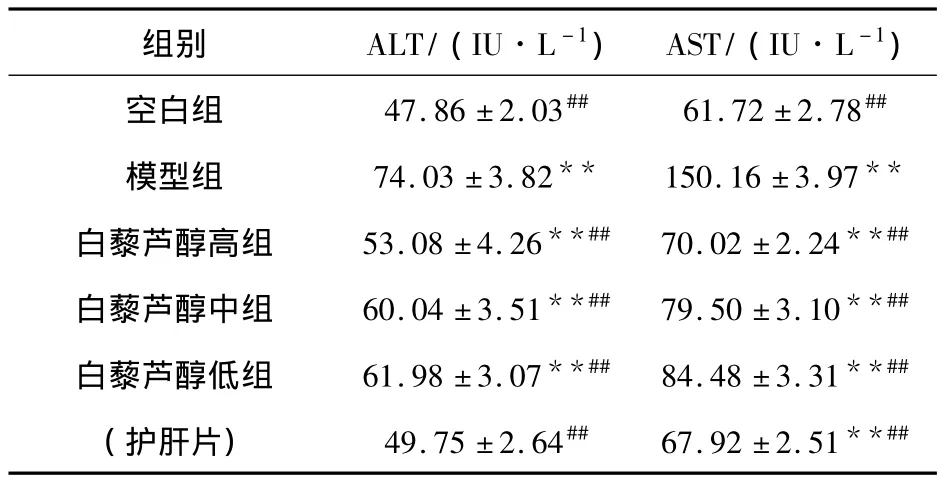
表2 白藜芦醇对酒精性肝损伤大鼠血清ALT、AST的影响
3.5 白藜芦醇对酒精性肝损伤大鼠血清中SOD、MDA水平的影响
由表3可以看出,模型组的大鼠SOD水平明显降低,MDA含量明显升高,与正常组比较有显著性差异(P<0.01).与模型组比较,白藜芦醇三个剂量组均能降低MDA含量(P<0.01),呈计量相关性;而与模型组比较,白藜芦醇高、中剂量组能明显升高SOD水平(P<0.01),差异具有显著性.
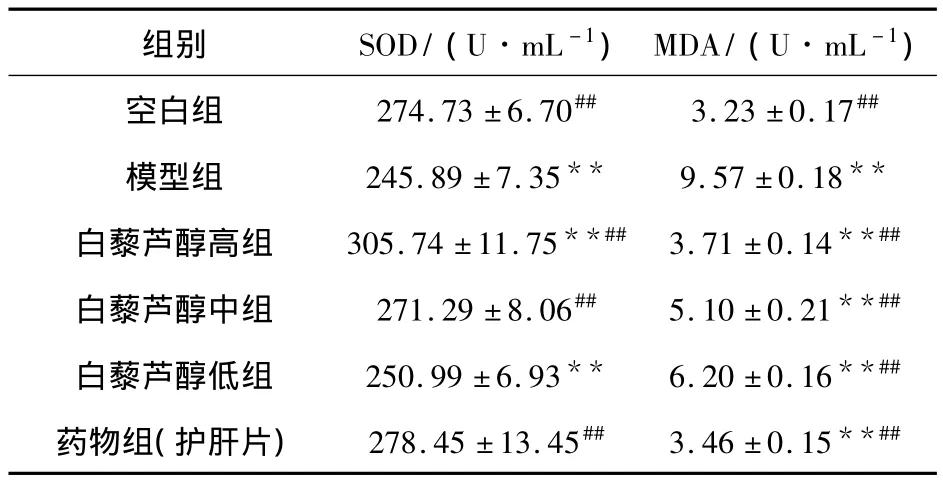
表3 白藜芦醇对酒精性肝损伤大鼠血清SOD、MDA的影响
本实验结果显示模型组的大鼠肝指数明显升高,与正常组比较有显著性差异(P<0.05).白藜芦醇各剂量组均能显著降低血清ALT、AST、TG活性,说明白藜芦醇对大鼠急性酒精性肝损伤有保护作用.同时,白藜芦醇各剂量组也能显著提高大鼠肝组织中抗氧化酶SOD的活性,降低脂质过氧化产物MDA的含量,说明白藜芦醇的保护作用可能与增强机体清除自由基,防止脂质过氧化有关.
4 讨论
酒精性肝病(alcoholic liver disease,ALD)是因长期、大量饮用各种含乙醇的饮料所致的肝脏损害性病变.近年来,我国ALD的发病率呈逐年上升趋势,成为仅次于病毒性肝炎的第二大肝病[7].因此,开发并筛选对ALD有确切防治作用的药物并应用于临床,是当前面临的重要课题.
乙醇在其代谢过程中可通过多种途径产生大量自由基,能与细胞大分子反应,导致脂质过氧化,损伤肝细胞,引起细胞结构和功能的破坏,大量肝内酶(ALT、AST)释放入血,并加速清除自由基酶(SOD)的耗竭,肝功能异常,脂质代谢紊乱[8-10].酒精吸收入血后主要在肝脏代谢,酒精引起肝脏损害的机制涉及乙醇的直接毒性、乙醛的化学性损伤、氧化应激和脂质过氧化等多个方面,导致肝细胞损伤及肝功能异常[11],其中氧应激和脂质过氧化可能是酒精引起肝损伤的重要因素之一.在氧化和抗氧化体系中,MDA是脂质过氧化物的最终代谢产物,其含量的高低可反映机体的脂质过氧化程度,从而反映细胞损伤的程度[12].而SOD是细胞内抗脂质过氧化作用的酶性保护系统的主要成分[13],对机体的氧化与抗氧化平衡起着至关重要的作用是反映机体抗氧化能力的重要指标.
本实验结果显示白藜芦醇各剂量组均能显著降低血清ALT、AST的活性,说明白藜芦醇对大鼠急性酒精性肝损伤有保护作用.同时,白藜芦醇各剂量组也能显著提高大鼠肝组织中抗氧化酶SOD的活性,降低脂质过氧化产物MDA的含量,说明白藜芦醇的保护作用可能与增强机体清除自由基,防止脂质过氧化有关.
综上所述,白藜芦醇可以降低血清ALT、AST活性和MDA的含量,提高SOD的含量,对酒精性肝损伤有明显的保护作用.白藜芦醇减轻酒精对肝脏的脂质过氧化损伤,降低血清转氨酶活性,有效减轻了酒精对肝组织的损伤,其作用机制可能与其减轻肝脏炎症、清除自由基及抗脂质过氧化作用等有关.实验为白藜芦醇在解酒保健领域的开发利用方面提供了依据.
[1]庄 辉.酒精性肝病的流行病学[J].中华肝脏病杂志,2003,11(11):698.
[2]JOSEPH A B,AVID A S.Therapeutic potential of resveratrol:in vivo evience[J].Drug Discovery,2006,5(6):93.
[3]CHENG L Y,LIU S X.The application prospect and research status of resveratrol[J].Food Res Dev,2005,26(1):25 -27.
[4]DAS M,DAS D K.Resveratrol and cardiovascular health[J].Molecular Aspects of Medicine,2010,31(6):503-512.
[5]余慧琳.白藜芦醇的生理功能及其应用前景[J].生物学通报,2005,40(11):12-13.
[6]钟 芳,罗少军,少 明.白藜芦醇抑制细胞增值研究新进展[J].中草药,2003,34(5):2-4.
[7]鞠 辉,魏良洲.酒精性肝病的流行病学现状[J].肝脏,2006,2(11):57.
[8]CHOI J S,YOON T J,KANG K R,et al.Glycoprotein isolated from Acanthopanax senticosus proteits against hepalotoxicity induced by acute and chronic alcohol treatment[J].BiolPharm Bull,2006,29(2):306 -314.
[9]江正辉,王泰龄.酒精性肝病[M].北京:中国医药科技出版社,2001:26-29.
[10]孙 艳,孟祥伟,迟宝荣,等.酒精性肝病发病机制的研究进展[J].吉林医学,2006,27(3):230-231.
[11]韩 婷,井 源,吴 静,等.酒精性脂肪肝的肝损伤机制研究近况[J].实用肝脏病杂志,2007,10(4):279 -282.
[12]MASALKAR P D,ABHANG S A.Oxidative stress and antioxidant status in patients with alcoholic liver disease[J].Clin Chim Acta,2005,55(1/2):61-65.
[13]YU B P.Cellular defenses against damage from reactive oxygen species[J].Physiol Rev,1994,74(1):139-162.
