两种帕金森体外模型的构建及相关研究
2015-08-05王可心李煦照徐红英刘树民
王可心,李煦照,徐红英,张 宁,刘树民
(1.黑龙江中医药大学中医药研究院中药毒理学实验室,哈尔滨150040;2.黑龙江中医药大学中医药研究院细胞生物学研究室,哈尔滨150040;3.黑龙江中医药大学药物安全性评价中心,哈尔滨150040)
帕金森病是一种中老年人常见的运动障碍疾病,临床上表现为静止性震颤,运动迟缓,肌强直和姿势步态异常等.PD的主要病理学特征是中脑黑质致密部的多巴胺能神经元的选择性变性、死亡,以及在残存的神经元胞浆中出现嗜酸性的淀粉样蛋白包涵体—Lewy小体,Lewy是PD的诊断特征.虽然目前对于a-Synuclein与帕金森的关系尚未完全清楚,但SNCA(Synuclein,alpha)基因编码的a-Synuclein在病理状态下聚集与Lewy的形成和多巴胺能神经元的死亡乃至PD的发生有密切的关系[1].
a-Synuclein是一种含有140个氨基酸的神经突触前末端蛋白[2],有研究发现PD中发现a-Synuclein基因有两个罕见的错义突变(A30P和A53T)后[3-4],a-Synuclein 引起了广泛的关注,过表达野生型或突变型a-Synuclein的转基因动物均可产生类似PD的症状[5],但是a-Synuclein的异常聚集及lewy小体的形成机制尚不明确.
由于PD的病理特征是中脑多巴胺能神经元的损失,而SH-SY5Y细胞系恰恰具有许多多巴胺能神经元的特点,如:SH-SY5Y细胞具有合成多巴胺和去甲肾上腺素的能力;SH-SY5Y细胞能表达多巴胺转运蛋白(DAT)等,同时SH-SY5Y细胞容易获取,培养简便,所以近些年被用来多巴胺神经元细胞模型,但是该细胞作为宿主细胞能否表达a-Synuclein还需要进一步研究.因此针对该问题本实验拟构建人野生型和A53T突变型a-Synuclein载体质粒,并以慢病毒介导的方式转染SH-SY5Y细胞,并对融合在该细胞里面的目的基因及其所表达的蛋白进行鉴定,为今后a-Synuclein基因体外模型建立及帕金森等神经退行性疾病的研究奠定了基础.
1 实验材料
Xmn I、Xho I、DrdI、SpeI、NdeI、Nsp V 等限制性内切酶、慢病毒包装试剂盒均购自广州复能基因公司;pEGFP-SNCA-WT和pEGFP-SNCA-A53T质粒广州复能基因公司合成;Polybrene购自Sigma公司;293T细胞为黑龙江八一农垦大学提供;SHSY5Y细胞购自中国科学院典型培养物保存委员会细胞库;TOP10感受态细胞由本实验室保存;PBS、血清(FBS)、胰酶、DMEM、DMEM/F12、Opti-MEMI、Puromycin均购自Thermo公司;兔抗人Anti-Alpha-Synuclei购自北京博奥森生物技术有限公司、羊抗兔二抗北京中杉金桥有限公司.
2 实验方法
2.1 pEGFP-SNCA -WT、pEGFP-SNCA -A53T突变型基因表达载体的构建及鉴定
2.1.1 pEGFP-SNCA-WT基因表达载体的构建
根据GenBank中基因序列设计引物;WT上游引物:5'-ATCCACGCTGTTTTGACC -3',含 Xmn I内切酶位点,下游引物:5'-CCGGACACGCTGAACTTGT-3'含Xho I内切酶位点;以WT型a-Synuclein基因为模板94℃预变性5 min,94℃变性1 min,60 ℃退火 1 min,72 ℃延伸 1 min,30 个循环,72℃延伸10 min.PCR产物分别转化TOP10感受态细胞扩增培养.以Xmn I、Xho I酶切PCR产物获得423bp的DNA片段,将得到的DNA片段通过T4-DNA连接酶插入到pEZ-Lv122载体质粒中,获得pEGFP-SNCA-WT基因表达载体,并将其转化Top10感受态细胞中培养.
以SNCA-WT为模板,在A53T所需的突变点位进行定点突变,将获得的DNA片段连入pReceiver-Lv122载体质粒中,将获得的 SpEGFPSNCA-A53质粒同样转化到感受态细胞中.
2.1.2 酶切鉴定
将pEGFP-SNCA-WT基因表达质粒分别用DrdI、SpeI内切酶酶切;pEGFP-SNCA -A53T基因表达质粒分别用Xmn I、NdeI酶切,对所得到酶切产物进行鉴定.
2.2 慢病毒包装、浓缩和储存
2.2.1 293T 细胞的培养
293T细胞接种于培养瓶中培养(培养基为:10%的FBS+1%的青链霉素双抗+DMEM,培养条件:37℃,体积分数为5%的CO2),待细胞贴壁后,每2天换液,细胞80%融合后传代继续培养.
2.2.2 慢病毒的包装、浓缩
将1.3~1.5 ×106个293T 细胞平铺于 10 cm培养皿中,待融合度达到70% ~80%后,按照说明书提供的慢病毒包装方法,在293T中生产慢病毒,并收集病毒上清液,将收集的慢病上清液用0.45 μm的PVDF膜过滤除去细胞碎片,过滤后的上清在4℃,5 000 g条件下离心120 min,将沉淀用1 mLPBS重悬,混匀后置于-80℃保存备用.
2.3 WT和A53T型a-Synuclein稳定表达的SH-SY5Y细胞系的建立
2.3.1 转染SH-SY5Y细胞
在感染病毒的24 h前,将细胞铺于24孔板,每孔加入2~10×104个细胞.之后每孔填充0.5 mL含有5%热灭活的胎牛血清和青链霉素双抗的DMEM/F12.37℃,5%CO2孵育过夜.对于每个孔,用0.5 mL含有慢病毒颗粒的完全培养基替换旧的培养基,并加入 Polybrene,使其终质量浓度为8 μg/mL,先将培养板在4~8℃下放置2 h,然后再在37℃,5%CO2下继续孵育,直至总转染时间达到72 h.
2.3.2 稳定转染细胞的药物筛选
移除慢病毒介导后的SH-SY5Y细胞中的培养液,用PBS充分漂洗,以10%FBS+DMEM/F12+Puromycin(终质量浓度为1 μg/mL)作为选择性培养液对转染完成后的细胞进行阳性筛选,筛选4周后在倒置荧光显微镜下观察荧光表达情况.并提取目的DNA进行测序.
2.4 western blot法检测SH-SY5Y-WT和SHSY5Y-A53T细胞系中a-Synuclein表达情况
SH-SY5Y-WT和SH-SY5Y-A53T细胞培养至80%融合后消化收集细胞,经PBS洗涤后加蛋白裂解液超声裂解,将裂解物以13 000 r/min 4℃离心30 min,收集上清,取适量样品用BCA蛋白定量试剂盒定量,等量蛋白样品经10%SDSPAGE分离后转至PVDF膜上,常规方法经一抗及二抗孵育后用ECL发光液显影.
3 实验结果
3.1 基因表达载体酶切结果鉴定
凝胶电泳显示 pEGFP-SNCA-WT质粒经DrdI酶切后得到和预期大小相同的两个条带(1 882 bp和6 552 bp),而经过SpeI酶切后所得的两个条带6 371 bp和2 063 bp也与预期的大小一致,见图1 A.证明pEGFP-SNCA-WT质粒构建成功.pEGFP-SNCA-A53T质粒经Xmn I酶切后所得到的2 596、1 877、3 959 bp 三个条带,和 NdeI酶切后得到的6 371、2 044 bp条带都与预期的一致,见图1 B.证明pEGFP-SNCA-A53T质粒构建成功.

图1 基因表达载体酶切结果鉴定
3.2 倒置荧光显微镜下观察荧光表达
转染后的细胞经Puromycin筛选4周后获得稳定的细胞系,在倒置荧光显微镜下观察其表达情况,发现筛选后,任何视野下荧光表达率均在90%,见图2的A1和B1.并且400倍显微观察发现很多阳性细胞突起出现荧光表达,见图2的A2,B2.证明慢病毒转染成功,SH-SY5Y细胞能够表达目的基因.
3.3 目的DNA测序
提取SH-SY5Y-WT和SH-SY5Y-A53T细胞基因组,然后用PCR方法扩增目的基因片段,纯化后进行测序,结果显示:SH-SY5Y-WT目的片段序列与 GeneBank中的序列一致,而 SHSY5Y-A53T目的片段序列中的第157位的鸟嘌呤(G)被腺嘌呤(A)取代,见图3,氨基酸密码子从GCA变为ACA,编码氨基酸从丙氨酸(Ala)变为苏氨酸(Thr),与文献报道相符[3].说明我们所要的目的基因已经成功的整合到SH-SY5Y细胞基因组中.

图2 SH-SY5Y-WT和SH-SY5Y-A53T细胞中pEGFP的表达
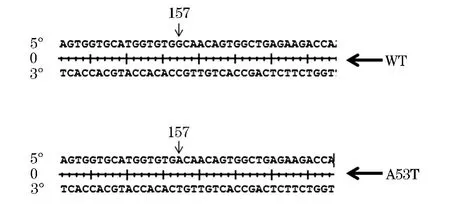
图3 目的DNA的测序结果
3.4 Western blot法检测a-Synuclein蛋白表达
Western blot结果显示SH-SY5Y、SH-SY5Y-WT、SH-SY5Y-A53T三种细胞在分子质量大约18 ku处均出现a-Synuclein蛋白条带,但是SH-SY5Y-WT和SH-SY5Y-A53T细胞在18 kd处的蛋白表达明显高于SH-SY5Y细胞,见图4.这可能是因为a-Synuclein在SH-SY5Y细胞中表达量过低,而三种细胞在40 ku处均出现GAPDH的明显表达,说明转染后的SH-SY5Y细胞能够过表达a-Synuclein蛋白.
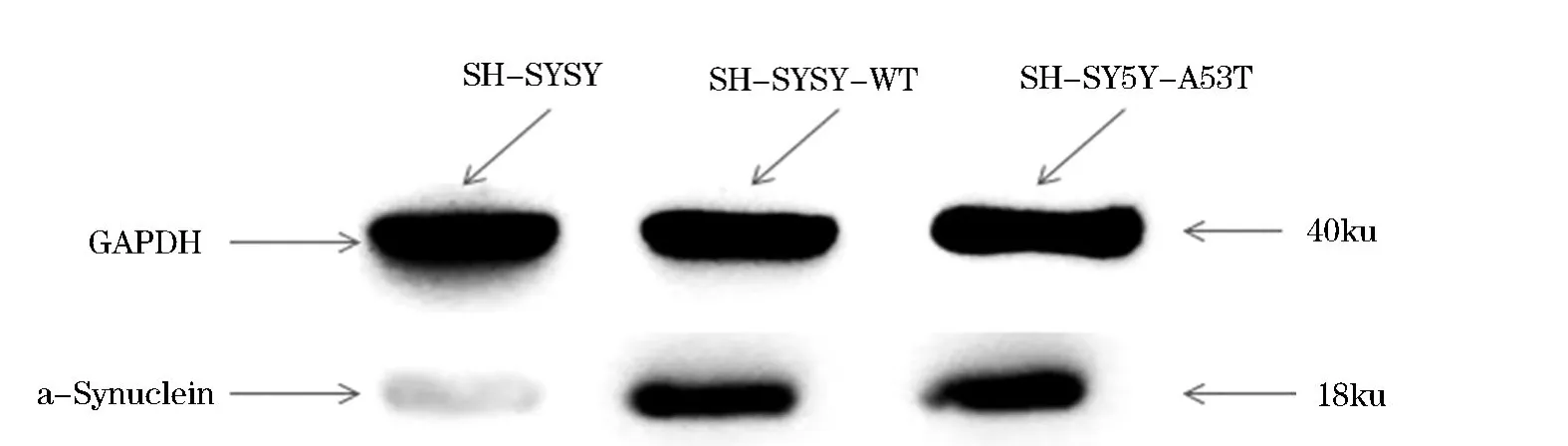
图4 Synuclein在SH-SY5Y、SH-SY5Y-WT及SH-SY5Y-A53T细胞中的表达
4 讨论
PD是威胁人类健康的重要性疾病,对它的机制的研究迫在眉睫,PD模型的建立为研究提供了很好的平台.目前PD模型以动物模型居多,同时随着人们对PD的深入研究,从基因和分子水平的层面上研究PD的发病机制受到越来越多学者的关注.a-Synuclein与PD有着密切的关系,a-Synuclein的过表达、错误修饰与折叠、原纤维及纤维形成参与了多巴胺能神经元的损伤过程[6-7].但是对a-Synuclein的生理功能上不明确,为了进一步探索a-Synuclein及其突变体在多巴胺神经能中的致病机制,建立一个合理的PD体外模型变得尤为重要.
目前广泛应用的PD细胞模型主要包括以下三种:1)非神经元性肿瘤细胞系.以大鼠肾上腺嗜铬瘤PC12细胞为代表;2)神经元性肿瘤细胞系.以神经母细胞瘤细胞系SH-SY5Y等为代表;3)原代中脑细胞;SH-SY5Y细胞是由SK-N-SH细胞系衍生而来(SK-N-SH→SH-SY→SH-SY5→SH-SY5Y),该细胞能够支持质粒的复制,进行转染DNA的高度扩增,使克隆的基因片段得到高效的表达,并可表达神经元标志性物质如:多巴胺-β-羟化酶、神经丝蛋白、阿片受体和神经生长因子受体等[8],其细胞形态及某些生理功能与正常神经元有相似之处,是目前国际上研究神经细胞功能较为理想的一种细胞模型[9].
运用转基因技术构建转基因细胞模型是研究帕金森病发病机制的重要途径,目前将基因导入真核细胞的方法有非病毒介导转染和病毒介导转染两大类[10].病毒介导的基因转染通过病毒携带目的基因进入细胞内,病毒凭借自身的逆转录系统,将携带的基因稳定整合至靶细胞基因组中,使目的基因得以长期稳定表达,因此慢病毒介导转染技术在分子生物领域得到广泛应用.
为了进一步研究a-Synuclein在SH-SY5Y细胞中的表达及a-Synuclein与PD的发病机制,本实验以慢病毒为载体,将人野生型和A53T突变型a-Synuclein基因转入SH-SY5Y细胞内,在宿主细胞内成功的检测到人野生型和A53T突变型a-Synuclein蛋白的表达,并通过嘌呤霉素的筛选获得长期稳定表达的细胞系,这对以后PD发病机制的研究、新药物作用靶点、目标药物设计和有效化合物的筛选具有重要意义.
[1]KHANDELWAL P J,DUMANIS S B,FENG L R,et al.Parkinson-related parkin reduces alpha-Synuclein phosphorylation in a gene transfer model[J].Mol Neurodegener,2010,5(1):47.
[2]GALVIN J E,LEE V M,TROJANOWSKI J Q.Synucleinopathies:clinical and pathological implications[J].Arch Neurol,2001,58:186- 190.
[3]POLYMEROPOULOS M H,LAVEDAN C,LEROY E,et al.Mutation in the a-synuclein gene identified in families with Parkinson’s disease[J].Science,1997,276:2045 -2047.
[4]KRUGER R,KUHN W,MULLER T,et al.Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson’s disease[J].Nature Genet,1998,18:106 -1081.
[5]FEANY M B,BENDER W W.A drosophilamodel of Parkinson’s disease[J].Nature,2000,404:394 -398.
[6]FUJIWARA H,HASEGAWA M,DOHMAE N,et al.a-Synuclein is phosphorylated in synucleinopathy lesions[J].Nat Cell Biol,2002,4(2):160- 164.
[7]MASLIAH E,ROCKENSTEIN E,VEINBERGS I,et al.Dopaminergic loss and inclusion body formation in alpha-synuclein mice:implications for neurodegenerative disorders[J].Science,2000,287:1265-1269
[8]CICCARONE V,SPENGLER B A,MEYERS M B,et al.Phenotypic diversification in human neruoblastoma cell:expression of distinct neural crest lineages[J].Cancer Res,1989,49(1):219-225
[9]GHATAN S,LARNER S,KINOSHITA Y,et al.P38 MAP Kinase mediated bax translocation in nitric oxide induced apoptosis in neurons[J].The Journal of Cell Biology,2000,150(2):335-347.
[10]兰丹梅,邬剑军,苏雅茹,等.人野生型和A53T突变型A-突触核蛋白慢病毒表达载体的构建及在PC12细胞中的转染[J].神经解剖学杂志,2009,25(3):289 -294.
