凋亡抑制蛋白与肿瘤关系的研究
2015-08-05孙秋佳高世勇
孙秋佳,庄 严,高世勇
(哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076)
细胞凋亡是一种主动的死亡过程,人体正常细胞受到刺激后出现自发有序的一系列基因的激活、表达以及调控等,细胞凋亡与增殖,对于维持生物体正常发育和体内稳态起着关键性作用[1].细胞凋亡和抗细胞凋亡信号传导途径对于肿瘤发生、发展和预后的判断是很重要的.参与细胞凋亡的分子代表潜在的癌症诊断标志物和治疗靶点.凋亡抑制蛋白是细胞凋亡、分裂和信号传导的关键,在多种途径作用下控制细胞凋亡、增殖、分化、免疫炎症和迁移.凋亡抑制蛋白不同的家族成员通过不同的机制抑制细胞凋亡,主要是抑制caspase活性、活化NF-κB途径因子调节先天免疫信号影响泛素(Ub)依赖途径抗细胞凋亡、通过外在膜受体依赖性级联反应和内在的线粒体依赖途径阻碍细胞凋亡信号的传导[2-3].到目前为止,已研究的人凋亡抑制蛋白家族成员包括:神经元凋亡抑制蛋白(Neuronal apoptosis inhibitor protein,NAIP),人类凋亡抑制蛋白-1(cellular IAP1,c-IAP1),人类凋亡抑制蛋白-2(cellular IAP2,c-IAP2),X相关凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP),生存素(survivin),含泛素连接酶的杆状病毒IAP重复序列(baculoviral IAP repeat containing ubiquitin - conjugating enzyme,BRUCE,Apollon),黑色素瘤凋亡抑制蛋白(ML-IAP、Livin),ILP-2(Ts-IAP)等.其中,c-IAP1,c-IAP2和 XIAP,ML-IAP直接参与调控细胞凋亡,而其他的家族成员可以通过控制细胞周期或其他炎症途径调节细胞的存活.
IAPs主要有三个结构域,即杆状病毒的凋亡抑制蛋白重复结构域(baculoviral IAP repeat,BIR),锌指结构域(Really Interesting New Gene,RING)与caspase活化募集结构域(caspase activing and recruitment domain,CARD)结构域.IAP蛋白家族的成员的特点是存在的1-3个BIR域,与caspase和其他蛋白质结合.其中,NAIP、c-IAP1、c-IAP2和XIAP都含有三个BIR结构域,但Survivin、Bruce、ML-IAP和 Ts-IAP结构只含有一个BIR结构域.IAP家族所有成员除了Survivin之外都有一个或者多个其他功能域,具有E3泛素连接酶活性的Ring结构域(c-IAP1,c-IAP2,XIAP、Livin和hILP2),可以降解蛋白酶体,介导自身和靶蛋白的泛素化;CARD结构域(c-IAP1,c-IAP2)位于BIR与RING之间,参与蛋白-蛋白相互作用,通过与其他包含此结构域的蛋白形成聚体介导细胞凋亡;泛素结合结构域(UBC)是 Apollon/BRUCE特有的结构域,能够加强Apollon的抑凋亡作用.IAP家族各凋亡抑制蛋白的结构域特征示意图如表1所示.
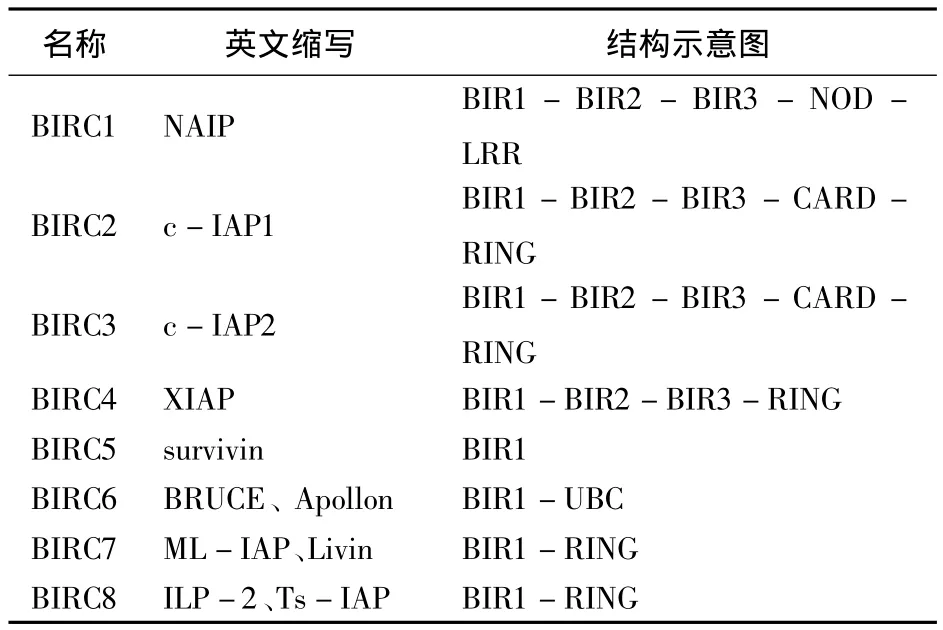
表1 凋亡抑制蛋白结构图
1 NAIP与肿瘤
NAIP既是IAP家族的成员同时又是 NLR(NOD-Like Receptor)家族的成员,拥有3个BIR相连的独特结构,1个中心的核苷酸结合寡聚化区域(NOD),1个羧基末端富含亮氨酸的重复单位(LRR),而无RING结构.由于NAIP的特殊结构,NAIP主要功能是不同于其他的IAP家族成员,现有的研究报道主要是在一些感染性、炎性疾病和神经系统疾病,对于NAIP在恶性肿瘤中的相关表达研究很少.NIAP的NOD上有1个可以与ATP链接的点,与ATP相互作用后NIAP的结构会发生变化导致NAIP结构中的BIR域与caspase结合,阻止细胞凋亡的发生.由于NAIP结构中LRR域的影响,BIR域与caspase结合受阻.NAIP直接结合并抑制caspase-3和caspase-7,与caspase-9结合时则需ATP参与.恶性淋巴瘤和正常样本之间NAIP的表达没有统计学差异,对细胞凋亡的调控不是NAIP的主要功能[4].NIAP的研究主要侧重于神经系统,参与阿尔兹海默病、Down综合征等神经性疾病的发生、发展的调控.
2 c-IAP1、c-IAP2与肿瘤
c-IAP1、c-IAP2含有3个BIR域、1个Ring域以及c-IAP家族所特有的CARD域.c-IAP家族与不同的底物相互作用,包括细胞凋亡、NF-κB信号传导和肿瘤形成,并通过其E3泛素连接酶活性介导这些底物的泛素化.同其他家族成员一样,c-IAPs的BIR结构域可以与相应的caspase结合,抑制caspase的连级反应.c-IAPs与caspase-9前体结合,使其不能激活caspase-9,从而间接抑制了caspase-3,-6,-7的活性.c-IAPs不能直接阻滞caspase-8蛋白水解,但由于c-IAPs可以通过BIR域抑制 caspase-3,从而间接地阻止了caspase-8起始的蛋白水解过程.有研究表明c-IAPs还可以与caspase-7直接作用,但与caspase-l、-6、-8,-10不能直接作用.c-IAPs作为介导结合TRAF1和TRAF2的肿瘤坏死因子受体2(TNFR2)复合物被首次发现.c-IAP蛋白的BIR1结构域与TRAF2的TRAF-N结构域结合,c-IAP1和c-IAP2通过与TRAF2作用结合TNF受体.研究表明,一个 c-IAP蛋白可以结合三个TRAF2分子.在典型的NF-κB途径中通过激活TNFα,c-IAP蛋白可以介导受体相互作用蛋白-1(receptor-interacting protein,RIP1)泛素化,没有c-IAP蛋白的存在RIP1将不能泛素化.非泛素化的RIP1可与转接分子FADD、caspases-8在胞内形成结构复杂的结合物,从而诱导细胞凋亡.在非典型的NF-κB途径中c-IAP家族是负责诱导NF-κB激酶使泛素化和降解减弱.c-IAP1和c-IAP2通过泛素连接酶活性介导外源性凋亡通路.在BIR1域的N-末端区域的细微差异使c-IAP1和c-IAP2具有特异性.与c-IAP1能在多个肿瘤细胞株中表达不同,c-IAP2在癌细胞中表达很有限,它们的mRNA和蛋白水平的表达并不一致[5].
通过黏膜相关淋巴组织(MALT)淋巴瘤高比例表达和染色体易位引起c-IAP2的 BIR域和MALT1的C-末端部分蛋白融合,可能是NF-κB的抗原信号,可裂解底物,达到抑制细胞凋亡的作用[6].c-IAPs在膀胱癌组织中表达率明显高于正常膀胱上皮组织.c-IAP1不仅位于细胞浆,也可能出现于细胞核中,c-IAP2仅见于细胞浆中[7].c-IAP1和c-IAP2的表达程度可能与血管转移有关.鼻咽癌细胞、胰腺癌,宫颈肿瘤,卵巢癌,髓母细胞瘤,恶性胶质瘤,胃癌以及肺腺癌组织中同样发现有c-IAP2的高表达.c-IAP1和 c-IAP2对MAPK信号通路也有激活作用.另有研究报道c-IAP1和c-IAP2抑制凋亡的作用是通过CARD域与肿瘤坏死因子受体相关因子(TRAFS)相互作用[8].
3 XIAP与肿瘤
XIAP是IAP家族成员中对caspase的抑制能力最强有效的蛋白.XIAP的作用机制是通过3个BIR域与caspase-3、-7、-9直接结合使其失效,但对caspase-1、-6、-8、等不能结合发挥作用.XIAP的连接区域是caspase的活性位点,BIR3结构域具有靶向性,与Apaf-1同源并结合,阻止了Apaf-1与caspase-9结合形成复合物,抑制细胞凋亡.在细胞凋亡过程中caspase-3,-7是关键的蛋白酶,在BIR1域的协助下BIR2域和BIR1与BIR2域之间的连接区域可以与caspase-3,-7相互作用并抑制活性.另外,BIR1域能与转化生长因子β激活性激酶(Transforming growth factor β activated kinase,TAK1)和TAK1结合蛋白因子(TAK1-binding protein,TAB1)形成复合体,进而激活 c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK),在 JNK 的介导下激活 NF - κB 途径[9].此外,XIAP的Ring结构域通过泛素化、降解caspase蛋白酶和信号转导途径抑制细胞凋亡.通过对结构和生化的精确定义,已证实XIAP是IAP家族中惟一直接抑制caspase活性的抗凋亡蛋白[10].
XIAP在几乎所有的肿瘤细胞株中均有表达.肾癌、结直肠癌、肝癌、肺癌、胰腺癌等组织的发生、发展与XIAP有显著相关性,XIAP的表达均高于正常组织[11-12].研究表明,XIAP 基因的表达异常可能是肿瘤细胞失去正常凋亡调控并能在不良条件下生存的原因.通过运用RNA干扰技术、基因治疗、化学合成的XIAP抑制剂等方法对XIAP的深入研究,可以通过抑制XIAP,促进肿瘤细胞凋亡坏死,增加对化疗药物的敏感性.
4 survivin与肿瘤
survivin是IAP基因家族中分子量最小的成员,同时也是一个多功能蛋白,不仅抑制细胞凋亡而且在包括调控有丝分裂等细胞分裂基本功能中也发挥重要的作用[13].它的结构非常独特,仅有一个BIR结构域.survivin在正常和肿瘤组织的表达有很大不同.survivin在胎儿组织表达,但随着发育过程中受抑制不表达.survivin在干细胞,胸腺,睾丸,再生肝细胞和内皮细胞中表达但是在其他大多数分化成熟组织中表达很低或检测不到,但在大多数肿瘤组织中均过度表达.一般认为,细胞核中的survivin控制有丝分裂,细胞质或线粒体中survivin则保护细胞免于凋亡[14].survivin在细胞凋亡、增殖、血管生成、耐辐射和化疗过程中是一个关键调节点.一些研究表明,survivin表达上调与癌症预后差之间具有相关性,其下调或失活抑制肿瘤的生长.survivin在肿瘤中的异常高表达与肿瘤复发率的增加、疾病晚期等相关,survivin几乎触及了包括癌症发生、发展、预后各个方面,因此,对于survivin的研究有着重大的临床意义.survivin蛋白具有靶向性地抑制肿瘤生长的能力,同时自发性的诱导肿瘤细胞凋亡.survivin主要通过抑制caspase-3、-7活性阻断细胞凋亡,由于survivin结构简单,不能直接与caspase结合抑制活性,从而调控细胞有丝分裂.通过p21间接抑制caspase;通过抑制p53的功能阻断凋亡过程;在有丝分裂过程中与微管蛋白作用调节细胞,间接发挥抗凋亡功能.survivin还可通过抑制细胞色素C的释放抑制凋亡.survivin还特异性作用于细胞分裂G2/M期,使G2/M期监控点不能有效对肿瘤细胞进行监控,导致细胞异常增殖,从而促进肿瘤发生.
survivin在肿瘤细胞的特异性表达,使其在临床诊断过程中可以作为标志物判断肿瘤早晚期.免疫组化方法检测survivin在原发性肺腺癌中的表达发现明显高于正常病变[15].survivin的表达与预后差呈正相关性,survivin阳性表达增加乳腺癌复发的风险降低生存率[16].在多种常见的包括食管腺癌、胃癌、结直肠癌、胰腺癌、肝癌等肿瘤组织中survivin的高表达都会增加相关的死亡风险[17].survivin在卵巢良性肿瘤和卵巢上皮性恶性肿瘤中的表达具有明显的差异性,可能与肿瘤临床分期、组织学分级和淋巴结转移等有关.survivin在几乎所有恶性肿瘤组织中均高表达,如乳腺癌、肺癌、胆囊癌、肝癌、黑色素瘤、结肠癌等60余种肿瘤组织或细胞[18].
5 Livin与肿瘤
几乎在同一时期Livin被4个不同的实验小组通过找寻凋亡蛋白同源序列的方法发现,并依据方法不同被分别命名为Livin、KIAP(kidney IAP)、ML- IAP(melanoma IAP)、Livinα 和 Livinβ[19-22].Livin同Survivin一样,在肿瘤细胞系中高度表达,但在大部分正常成人组织中表达量很小或者不表达,可能与肿瘤的形成和细胞增殖活跃密切相关.研究表明,Livin能选择性表达于恶性肿瘤组织中,可以作为抗肿瘤靶向治疗的良好靶点[23].
Livin作用机制是抑制caspase-3、-7、-9的活性,介导细胞凋亡.Livin与caspase的相互作用具有特异性,Livin拥有完整的BIR域,如果氨基酸的结构改变会引起Livin与caspase相互作用,Livin的抑制细胞凋亡的作用减弱或者消失,BIR域也通过参与死亡受体介导的凋亡和中性粒细胞的自发凋亡的smac及活性肽片段特异性结合抑制caspase途径.Livin参与TAK1/JNK1信号传导途径,激活MAP(mitogen activated protein)激酶JNK1和JNK2,对JNK3无激活作用,而Livin对JNK1的激活作用远远强于JNK2.Livin通过TAB1/TAK1途径激活JNK1.TAB1是TAK1的共反应子,Livin与TAB1结合后,进一步激活 TAK1从而激活JNK1,诱导细胞凋亡.Livin在黑色素瘤、胃癌、膀胱癌、淋巴瘤、肺癌、鼻咽癌、恶性胸膜间皮瘤、结肠癌、淋巴细胞性白血病、前列腺癌、胰腺癌、白血病及脑胶质瘤等大部分恶性肿瘤中是高表达的,在大部分肿瘤组织中也表达,如乳腺癌细胞系等,但在各系统的正常组织中却是低表达或很少表达[24].
6 BRUCE与肿瘤
BRUCE(Apollon)是IAP家族分子质量最大.正常条件下BRUCE拮抗Smac蛋白和caspase-9的活性是抑制细胞凋亡的主要作用机制.BRUCE在细胞凋亡中似乎充当了Bcl-2/Bcl-xL的角色,阻止 caspase活化剂从线粒体释放,抑制caspase活性[25].BRUCE 是通过促进 Smac/DIABLO的泛素化使其降解,抑制其诱导细胞凋亡;与其他的IAPs不同,BRUCE还可以与 Smac/DIABLO前体结合,也会促进其蛋白酶体降解,并抑制procaspase-9裂解[26]从而抑制 caspase-9的活性.BRUCE的UBC结构域缺失与肿瘤抑制基因p53,激活线粒体凋亡途径,与诱导细胞凋亡有关[27].BRUCE与caspase-9前体的相互作用可能是抑制细胞凋亡的关键,此外,BRUCE能抑制成熟caspase-9的活性,但不能与caspase-3相互作用[26].
BRUCE/Apollon蛋白在神经胶质瘤、脑肿瘤和卵巢癌等许多细胞系以及骨髓增生异常综合征的骨髓细胞中过度表达.Apollon在一些耐DNA损伤剂的脑肿瘤细胞系的上调,同时其过度表达与儿童急性髓系白血病预后不良相关[27].通过反义寡核苷酸或者运用siRNA技术,Apollon蛋白量降低可使抗癌药物诱导癌症细胞凋亡更容易[28],也许可以作为一个治疗疾病的新靶点.
7 ILP-2与肿瘤
ILP-2是在正常成人睾丸组织中鉴定出来的结构与XIAP(ILP-1)高度同源但其编码基因不同的凋亡抑制蛋白.ILP-2与ILP-1不同,ILP-2的过度表达对FAS或肿瘤坏死因子TNF介导的细胞凋亡无保护作用.但是在细胞凋亡过程中,胞质内与caspase-9结合的BAX亚细胞结构高数量表达.ILP-2通过 Bax的过表达或者 Apaf-1/caspase-9途径的共同表达能有效抑制细胞凋亡[23].在体内以抗凋亡信号转导为主的情况下,ILP-2受到凋亡信号刺激后,在体内大量表达,与Smac结合而抑制Smac的caspase活化蛋白酶的活性,从而使caspase未能活化而发挥抗凋亡作用.在正常组织中,只在睾丸中检测到的ILP-2基因的表达,但是ILP-2不能直接抑制caspase活性.ILP-2和ILP-1之间最重要的区别是与ILP-2缺乏两个氨基末端BIR域.鉴于两种蛋白质之间的高同源性,缺失的BIR结构域可能是两种蛋白质在生物活性差异的主要决定因素[29].ILP-2的高度特异性对更好地了解细胞凋亡的机制是非常有用的.
ILP-2在骨髓增生异常综合症(MDS),急性髓系白血病(AML),慢性髓细胞白血病(CML)乳腺癌患者中均有高表达;但是ILP-2在CML加速期表达高于慢性期.可以推断出在CML的发生发展中ILP-2表达有重要作用,如果慢性期的患者ILP-2表达升高,预示疾病可能恶化[30].ILP -2可能与癌症的发生、发展密切相关,ILP-2有望成为癌症诊断和治疗的新靶点.
8 结语
凋亡抑制蛋白在细胞凋亡中发挥重要作用,家族成员在多种肿瘤组织细胞中高表达,发挥调节凋亡的作用,与多种肿瘤的发生密切相关.但是凋亡抑制蛋白在细胞凋亡作用机制以及与其他抗凋亡基因的相互关系还有待进一步研究.凋亡抑制蛋白作为癌症诊断的新的标记物、癌症治疗的新靶点随着研究的深入,也许会为临床治疗肿瘤提供新思路和新的治疗方法.
[1]CZABOTAR P E,LESSENE G,STRASSER A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
[2]WANG K,LIN B.Inhibitor of apoptosis proteins(IAPs)as regulatory factors of hepatic apoptosis[J].Cell Signal,2013,25(10):1970-1980.
[3]曹子鹏.X连锁凋亡抑制蛋白(XIAP)影响肿瘤细胞增殖的生物学新功能研究[D].陕西:第四军医大学,2013.
[4]MAZROUEI S,ZIAEI A,TANHAEE A P,et al.Apoptosis inhibition or inflammation:the role of NAIP protein expression in Hodgkin and non-Hodgkin lymphomas compared to non-neoplastic lymph node[J].J Inflamm(Lond),2012,9(1):4.
[5]杨先智.凋亡调控因子c-IAP1,c-IAP2和caspase3在大肠肿瘤中的表达及意义[D].遵义:遵义医学院,2009.
[6]MEI Y,HAHN A A,HU S,et al.The USP19 deubiquitinase regulates the stability of c-IAP1 and c-IAP2[J].J Biol Chem,2011,286(41):35380-35387.
[7]郝琳.c-IAP1/2在膀胱癌中的表达及意义[D].延边:延边大学,2011.
[8]HOFMANN H S,SIMM A,HAMMER A,et al.Expression of inhibitors of apoptosis(IAP)proteins in non-small cell human lung cancer[J].J Cancer Res Clin Oncol,2002,128(10):554-560.
[9]NAKAGAWA T,ZHU H,MORISHIMA N,et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid - beta[J].Nature,2000,403(6765):98-103.
[10]ECKELMAN B P,SALVESEN G S,SCOTT F L.Human inhibitor of apoptosis proteins;why XIAP is the black sheep of the family[J].EMBO Reports,2006,7(10),988 -994.
[11]CHEN P,LI J,GE L P,et al.Prognostic value of survivin,X-linked inhibitor of apoptosis protein and second mitochondria-derived activator of caspases expression in advanced nonsmall-cell lung cancer patients[J].Respirology,2010,15(3):501-509.
[12]严晓丹,戴 岭,蒋 敏,等.XIAP在胰腺癌化疗耐药及治疗中的研究进展[J].现代生物医学进展,2010,09:1768-1770.
[13]ALTIERI D C.The case for survivin as a regulator of microtubule dynamics and cell- death decisions[J].Curr Opin Cell Biol,2006,18(6):609 -615.
[14]LI F,YANG J,RAMNATH N,et al.Nuclear or cytoplasmic expression of survivin:what is the significance?[J].Int J Cancer,2005,114(4):509 -512.
[15]YU S,ZHANG Z,ZHANG B,et al.Clinical significance of PIK3CA and survivin in primary adenosquamous lung carcinoma[J].Med Oncol,2014,31(6):983.
[16]LI Y,MA X,WU X,et al.Prognostic Significance of Survivin in Breast Cancer:Meta - analysis[J].Breast J,2014,20(5):514-524.
[17]宰红艳,易小平,李宜雄,等.抑制X染色体连锁的凋亡抑制蛋白(XIAP)和Survivin表达对胰腺癌Panc-1细胞增殖及化疗敏感性的影响[J].北京大学学报:医学版,2013,02:242-249.
[18]张宝刚.RNA联合干扰STAT3及Survivin对膀胱癌细胞的抑制作用研究[D].吉林:吉林大学,2014.
[19]KASOF G M,GOMES B C.Livin,a novel inhibitor of apoptosis protein family member[J].J Biol Chem,2001,276(5):3238-3246.
[20]LIN J H,DENG G,HUANG Q,et al.KIAP,a novel member of the inhibitor of apoptosis Protein family[J].Bioehem Biophys Res Commun,2000,279(3):820-831.
[21]VUCIC D,STENNICKE H R,PISABARRO M T,et al.MLIAP,a novel inhibitor of apoptosis that is preferentially expressed in human melanomas[J].Curr Biol,2000,10(21):1359 -1366.
[22]ASHHAB Y,ALIAN A,POLLIAEK A,et al.Two splicing variants of a new inhibitor of apoptosis gene with different biological properties and tissue distribution pattern [J].FEBS Lett,2001,495(1-2):56-60.
[23]SALEEM M,QADIR M I,PERVEEN N,et al.Inhibitors of apoptotic proteins:new targets for anticancer therapy[J].Chem Biol Drug Des,2013,82(3):243 -251.
[24]WANG X,XU J,JU S,et al.Livin gene plays a role in drug resistance of colon cancer cells[J].Clin Biochem,2010,43(7-8):655-660.
[25]QIU X B,MARKANT S L,YUAN J,et al.Nrdp1 - mediated degradation of the gigantic IAP,BRUCE,is a novel pathway for triggering apoptosis[J].EMBO J,2004,23(4):800 -810.
[26]QIU X B,GOLDBERG A L.The membrane-associated inhibitor of apoptosis protein,BRUCE/Apollon,antagonizes both the precursor and mature forms of Smac and caspase -9[J].J Biol Chem,2005,280(1):174-182.
[27]SUNG K W,CHOI J,HWANG Y K,et al.Overexpression of Apollon,an antiapoptotic protein,is associated with poor prognosis in childhood de novo acute myeloid leukemia[J].Clin Cancer Res,2007,13(17):5109 -5114.
[28]刘媛媛.Apollon反义寡核苷酸对K562细胞增殖、凋亡和耐药影响的研究[D].山东:滨州医学院,2011.
[29]RICHTER B W,MIR S S,EIBEN L J,et al.Molecular cloning of ILP-2,a novel member of the inhibitor of apoptosis protein family[J].Mol Cell Biol,2001,21(13):4292 -4301.
[30]ABE S,YAMAMOTO K,HASEGAWA M,et al.Bone marrow cells of myelodysplastic syndromes exhibit significant expression of apollion,livin and ILP-2 with reduction after transformation to overt leukemia[J].Leuk Res,2005,29(9):1095 -1096.
