DNMT3a基因shRNA质粒表达载体的构建及其沉默作用
2015-08-03吴艳凤李德涛薛成军重庆医科大学附属第一医院检验科重庆400016
吴艳凤 李德涛 郑 倩 李 雪 薛成军 陈 辉 (重庆医科大学附属第一医院检验科,重庆 400016)
表观遗传学调控是肿瘤细胞对顺铂获得性耐药产生的重要途径之一,甲基化是表观遗传修饰的重要方式,DNA甲基转移酶(DNMTs)是甲基化调节的关键酶,是基因表达的重要调控因子〔1〕。在哺乳动物细胞中,具有催化活性的DNMTs有三个亚型,分别为 DNMT1、DNMT3a和 DNMT3b,其中 DNMT3a和DNMT3b在哺乳动物的发育和甲基化形成阶段发挥重要作用〔2〕,DNMT3a是DNMTs中的重要成员之一,在新形成甲基化时发挥关键作用。新近研究发现DNMT3a及其调控的多基因异常甲基化所致肿瘤细胞抗凋亡途径激活是影响放疗和化疗敏感性的重要因素。前期研究中发现DNMT3a在顺铂耐受的同源A549细胞(A549-DDP)中的表达水平明显高于亲本A549细胞中的表达〔3〕,本研究拟通过利用RNA干扰技术,设计以DNMT3a的mRNA保守序列为靶点的shRNA序列,通过pGenesil-1载体构建携带DNMT3a shRNA的真核表达载体,为进一步研究DNMT3a在A549-DDP细胞中的过表达与其对顺铂化疗耐受关系奠定基础。
1 材料与方法
1.1 细胞株 肺腺癌A549细胞株由重庆医科大学附属第一医院惠赠,A549-DDP是在人肺腺癌细胞A549的基础上,以顺铂作为诱导药物,采用逐步递增浓度的方法诱导获得,在常规培养中使用2 μg/ml的顺铂维持其耐药性状。
1.2 主要试剂 pGensil-1质粒由重庆医科大学检验医学院涂植光教授惠赠,克隆用的大肠杆菌DH5a由本实验室保存,T4 DNA Ligdase、BamHⅠ、HinDⅢ、PstⅠ购自 TakaRa 公司,RPMI-1640培养基与胎牛血清购自美国Hyclon公司,质粒小量提取试剂盒、凝胶回收试剂盒购自Omega公司,annealing缓冲液购自碧云天生物研究所。
1.3 方法
1.3.1 DNMT3a靶向siRNA设计与合成 Genbank中找到针对人DNMT3a的mRNA核苷酸序列(共有三个不同剪切体,GenBank No.NM_175629.1,NM_153759.2,NM_022552.3)。选择催化区保守序列的共同片断作为目的基因,参考shRNA设计原则,正义链带有 BamHⅠ的限制性酶切位点,反义链带有HinDⅢ的酶切位点,应用 BLAST进行同源序列对比后设计1条shRNA序列和1条无效干扰序列(HK),通过BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)同源性比对分析以排除其他具有同源性的其他基因。根据BamHⅠ+Sense+Loop+Antisense+终止信号+HinDⅢ的结构,设计序列如下:shRNADNMT3a-A:5'-GATCCCCAGATGTTCTTCGCTAATCTATGGACAA TTAGCGAAGAACATCTGGTTTTTTA-3';shRNA-DNMT3a-B:5'-AGCTTAAAAAACCAGATGTTCTTCGCTAATTGTCCATAGATTAG CGAAGAACATCTGGG-3';shRNA-HK-A:5'-GATCCGACTTCATAAGGCGCATGCTTCAAGACGGCATGCGCCTTATGAAGTC TTTTTTA-3';shRNA-HK-B:5'-AGCTTAAAAAAGACTTCATAAGGCGCATGCCGTCTTGAAGCATGCGCCTTATGAAGTCG-3',寡 核苷酸序列由上海英骏(Invitrogen)生物技术有限公司合成。
1.3.2 构建步骤 ①单链目的基因片段的退火连接:各用一定量annealing缓冲液溶解合成1 OD单链目的基因片段至0.01 nmol/μl,分别取 5 μl shRNA-DNMT3a-A 与 5 μl shRNADNMT3a-B 及 5 μl shRNA-HK-A 与 5 μl shRNA-HK-B 混匀,94℃水浴缓慢退火冷却至室温。②质粒 pGenesil-1用BamHⅠ+HinDⅢ双酶切,1%琼脂糖凝胶电泳,回收大片段。③退火片段分别与线性化pGenesil-1质粒载体利用T4 DNA连接酶16℃过夜连接。④各取5 μl连接产物转化感受态细胞DH5α,分别涂布于含卡那霉素(终浓度50 μg/ml)的LB平板上,37℃恒温箱培养过夜。⑤从培养皿上挑取2个阳性菌落接种于5 ml含卡那霉素(终浓度50 μg/ml)的液体LB培养基中,37℃,200 r/min,振摇12~16 h。⑥用小提试剂盒小量提取质粒,质粒分别用 BamHⅠ,HinDⅢ,PstI做酶切鉴定,酶切产物用1%琼脂糖凝胶电泳检查。
1.3.3 重组质粒进行测序鉴定 将初步鉴定证实后的细菌常规培养扩增,保存菌液,并提取质粒,分别取质粒和菌液送上海invitrogen公司测序。
1.3.4 细胞培养与转染 用含10%胎牛血清的RPMI-1640完全培养基37℃、5%CO2条件下常规培养A549-DDP细胞24 h,0.25% 胰酶消化贴壁A549-DDP细胞,新鲜RPMI-1640完全培养基中和胰酶并收集细胞,室温500 r/min离心5 min,弃上清,并用RPMI-1640完全培养基重悬细胞,用牛鲍氏计数板计数,按照每孔2×105个细胞铺6孔板,37℃、5%CO2分别培养24 h后,严格按照转染试剂说明书将2 μl转染试剂+1 μg DNA分别转染pGenesil-1-DNMT3a-shRNA和pGenesil-1-HK-shRNA,37℃,5%CO2培养24 h在倒置荧光显像镜下观察转染效率。
1.3.5 RT-PCR检测转染前后DNMT3a mRNA水平 用Trizol法提取转染后24、48、72 h总RNA,分光光度法检测RNA浓度。参照文献〔4,5〕设计引物,其中GAPDH为内参基因。取500 ng总RNA按逆转录试剂盒说明书合成cDNA序列,然后进行PCR反应,条件如下:95℃预变性,5 min,94℃变性,30 s,58℃ 退火,30 s,72℃延伸30 s,共35个循环,72℃延伸10 min。GAPDH以相同条件反应35个循环。PCR产物在2%琼脂糖凝胶中电泳30 min。
2 结果
2.1 载体的酶切鉴定 将pGenesil-1载体用BamHⅠ和HinDⅢ进行双酶切,回收产物进行电泳检查,环状质粒被切开形成大小两个片段,大片段为4 870 bp,小片段为30 bp(因太小跑出胶外而未见成像),见图1。
2.2 重组质粒的酶切鉴定 质粒pGenesil-1的多克隆位点(MCS)如下:-HindⅢ-XbaⅠ-SalⅠ-PstⅠ-BamHⅠ-U6 Promotor-EcoRⅠ-SalⅠ-X baI-DraⅢ,pGenesil-1质粒可被 PstⅠ切开,而在重组质粒中由于外源性寡核苷酸片段插入成功后PstⅠ位点被取代,重组质粒不能被切开,见图2。
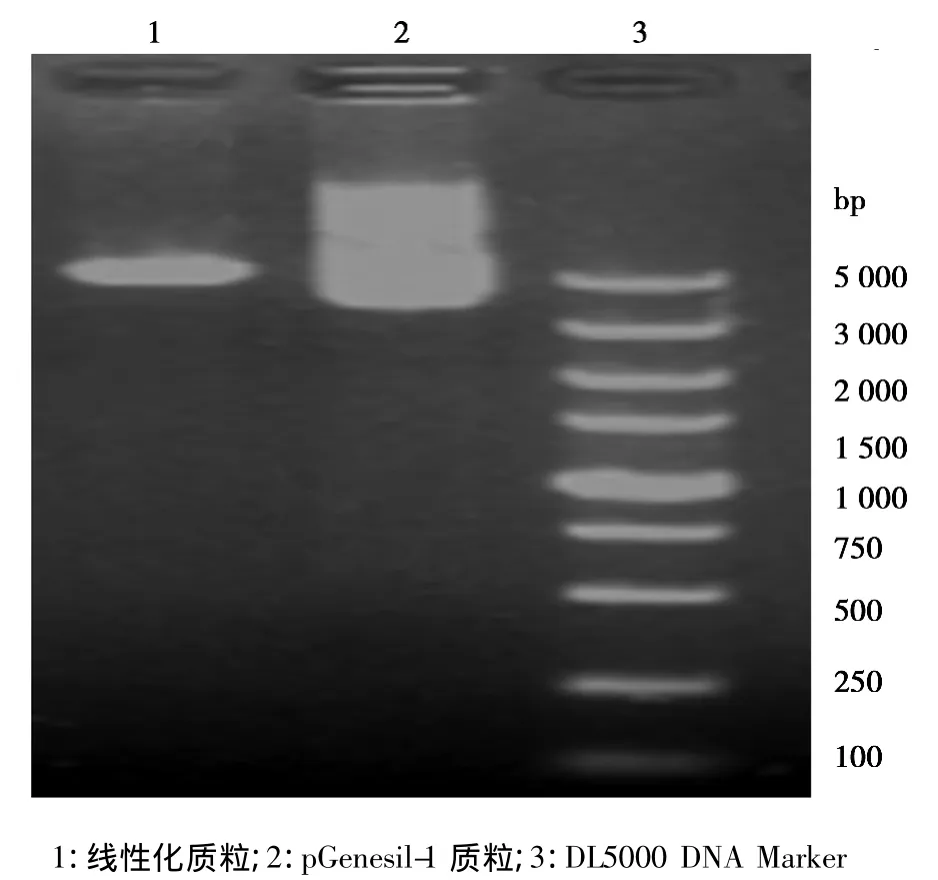
图1 BamHⅠ和HinDⅢ双酶切环状质粒pGenesil-1结果

图2 重组质粒PstⅠ酶切鉴定结果
2.3 重组质粒测序鉴定 重组质粒(pGenesil-1-DNMT3a-shRNA、pGenesil-1-HK-shRNA)的测序结果与合成序列完全相同,成功构建两组质粒。
2.4 重组质粒转染效率鉴定 由于pGenesil-1质粒中带有编码绿色荧光蛋白的基因,若转染成功则可在细胞内产生绿色荧光蛋白。将 pGenesil-1-DNMT3a-shRNA、pGenesil-1-HK-shRNA重组质粒转染A549-DDP细胞24 h后,倒置荧光显微镜下观察,成功转染的细胞中出现绿色荧光(图3),重组质粒成功转入细胞。
2.5 重组质粒重组效率验证 利用RT-PCR检测转染pGenesil-1-DNMT3a-shRNA 24、48、72 h后 DNMT3a在 mRNA 水平的变化,转染后DNMT3a mRNA水平显著降低,并呈明显的时间依赖性,抑制率分别为25.5%,56.2%,63.4%,而转染pGenesil-1-HK-shRNA组DNMT3a在mRNA水平无明显变化,见图4。

图3 荧光显微镜下观察转染重组质粒24 h后A549-DDP细胞(×200)

图4 RT-PCR检测转染前后DNMT3a mRNA水平变化
3 讨论
RNA干扰(RNAi)作为一种选择性抑制特殊基因表达的技术是研究疾病发病机制与基因表达最常用的手段之一〔6〕。RNAi是一种转录后抑制,在RNA干扰的效应阶段,不同来源的 dsRNA 在 Dicer作用下产生21~23nt的 siRNA〔7〕,siRNA 与核酶复合物形成RNA诱导沉默复合物(RISC),在ATP酶作用,激活的RISC通过碱基配对定位至对应的mRNA上,导致mRNA同源依赖性降解〔8〕,从而使细胞表现出特定基因表型缺失。RNAi的发现改变了人们对细胞基因调控的传统理解,为特异性阻断基因表达、评价基因功能及研究肿瘤发病机制提供了新策略。研究证实 RNAi主要通过 microRNA、shRNA、siRNA〔9〕三种途径完成。而目前广泛应用的RNAi技术则主要通过体外化学合成和载体介导的体内合成来实现,前者是通过人工合成针对特定靶基因的siRNA序列,然后通过一定的手段转入细胞内发挥干扰作用,此法操作简单,但体外合成的siRNA易被细胞内的RNA酶降解,且还可随细胞的增殖逐渐被稀释导致干扰效率低,干扰持续时间短,体内合成则由质粒和病毒等载体介导,病毒载体成本高、对细胞毒性大,操作时需要有较高的精确度;质粒载体则具有经济便利和制备质量可控性好等优点,不仅可在原核生物细胞内进行大量扩增,还可真核细胞中持续扩增并发挥特异性抑制靶基因mRNA的转录和其蛋白的表达,持续时间可达数星期甚至更久〔10〕,是目前RNAi最常用的方式。
本实验中使用的载体是含有U6启动子和RNA聚合酶Ⅲ启动子的pGenesil-1载体,U6启动子可转录产生shRNA,本次实验中设计的分隔正义和反义片段的9个碱基互补可折返形成短发卡状双链RNA,这种短发卡状RNA结构可被细胞内酶切割成siRNA后引发特定靶基因沉默。同时,U6启动子在真核细胞中可以精确地识别RNA的转录起始和终止位置,并且U6启动子能被RNA聚合酶Ⅲ识别合成RNA,确保shRNA总是表达,此外,U6启动子的转录起始位置刚好被限制性内切酶切断,可直接插入 shRNA序列,在转录后不需切除多余的碱基。保证了插入序列的高效性和高度特异性。RNA聚合酶Ⅲ系统的关键优势在于转录过程可被中止序列(TTTTT)准确中止。有研究证实RNA聚合酶Ⅲ启动子和 shRNA编码序列的质粒转染哺乳动物细胞时,这种能表达siRNA的质粒可以下调包括外源基因和内源基因在内的特定基因的表达〔11〕。此外,pGenesil-1重组质粒载体导入细胞后相对稳定可传递到子代细胞中去,使抑制靶基因可被遗传,同时该载体还带卡那霉素和新霉素(G418)筛选标记,能够快速原核筛选出阳性克隆菌株,并且可经长期筛选获得稳定的DNMT3a表达缺失的细胞株,此外,该载体还带有编码绿色荧光蛋白的基因序列,可通过荧光实时监测重组质粒在细胞内的表达和定位。
本实验成功构建了携带干扰DNMT3a基因表达的RNAi序列的pGenesil-1-shRNA-DNMT3a重组质粒,经体外扩增后可直接转染细胞进行基因沉默,有效的干扰了DNMT3a在A549-DDP细胞株中的表达,克服了以往应用化学合成法进行RNAi干扰技术研究基因功能的瞬时性干扰的缺陷〔12〕,为后续研究DNMT3a在A549-DDP中的过表达与肺癌对顺铂耐受关系奠定基础,同时也为肺癌顺铂化疗耐受的基因治疗提供新途径。
1 Jones PA,Takai D.The role of DNA methylation in mammlian epigenetics〔J〕.Science,2001;293(5532):1068-70.
2 王志刚,吴建新.DNA甲基转移酶分类、功能及其研究进展〔J〕.遗传,2009;31(9):903-12.
3 吴艳凤,侯玉磊,薛成军,等.DNMT3a表达上调与A549细胞对顺铂耐受关系的实验探究〔J〕.中国细胞生物学学报,2013;35(7):991-6.
4 Zhang Q,Chen L,Helfand BT,et al.TGF-β regulates DNA methyltransferase expression in prostate cancer,correlates with aggressive capabili-ties,and predicts disease recurrence〔J〕.PloS One,2011;6(9):e25168.
5 Attwood J,Richardson B.Relative quantitation of DNA methyltransferase mRNA by real-Time RT-PCR assay〔J〕.Methods Mol Biol,2004;287:273-83.
6 Kim D,Rossi J.RNAi mechanisms and applications〔J〕.Biotechniques,2008;44(5):613.
7 杨 媛,王 蒙,粟永萍.RNAi作用机制研究进展及其应用〔J〕.免疫学杂志,2005;21(6):543-5.
8 Nykanen A,Haley B,Zamore PD.ATP requirements and small interfering RNA structure in the RNA interference pathway〔J〕.Cell,2001;107(3):309-21.
9 Khatri N,Rathi M,Baradia D,et al.In vivo delivery aspects of miRNA,shRNA and siRNA〔J〕.Crit Rev Ther Drug Carrier Syst,2012;29(6):487-527.
10 Yu JY,DeRuiter SL,Turner DL.RNA interference by expression of short interfering RNAs and hairpin RNAs in mammalian cells〔J〕.Proc Natl Acad Sci USA,2002;99(9):6047-52.
11 Bannister SC,Wise TG,Cahill DM,et al.Comparison of chicken 7SK and U6 RNA polymeraseⅢpromoters for short hairpin RNA expression〔J〕.BMC Biotechnol,2007;7(1):79-87.
12 Irie N,Sakai N,Ueyama T,et al.Subtype and species-specific knockdown of PKC using short interfering RNA〔J〕.Biochem Biophys Res Commun,2002;298(5):738-43.
