PEI介导pCEP4/EGFP瞬时转染293-F细胞条件优化
2015-08-01贺玉萍易晓红
贺玉萍,张 航,易晓红
(1.成都中医药大学 基础医学院,四川 成都 611137;2.四川大学 华西医院生物治疗国家重点实验室,四川 成都 610041)
0 引 言
重组蛋白在生物化学、信号转导、新药筛选以及疾病治疗等领域具有广泛的需求,其制备工艺包括传统的构建稳定细胞株表达和基因瞬时转染表达.目前,在临床及实验室研究中,往往要求在短时间内生产一定量的候选蛋白供应研究需求,这使得瞬时基因表达技术近年来得到广泛应用[1].聚乙烯亚胺(polyethylenimie,PEI)是基因瞬时转染广泛使用的转染试剂,具有成本较低、操作简便、适用宿主范围广、转染效率高以及包装容量不受限制等优势[2-4].真核表达载体pCEP4 包含有EBNA-11 基因、EBNA Orip、CMV 启动子、氨苄抗性和潮霉素筛选标记,可用于稳定和瞬时转染[5].本研究通过构建真核表达载体pCEP4/EGFP,PEI 介导瞬时转染293-F 细胞,观察转染效率,优化转染条件,拟为后续重组蛋白瞬时表达奠定基础.
1 材料与方法
1.1 材 料
实验所用材料包括:293-F 细胞和pREP4/EGFP质粒为本实验室保存;pCEP4 质粒购自Life Technologies Corporation;Trans5α 感受态细胞购自北京全式金生物技术公司;限制性内切酶Not I 和Hind III、琼脂糖凝胶DNA 回收试剂盒、T4 连接酶试剂盒购自TaKaRa;质粒抽提试剂盒购自Omega bio-tek 和Promega;转染试剂支化聚乙烯亚胺(polyethylenimie,branched)购自Sigma-aldrich;FreeStyle 293 Expression Medium 购自gibco;1640 培养液由本实验室配制.
1.2 方 法
1.2.1 重组载体pCEP4/EGFP 构建.
酶切pCEP4、pREP4/EGFP 质粒,并回收目的片段(pCEP4 Not I/Hind III(10.2kb),EGFP Not I/Hind III(0.8kb)).将回收的目的片段进行连接,连接产物转化Trans5α 感受态细胞.氨苄青霉素筛选培养,挑取阳性单克隆菌落至LB 液体培养基中,37℃,225 r/min摇菌过夜.提取质粒,Not I/Hind III 双酶切,电泳鉴定.
1.2.2 293-F 细胞的培养及重组载体的PEI 转染.
1)24 孔板.将293-F 细胞接种于专用培养液(FreeStyle 293 Expression Medium),37 ℃、5% CO2培养.铺板前1 天以7 ×105cells/mL 的密度接种培养,转染前3 h 以0.9 ×106cells/mL 的密度铺24 孔板,置于摇床上培养.配制PEI 浓度为1 mg/mL,pH 值调整为7.0,用0.22 μm 滤膜于洁净条件下过滤;DNA浓度为1 μg/mL.配制DNA/PEI 混合物,N/P 范围10~30,混合时用1640 培养液,室温中放置10 min,转染293-F 细胞,置于摇床上培养,分别于24 h、48 h后在荧光显微镜下观察绿色荧光蛋白的表达情况.
2)悬浮培养.转染前24 h,293-F 以8 × 106cells/mL 的密度接种培养20 mL,悬浮培养.转染时细胞计数,细胞活力应达到90%以上,将细胞稀释为1.5 ×106cells/mL,18 mL;DNA 用量为1 μg/mL,N/P 为25,混合时用1640 培养液,混合液为2 mL,室温中放置10 min.转染后细胞继续悬浮培养,130 r/min.48 h 后荧光显微镜下观察绿色荧光蛋白表达情况,流式细胞仪检测转染效率.
2 结 果
2.1 pCEP4、pREP4/EGFP 酶切后的目的片段
pCEP4、pREP4/EGFP 经Not I 与Hind III 双酶切后获得的目的片段pCEP4(10.2kb)和EGFP(0.8kb)如图1 所示.
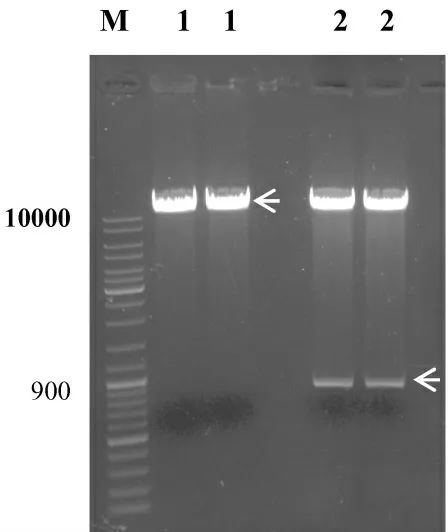
图1 pCEP4/EGFP 酶切后的目的片段
2.2 重组载体pCEP4/EGFP 的酶切鉴定
重组载体pCEP4/EGFP 双酶切鉴定如图2 所示,其与预期结果一致.
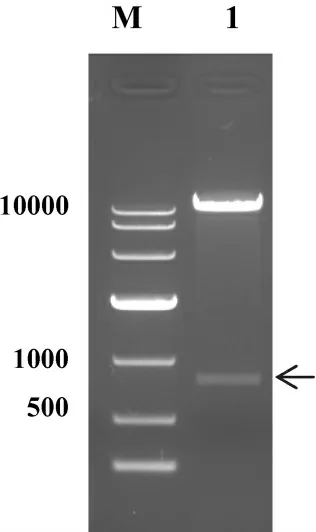
图2 pCEP4/EGFP 重组载体的双酶切鉴定
2.3 pCEP4/EGFP PEI 转染293-F 细胞
2.3.1 24 孔板.
转染24 h、48 h 后绿色荧光蛋白表达情况如图3 所示.光镜下观察细胞状态可见,悬浮细胞漂浮成团(24 孔板摇动幅度太小),随着PEI 浓度的增加,贴壁细胞数目亦增加.当N/P 为25,转染48 h 后,转染效率相对最高.
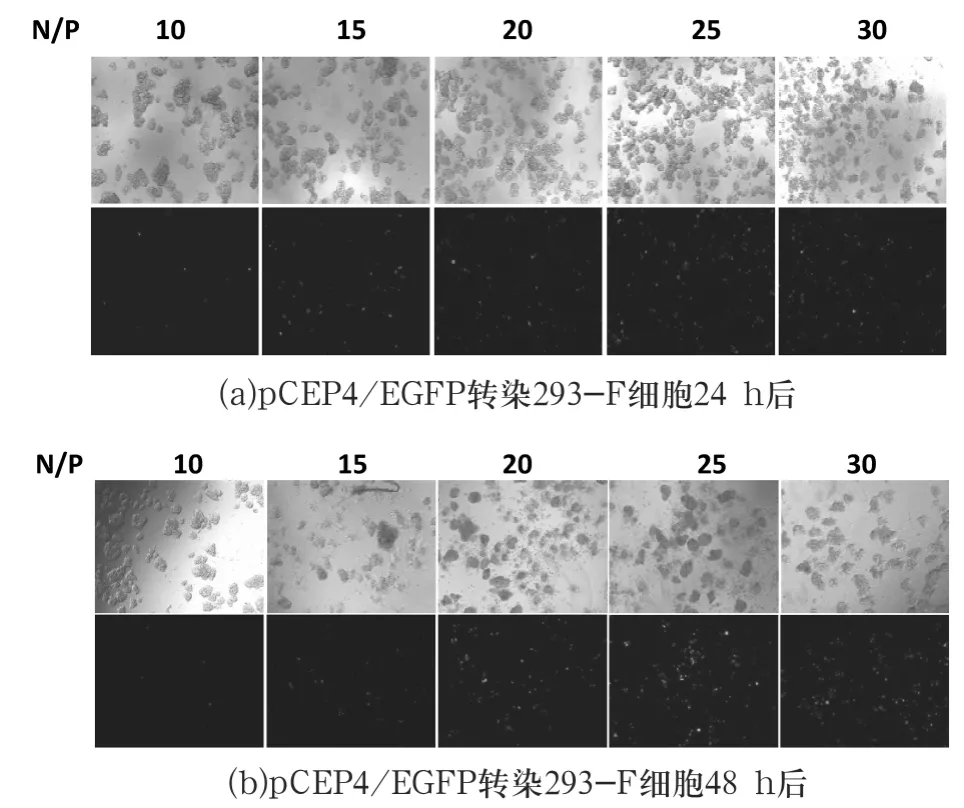
图3 倒置荧光显微镜观察(×50)
2.3.2 悬浮培养.
悬浮培养排除细胞结团对转染的影响,当N/P为25,转染48 h 后,绿色荧光蛋白表达情况如图4所示.利用流式细胞术检测pCEP4/EGFP 的转染效率为77.57%,结果如图5 所示.

图4 正置荧光显微镜观察(×50)
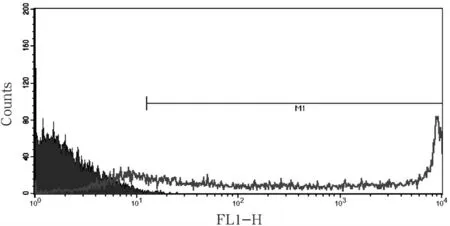
图5 流式细胞术检测绿色荧光蛋白的表达
3 结 论
基因瞬时转染技术作为一种快捷方便获取重组蛋白的方法,可用于筛选大量蛋白候选药物.PEI 介导的基因瞬时转染效率取决于孵育得到的DNA/PEI 复合物的结构、粒径和表面电荷等因素以及细胞与复合物发生相互作用的过程.在转染条件选择上,主要考虑DNA 的用量,PEI 与DNA 的比例(N/P)[6],DNA 与PEI 混合孵育的介质、孵育时间以及转染时间、细胞密度[7-10].本研究以EGFP 为报告基因,探讨了真核表达载体pCEP4 转染293-F 细胞的条件,DNA 用量为1 μg/mL,N/P 为25,混合时使用1640 培养液,室温孵育10 min,转染前24 h 细胞以8 ×106~9 ×106cells/mL 的密度传代,转染时细胞密度为1.5 ×106cells/mL,同时保证细胞活力达到90%以上,可获得较为理想的转染效果.
[1]Aggarwal R S.What's fueling the biotech engine—2012 to 2013[J].Nat Biotechnol,2014,32(1):32-39.
[2]Huh S H,Do H J,Lim H Y,et al.Optimization of 25kDa linear polyethylenimine for efficient gene delivery[J].Biologicals,2007,35(3):165-171.
[3]Godbey W T,Wu K K,Mikos A G.Tracking the intracellular path of poly(ethylenimine)/DNA complexes for gene delivery[J].Proc Nati Acad Sci USA,1999,96(9):5177-5181.
[4]Longo P A,Kavran J M,Kim M S,et al.Transient mammalian cell transfection with polyethylenimine(PEI)[J].Methods Enzymol,2013,529(1):227-240.
[5]Parham J H,Kost T,Hutchins J T.Effects of pCIneo and pCEP4 expression vectors on transient and stable protein production in human and simian cell lines[J].Cytotechnology,2001,35(3):181-187.
[6]曾静,王津京,刘然,等.靶向CD20 和HLA-DR 分子Crossmab 的设计与构建表达[J].标记免疫分析与临床,2014,21(5):557-563.
[7]Raymond C,Tom R,Perret S,et al.A simplified polyethylenimine-mediated transfection process for large-scale and highthroughput applications[J].Methods,2011,55(1):44-51.
[8]Liu C,Dalby B,Chen W,et al.Transient transfection factors for high-level recombinant protein production in suspension cultured mammalian cells[J].Mol Biotechnol,2008,39(2):141-153.
[9]Zhang C B,Cao H L,Li Q,et al.Enhancement effect of ultrasound-induced microbubble cavitation on branched polyethylenimine-mediated VEGF(165)transfection with varied N/P ratio[J].Ultrasound Med Biol,2013,39(1):161-171.
[10]Fliedl L,Kaisermayer C.Transient gene expression in HEK293 and vero cells immobilised on microcarriers[J].J Biotechnol,2011,153(1-2):15-21.
