硫化氢对心室肌细胞触发活动及L型钙通道的影响*
2015-07-24刘慧霞
刘慧霞
(菏泽医学专科学校生理学教研室,山东菏泽274030)
硫化氢对心室肌细胞触发活动及L型钙通道的影响*
刘慧霞
(菏泽医学专科学校生理学教研室,山东菏泽274030)
目的研究硫化氢(H2S)对哇巴因诱发的触发性心律失常及L型钙通道的作用,探讨硫化氢抗心律失常的机制。方法运用全细胞膜片钳技术,记录L型钙通道电流,观察硫化氢对单个心室肌细胞L型钙通道各参数的影响。结果H2S抑制哇巴因诱发的迟后去极化(DAD)及触发活动(TA),50,100和200 μmol/L硫氢化钠(H2S的供体)使ICa-L的峰值降低,浓度依赖性的使I-V曲线上移,峰值由(-13.9±1.4)pA/pF分别至(-10.7±1.4)pA/pF(n=6,P<0.05)、(-7.4±2.5)pA/pF(P<0.01)和(-5.3±1.1)pA/pF(P<0.01),H2S使稳态激活曲线右移,而不影响稳态失活曲线。结论H2S通过对L型钙通道的抑制而发挥抗心律失常作用。
硫化氢;钙通道;心律失常
心律失常是临床上常见的心血管疾病,且对患者的生活质量和生命影响极大。治疗和预防心律失常的药物成为人们长期关注的研究热点[1]。由后除极引起的触发活动是心律失常的重要发病机制之一。触发活动致心律失常的根本原因在于紊乱的离子流扰乱了心肌除复极的同步性[2]。
H2S是继一氧化氮(NO)和一氧化碳(CO)之后的第三种新型内源性气体信号分子[3]。H2S在心血管系统中发挥着非常重要的作用,参与低氧性肺动脉高压、高血压、冠心病、动脉粥样硬化、心肌缺血再灌注损伤等诸多心血管疾病的发病与转归[4],然而目前,H2S对心律失常方面的研究较少。
哇巴因是经典的心律失常模型药,前期的实验证实硫化氢对哇巴因诱发的豚鼠心肌迟后去极化与触发活动有确切的抑制作用,亦具有明显剂量依赖性,且该效应可被L钙通道开放剂BayK8644完全阻断[5],但其对离子通道的作用未充分阐明。L型钙通道调节的失衡将会导致致命的心脏疾病,因此对L型钙通道调节的研究有利于某些心脏疾病的预防与治疗。本研究从L型钙通道角度,运用全细胞膜片钳技术研究硫化氢对L钙通道电流及动力学过程的作用,这为H2S的抗心律失常的作用提供了电生理学基础。
1 材料与方法
1.1实验动物动物SD大鼠(北京维通利华实验动物技术有限公司提供),雄性,200~300 g。
1.2主要仪器Langendorff灌流装置(成都仪器厂),X71倒置显微镜(Olympus公司),MP285微操作器(Sutter Instrument公司),P97微电极拉制器(Sutter Instrument公司),Digidata1440A数模转换器(Axon公司),Axopatch 200B膜片钳放大器(Axon公司)。
1.3试剂硫氢化钠(NaHS)、Ⅱ型胶原酶(collagenase typeⅡ)、哇巴因(Ouabain)均来自Sigma公司;其余均为国产分析纯。硫氢化钠溶液需现用现配以免H2S挥发,哇巴因配制成母液,冷藏保存,用时稀释;Ⅱ型胶原酶2.0mg/ml,用K-H液溶于小瓶内。
1.4溶液①无钙K-H液(mmol/L):NaCl 118.0,MgSO4·7H2O 1.6,KCl 4.7,KH2PO41.2,NaHCO325.0,Glucose 11.1。正常K-H液(mmol/L):CaCl22.5,其他同上。蒸馏水配制,调pH至7.38±0.03。②KB保存液(mmol/L):KOH 90,L-glutamic acid 70,Taurine 20,KCl 30,KH2PO410,HEPES 10,Glucose 10,EGTA 0.5,调pH至7.33。③记录L钙通道电流的细胞外液(mmol/L):NaCl 137.0,KCl 5.0,NaH2PO4 0.5,CaCl21.2,MgSO41.2,glucose 10.0、HEPES 10.0(用NaOH调定pH至7.33~7.39)。④记录L钙通道电流的细胞内液(mmol/L):NaCl 10.0,KCl 125.0,CaCl21.0,EGTA 14.0,HEPES 10.0,MgATP 1.0(用KOH调pH至7.2左右)。
1.5实验分组①空白对照组,②NaHS(50 μmol/ L)组,③NaHS(100 μmol/L)组,④NaHS(200 μmol/L)组,每组6只。
1.6心肌细胞的急性分离大鼠用10%水合氯醛溶液麻醉后,仰卧固定在鼠台上,迅速从剑突下打开胸腔,取出心脏,暴露主动脉,去除脂肪及结缔组织,立即置于95%O2+5%CO24℃氧饱和的K-H液中,与Langendorff灌流装置连接,对心脏进行恒温(37 ±0.3)℃恒压逆行灌流,灌流液均用95%O2+5% CO2饱和。先用无钙K-H液灌流5 min,待心脏停止跳动后,去除冠脉及心脏内残血,再用含Ⅱ型胶原酶的K-H液灌流,当心脏流出液变黏稠,呈海绵状、心肌的颜色变浅变透明,表示可以终止酶消化,此时将心脏自左心室分段取心室肌组织,剪下左心室部分的少许心肌组织,置于装有KB液的试管中剪碎,用粗口吸管轻轻反复吹打,使细胞团分散,孵化10 min,然后用200目细尼龙网过滤,收集到心室肌细胞悬液,直接放入4℃冰箱下冷藏2小时备用。
1.7膜片钳全细胞记录应用全细胞膜片钳技术记录单个细胞离子电流。电流信号经Ag/AgCl电极引导,膜片钳AXON 200B放大器、数-模转换器及Pclampex10.0采集、贮存及分析。取细胞悬液滴入置于倒置显微镜工作台上的灌流槽中,待细胞贴壁后使用室温细胞外液灌流冲洗,选取无自主收缩,边缘整齐,横纹清晰,贴壁牢固,形态规整的细胞进行实验。玻璃微电极由两步拉制而成,电极电阻为3~5MΩ,通过三维操纵仪驱动电极,给予适当负压吸引,待高阻封接形成后,然后继续负压吸破细胞膜,进行电极电容补偿。分别将各组药物加入灌流槽中,待作用10~15min后进行电流记录,K-H灌流液持续充氧。
1.8数据处理分析实验所得数据结果以±s表示,采用SPSS19.0软件对数据进行统计学分析,给药前后采用配对t检验,以P≤0.05认为具有统计学意义。
2 结果
2.1硫化氢对心室肌迟后去极化(DAD)及触发活动(TA)的影响NaHS(50、100、200 μmol/L)均能使DAD的潜伏期延长,幅度降低,时程缩短DAD,TA的发生率降低,且存在剂量依赖性(图1,表1)。
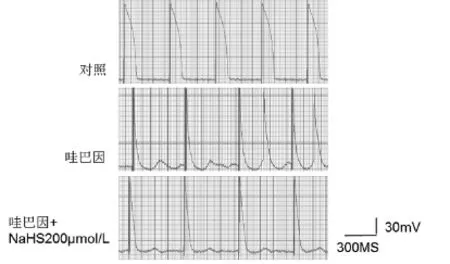
图1 NaHS对哇巴因诱发的豚鼠乳头肌DAD和TA的影响
2.2NaHS对L-型钙通道(ICa-L)峰值电流及电流-电压(I-V)关系的影响细胞保持电压固定于-50 mV,步阶测试电压从-40 mV开始,以10 mV为步阶至+50 mV,频率为0.1 HZ,步阶脉冲宽度为350 ms,测定各指令电压下去极化电流峰值,并获得ICa-LI-V曲线,200 μmol/L硫氢化钠能够抑制ICa-L峰值。ICa-L在-30 mV时激活,0 mV电位时出现峰值。50,100和200 μmol/L硫氢化钠浓度依赖性的使I-V曲线上移,峰值由(-13.9±1.4)pA/pF分别至(-10.7±1.4)pA/pF(n=6,P<0.05),(-7.4±2.5) pA/pF(P<0.01)和(-5.3±1.1)pA/pF(P<0.01)(图2)。
2.3NaHS对ICa-L稳态激活曲线的影响在-50 mV保持电位至+50 mV测试电位范围内,阶跃为10 mV,脉冲频率0.1 Hz,脉冲去极化350 ms,ICa-L激活曲线呈稳定状态。数据以Boltzmann方程I/Imax= 1/{1+EXP[(V-V0.5)/K]}(V0.5代表半激活电压,K代表斜率参数)拟合,激活曲线成立。200μmol/LNaHS使半激活电压由(-19.5±0.3)mV变至(-15.5±3.8)mV,斜率参数K由(5.5±0.7) mV变至(3.7±0.8)mV(n=6,P<0.05)(图3)。
表1 NaHS对哇巴因诱发的DAD和TA的影响(±s)

表1 NaHS对哇巴因诱发的DAD和TA的影响(±s)
注:与哇巴因组比较,P<0.05,P<0.01,P<0.001;与哇巴因+NaHS(50 μmol/L)组比较,P<0.05,P<0.01;P<0.05,与哇巴因+NaHS (100 μmol/L)组比较,++P<0.01。
?

图2 NaHS对L-型钙通道(ICa-L)峰值电流及电流-电压(I-V)关系的影响

图3 NaHS对ICa-L稳态激活曲线的影响
2.4NaHS对ICa-L稳态失活曲线的影响采用双脉冲刺激法测量L-型钙通道稳态失活,频率为0.1 Hz,膜电位为-50 mV至+20 mV,阶跃为10 mV,时长1000 ms,再至+10 mV(测试脉冲),时长400 ms,最后回至保持电位-50 mV。测试脉冲引起的峰值电流被最大电流归一化,条件电位为纵坐标,峰值电流为横坐标,以Boltzmann方程进行激活失活曲线拟合,200 μmol/LNaHS使半激活电压由(-29.9± 2.4)mV变至(-31.1±3.7)mV,斜率参数K由(6.2±1.7)mV变至(6.9±3.5)mV(P>0.05)(图4)。
3 讨论
自律性增高、折返及后除极引起的触发活动(triggerd activity,TA),是心律失常发生的主要原因。触发活动根据其时相特征分为早后去极化(early afterdepolarization,EAD)和迟后去极化(delayed afterdepolarization,DAD)两种类型。心肌局部儿茶酚胺浓度增高、心肌缺血再灌注、低血钾、高血钙、洋地黄中毒等均可导致触发性心律失常[6],现已证实,触发活动是尖端扭转型室速、长QT间期综合征、再灌注心律失常等异位心室搏动发生的重要机制。在不同电压条件下细胞膜上许多离子通道激活、失活的综合效应形成心肌细胞动作电位,任何离子通道的异常均可通过影响动作电位的形态,导致心律失常的发生。

图4 NaHS对ICa-L稳态失活曲线的影响
外源性H2S的主要供体是硫化钠(Na2S)、硫氢化钠(NaHS)或硫代硫酸钠(Na2S2O3)等,NaHS可分解为Na2S和H2S,本实验应用硫氢化钠作为H2S的供体,研究H2S的抗心律失常作用。H2S广泛存在于机体组织器官中,但最主要是由脑、心血管、肝、肾器官产生。目前人们发现H2S不但可以在体内内源性的生成,而且还发挥着重要的生物学作用[7]。内源性硫化氢是由L-半胱氨酸在胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE),和磷酸吡哚醛-5'-磷酸依赖性酶,即胱硫醚-β-合成酶(cystathionie-β-sythase,CBS)催化作用下生成的[8]。内源性H2S在心血管系统主要是通过CSE催化生成。内源性硫化氢参与体内许多病理生理过程,尤其是在心血管系统发挥着重要的作用[9]。H2S被认为是一重要的气体信号分子,具有明显的心肌保护作用。关于其对心脏的保护作用,人们已在多种心肌损伤模型中进行了研究[10]。
许多药物可引起心律失常,常用的有乌头碱、哇巴因、氯化钡、异丙肾上腺素、乙酰胆碱等,本实验采用的是哇巴因。哇巴因是从夹竹桃科植物苦毒毛旋花种子中提取,是一种快速短效强效的强心甙药物,长期以来人们将心肌组织暴露于含哇巴因(ouabain)的高钙灌流液中作为诱发迟后去极化的经典方法之一。触发性心律失常发生的主要原因是细胞内Ca2+浓度的异常增加[12],在本实验中,哇巴因可通过抑制Na+,K+-ATP酶使钠泵失活,胞内Na+增加,进一步激活Na+-Ca2+交换机制,促进Ca2+内流,肌浆网Ca2+摄取储存增加,而导致细胞内Ca2+超载[11];同时还可能直接激活细胞膜Ca2+通道,促进Ca2+内流使细胞内Ca2+浓度升高,导致振荡性后电位而引起异位节律,诱发快速型心律失常[13]。
心肌细胞中主要存在T型和L型两种钙离子通道[14]。L型钙离子通道是主要的心肌细胞质钙离子进入途径,在心肌细胞动作电位产生机制中起着重要的作用,钙离子是参与心肌细胞动作电位2期的主要离子,为一内向电流,ICa-L增加可延长动作电位时程,使平台期的电位水平升高,在快反应细胞心室肌,Ca2+内流增多将使心肌细胞的自律性提高,引起早期后去极化(EAD)和延迟后去极化(DAD),有效不应期缩短,折返激动形成,从而导致触发性心律失常的发生。因此,L型钙通道的结构和功能紊乱是引起心律失常的主要原因。L型钙通道是多种激素、神经递质及药物的作用靶点[15]。
本实验保持电位-50mV,这样的目的是排除T型Ca2+通道的干扰,研究显示,硫氢化钠(H2S的供体)可以使ICa-L的峰值降低,并使I-V曲线上移,且具有浓度依赖性,硫氢化钠使稳态激活曲线右移,而不影响稳态失活曲线,结果显示H2S能抑制Ca2+通道的稳态激活,表明硫化氢对于ICa-L具有抑制作用。硫化氢通过抑制心肌细胞膜上的Ca2+通道电流,通过减少Ca2+内流以及细胞内Ca2+超载,从而有效避免DAD的发生,这也可能是其抗心律失常的机制之一。H2S还可能通过抑制心肌细胞膜上的L型钙通道激活,从而降低Ca2+内流,并减少mPTP的开放,从而防止因Ca2+超载所致的线粒体损伤[16]。
综上所述,本研究结果提示硫化氢对心肌ICa-L有抑制作用,该研究为发现H2S的抗心律失常作用提供细胞电生理学基础,具有重要的临床意义。
[1]Zhang YJ,Duan HR,Wang YL,et al.Electro-physiologic effect of dipfluzine on human atrial fibers[J].Chin J Pharmacol Toxicol,2000,14:8-11.
[2]Neuyen TP,Qu Z,Weiss JN.Cardiac fibrosis and arrhy thmogenesis:The road to repair is paved with Perils[J].J Mol Cell Carrlinl,2014,70:83-91.
[3]Wang R.Two's company,three's a crowd:can H2S be the third endogenous gaseous transmitter?[J].FASEB J,2002,16(13): 1792-1798.
[4]张巧丽,杜军保.气体信号分子硫化氢与心血管疾病研究进展[J].实用儿科临床杂志,2010,25(1):63-65.
[5]刘慧霞,许萌,郭琪,等.硫化氢对哇巴因诱发的豚鼠乳头肌迟后去极化及触发活动的影响[J].中华医学杂志,2011,91(43) 3050-3053.
[6]丁绍祥.触发活动致心律失常发生机制的探讨[J].中国循环杂志,2015,30(4):407-409.PH
[7]耿彬,杜军保,唐朝枢.内源性H2S-一种新的气体信号分子[J].生理科学进展,2002,33(2):255-258.
[8]何松坚,吴铿,游琼,等.气体信号分子硫化氢对冠心病的保护作用机制及相关性研究[J].中西医结合心脑血管病杂志,2015,13(3):298-301.
[9]Sivarajah A,Collino M,Yasin M,et al.Anti-apoptotic and anti-inflammatory effects of hydrogen sulfide ina rat model of regional myocardial I/R[J].Shock,2009,31(3):267-74.
[10]吴玉玲,马继春,王兴程,等.外源性硫化氢对合并高血糖的大鼠心肌缺血再灌注损伤后的作用[J].临床心血管病杂志,2015,31(4):451-454.
[11]Vassalle M,Lee CO.The relationship among intracellular sodium activity,caleium,and strophanthidin inotropy in canine cardiac Purkinje fibers[J].J Gen Physiol,1984,83:287-307.
[12]刘慧霞,武宇明.触发活动与触发性心律失常的研究进展[J].中国医药,2013,8(11):1665-1667.
[13]龚冬梅,单宏丽,董德利,等.哇巴因诱发大鼠心律失常作用靶点的研究[J].哈尔滨医科大学学报,2002,36:872.
[14]郭雄,李妙龄,刘兴隆,等.附子含药血清对大鼠心室肌细胞L型钙通道的影响[J].中国实验方剂学杂志,2015,21(11): 111-115.
[15]孙宇,胡慧媛.心肌L型钙通道钙依赖性调节研究新进展[J].生理科学进展,2013,44(5):372-376.
[16]King AL,Lefer DJ.Cytoprotective actions of hydrogensulfide in ischaemia-reperfusion injury[J].Exp Physiol,2011,96(9):840-846.
Effects of hydrogen sulfide on arrhythmias induced
by ouabain and L-type calcium channel of myocardial cell
LIU Hui-xia
(Dept.of Physiology,Heze Medical College,Heze 274030,China)
Objective:To investigate effects of hydrogen sulfide(H2S)on arrhythmias induced by ouabain and L-type calcium channel of myocardial cell.Methods:The whole-cell patch clamp technique was applied to record the current of L-type calcium channel and observe the effects on arrhythmias induced by ouabain and L-type calcium channel of single arrhythmic ventricular cell.Results:H2S showed protective function of inhibiting the delayed afterdepolarization(DAD)and triggerd activity(TA)induced by ouabain.The peak current of Ica-Lwas decreased from(-13.9±1.4)pA/pF to(-10.7±1.4)pA/pF(n=5,P<0.05),(-7.4±2.5)pA/pF(P<0.01)and(-5.3±1.1)pA/pF(P<0.01)by 50,100,200μmol sodium hydrosulfide(H2S donor)respectively,and I-V curve was shifted upward in a concentration-dependent manner.The steady state activation curve was shifted to the right by H2S while no effect on inactivation curve was shown.Conclusion:H2S shows anti-arrhythmic function through its effects on L-type calcium channel.
H2S;calcium channel;arrhythmias
R365
A文献标识码:1004-7115(2015)11-1201-04
10.3969/j.issn.1004-7115.2015.11.001
2015-03-18)
山东省高校科技计划资助项目(J12LE08)。
刘慧霞(1979—),女,硕士,副教授,研究方向:心血管病理生理。
