中华绒螯蟹蜕皮抑制激素多克隆抗体的制备及其表达分泌特征的组织学研究
2015-07-24张凤娟曹佳培王鹏穆淑梅康现江
张凤娟,曹佳培,王鹏,穆淑梅,康现江
(河北大学 生命科学学院,河北省动物系统学与应用重点实验室,河北 保定 071002)
中华绒螯蟹(Eriocheir sinensis)蜕皮抑制激素(molt-inhibiting-hormone,MIH)属于甲壳动物高血糖激素家族(crustacean hyperglycemic hormone family)神经肽.该家族的激素包括:高血糖激素(crustacean hy-perglycemic hormone,CHH)、蜕皮抑制激素、性腺抑制激素(gonad-inhibiting hormone,GIH)、大颚器抑制激素(mandibular organ-inhibiting hormone,MOIH).这些激素均包含6个半胱氨酸残基,形成3个链内二硫键.由于其结构相似,它们也具有交叉的生物学功能[1-4].这些激素产生于眼柄的端髓X 器(medulla terminalis X-organ,MT-XO)或无眼柄甲壳类前脑相应的位置,释放到窦腺,进入血淋巴系统,参与调节甲壳类许多重要的生理过程[5-6].
MIH 通过与蜕皮激素(ecdysone)相互作用调节甲壳动物蜕皮进程[7].以前的研究认为MIH 只在甲壳动物的眼柄视上神经节的X 器官中表达,但是具体在眼柄视上神经节的哪几种分泌细胞中表达尚且未知[8-9].据报道,X 器官中,小神经元细胞(直径15~25μm)产生促色素细胞激素,而大神经元细胞(直径30~70μm)产生高血糖家族激素[3,10].近年来研究发现,MIH 不仅在X 器官中有分布,而且在甲壳动物的中枢神经系统(胸神经节、腹神经节和脑)中也存在,但与眼柄中的MIH 相比,可能在中枢神经系统中的MIH 发挥不同的作用[3,11].
本实验利用分子生物学与免疫组织化学技术,对中华绒螯蟹MIH 进行系统的研究,并对其在视上神经节的分泌情况进行了具体的研究,可以为进一步研究其作用机制奠定基础.
1 材料与方法
1.1 材料
实验用中华绒螯蟹购自河北省白洋淀;新西兰大白兔由河北大学实验中心提供;pET-30a载体(TaKa-Ra)、表达菌株大肠杆菌Rosseta(DE3)为本实验室保存.
1.2 方法
1.2.1 中华绒螯蟹MIH 蛋白的表达与纯化
按照姚燕等[12]的研究方法获得中华绒螯蟹的MIH 基因,并构建表达载体,构建好的表达载体命名为pET-30a-MIH.
将pET-30a-MIH 质粒导入大肠杆菌Rosseta(DE3)感受态细胞,37 ℃,200r/min振荡培养至OD600为0.6左右时,用0.5mmol/L IPTG 诱导表达4h,超声破碎后,离心收集沉淀,用8mol/L 的尿素溶解2h,12 000r/min 4 ℃离心20 min,取其上清液用镍柱进行纯化,纯化后的蛋白用体积分数为12%的SDSPAGE检测.
1.2.2 多克隆抗体的制备及特异性检测
按照常规方法制备兔抗多克隆抗体,在注射蛋白时,每次注射抗原2.0mg,间隔7~10d,注射4次;获得免疫血清.利用双向免疫扩散法检测抗体效价.用western blot法对血清的特异性进行检测,其中实验组以融合蛋白为抗原,以MIH 抗血清为一抗,而对照组以免疫前血清代替一抗,具体操作步骤按常规western blot法进行.
1.2.3 MIH 在视上神经节分布的免疫组织化学研究
解剖处于蜕皮间期的中华绒螯蟹眼柄置于布氏固定液(未加冰醋酸)中,4 ℃固定过夜,梯度脱水,常规石蜡包埋,进行连续切片,切片厚度为6μm,50 ℃烤片;常规脱蜡至水,用体积分数为3%的H2O2处理7~10min,以灭活内源性过氧化物酶.蒸馏水浸泡冲洗.用柠檬酸缓冲液(pH 6.0),采用微波修复法修复抗原.用质量分数为5%的BSA 室温孵育30min.一抗(MIH 抗血清)4 ℃过夜孵育,对照组用PBS代替一抗进行孵育.PBS浸洗3次,每次5min,在样品上滴加抗兔生物素化二抗,37 ℃孵育20min,PBS洗掉二抗.加上SABC 37 ℃孵育20min,PBS冲洗SABC.滴加DAB显色液,自来水冲洗,苏木精复染,梯度脱水至二甲苯,中性树胶封片.显微观察拍照.
2 结果
2.1 MIH 基因克隆结果
质量分数为1%的琼脂糖凝胶电泳检测结果在250bp处有特异性条带(图1),与预期大小(243bp)相符合.测序发现该片段与中华绒螯蟹蜕皮抑制激素成熟肽序列一致.
2.2 pET-30a-MIH 质粒双酶切鉴定结果
构建好的PET-30a-MIH 经BamHⅠ和HindⅢ双酶切,琼脂糖凝胶电泳检测在250bp处有目的条带(图2),表明表达载体构建成功且读码框正确.
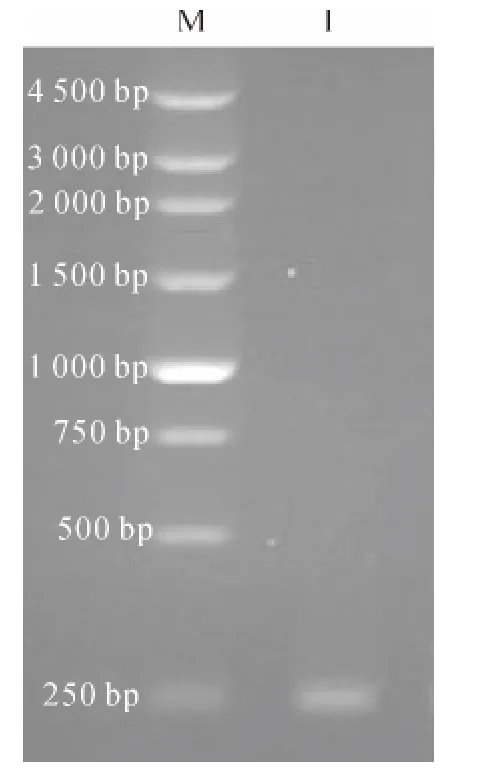
图1 MIH 基因克隆结果Fig.1 Result of MIH cloning
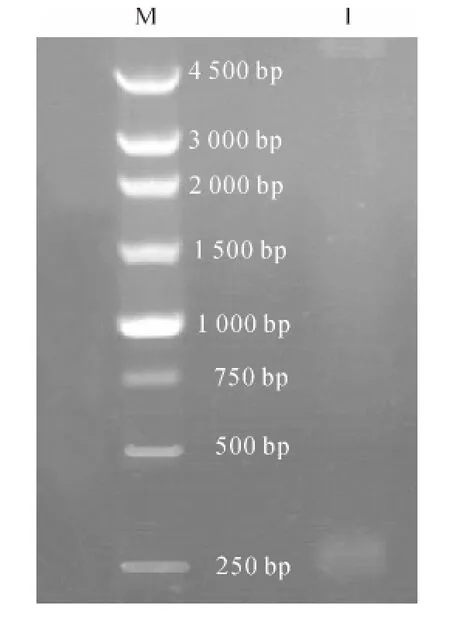
图2 重组质粒PET-30a-MIH 双酶切电泳结果Fig.2 Enzyme digestion result of PET-30a-MIH recombinant plasmid
2.3 融合蛋白的表达与纯化
将带有pET-30a-MIH 质粒的表达菌株Rosseta(DE3)经诱导后用体积分数为12%的SDS-PAGE 电泳检测,在14.3ku与20.1ku之间有一特异条带(图3).SDS-PAGE检测融合蛋白主要以包涵体形式存在于沉淀中,溶解后的包涵体蛋白用镍柱进行纯化,得到较高纯度的目的蛋白(图4).
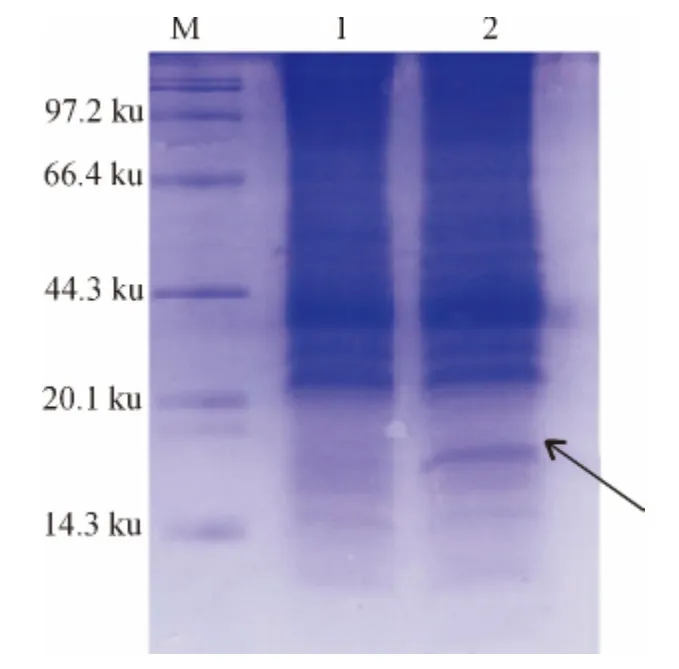
图3 融合蛋白在大肠杆菌中的表达Fig.3 Expression of fusion protein in E.coli
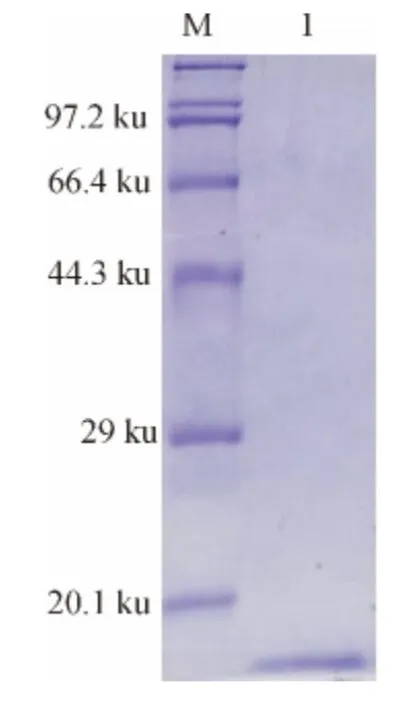
图4 融合蛋白镍柱纯化结果Fig.4 Purification of fusion protein using Ni-Resin
2.4 多克隆抗体效价及特异性的检测
多克隆抗体经双向免疫扩散测定其效价为1:32(图5).用MIH 抗血清对融合蛋白进行免疫印迹分析,在14.3~20.1ku内有1特异条带,而对照组没有,表明其特异性较高(图6).
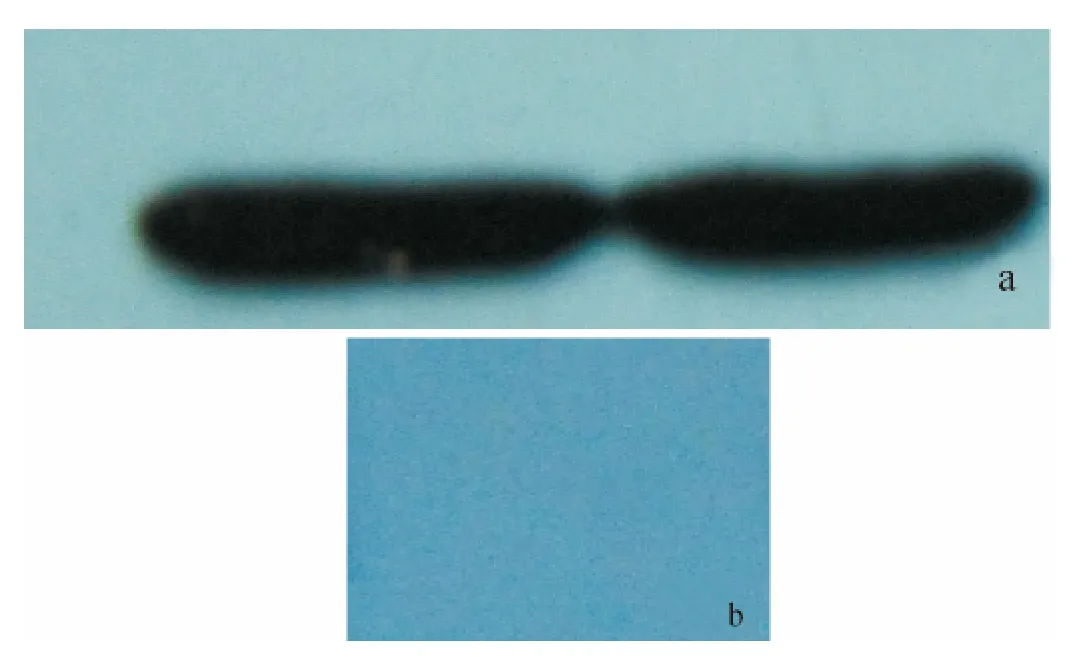
图6 融合蛋白western blot结果Fig.6 Western blot result of the fusion protein
2.5 MIH 在视上神经节的免疫组织化学定位
康现江等[13]将中华绒螯蟹视上神经节分泌细胞分为5种类型,本实验发现端髓中的细胞类型1(ct)、细胞类型3(ct3)和细胞类型4(ct4)的核周围呈阳性反应,这表明ct1,ct3,ct4参与了MIH 的分泌(图7).而阴性对照中均无阳性反应.
端髓中的ct1细胞核周围呈现阳性反应,由于MIH 在视上神经节中的合成和储存量很低,所以并不是所有的ct1细胞核周围均呈阳性反应(图7a).ct3细胞核周围呈现阳性反应,由于切片方向不同,所以细胞核没有完全呈现,但是依据其位置和核大小确定其为ct3(图7a).ct4周围呈阳性反应,故其也参与了MIH的分泌(图7c).
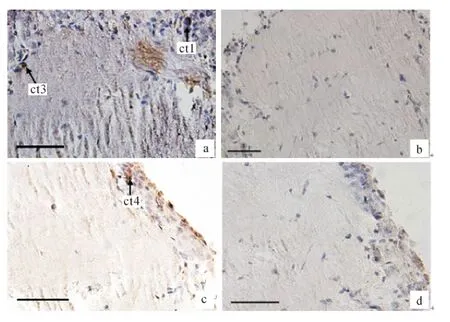
图7 端髓中分泌MIH 的细胞免疫阳性反应(bar=50μm)Fig.7 Immune positive reaction of cells in medulla terminalia
在中华绒螯蟹视上神经节的端髓与内髓交界处发现ct2细胞核周围呈现阳性反应(图8a),同时在窦腺(SG)处也呈现免疫阳性反应(图8c).
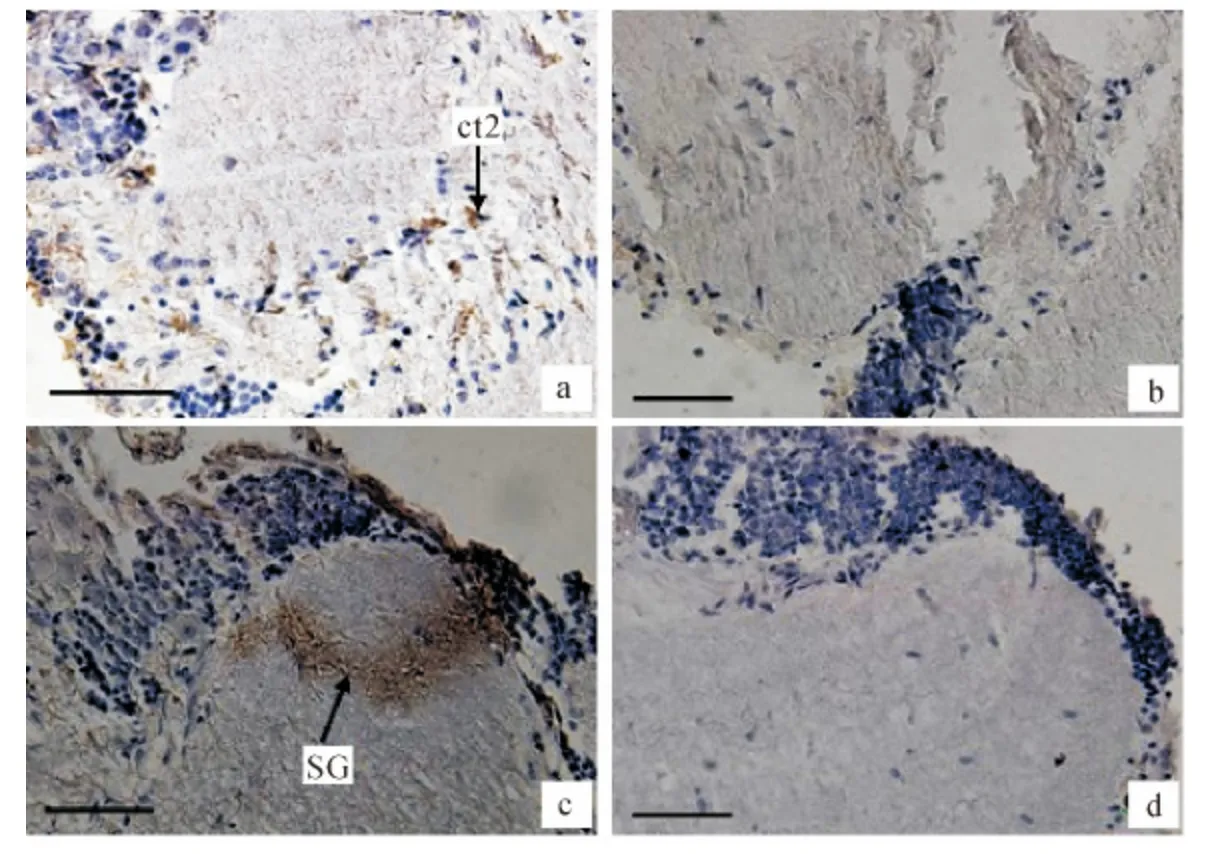
图8 端髓与内髓交界及窦腺免疫阳性反应Fig.8 Immune positive reaction in SG and the edge of medulla terminalia
3 讨论
中华绒螯蟹视上神经节由外髓、内髓和端髓组成,神经分泌细胞主要集中分布在端髓,端髓在视神经节中体积最大,有大量神经分泌细胞分布.窦腺位于端髓与内髓交界偏端髓处,由神经分泌细胞轴突末端聚集而成,神经分泌细胞分泌的激素可暂时储存于此,之后排出运输至血液.中华绒螯蟹MIH 由眼柄视上神经节中的X-器官分泌,与蜕皮激素共同调节着中华绒螯蟹的蜕皮周期[14-18].中华绒螯蟹MIH 基因成熟肽编码区含有228bp,编码75个氨基酸残基[19],姚燕等[12]制备了中华绒螯蟹MIH 鼠抗抗体,并对抗体进行了效价的检测,但并未进行后续实验的研究.
康现江等[13]将中华绒螯蟹视上神经节分泌细胞分为5种类型,在本实验中,除细胞类型5之外,其他类型的细胞均具有阳性反应,证明细胞类型1、细胞类型2、细胞类型3和细胞类型4均参与了MIH 的分泌.MIH 在端髓细胞中分布,此结果与不同物种中MIH 的分泌位置的研究一致[20-21].Gu等[22]研究发现,刀额新对虾(Metapenaeus ensis)中,MIH 在眼柄的分泌位置是端髓X-器官,但是,在其他中枢神经系统中,例如胸神经节、腹神经节中均无MIH 分泌.然而,在远海梭子蟹(Portunus pelagicus)中,MIH 不仅分布于眼柄中,在胸神经节、腹神经节等中枢神经系统中也有分布[3].而在中华绒螯蟹中,除了眼柄以外的中枢神经系统是否分泌MIH 还不得而知,这也是今后的研究目标.在实验过程中发现,在没有细胞核分布的区域也有呈现阳性反应的,有可能是MIH 经这些分泌细胞的轴突或结缔组织被运往窦腺暂时储存或释放.此结果与Stewart等的研究结果相符[3].
本实验研究了MIH 在眼柄中的分泌位置,为甲壳动物内分泌的研究提供新的资料,同时为解决虾蟹类的早熟问题提供参考.
[1] NAKATSUJI T,LEE C Y ,WATSON R D.Crustacean molt-inhibiting hormone:structure,function,and cellular mode of action[J].Comp Biochem Phy A,2009,152(2):139-148.
[2] WEBSTER S G,KELLER R,DIRCKSEN H.The CHH-superfamily of multifunctional peptide hormones controlling crustacean metabolism,osmoregulation,moulting,and reproduction[J].Gen Comp Endocr,2012,175(2):217-233.
[3] STEWART M J,STEWART P,SROYRAYA M.Cloning of the crustacean hyperglycemic hormone and evidence for molt-inhibiting hormone within the central nervous system of the blue crab Portunus pelagicus[J].Comp Biochem Physiol A Mol Integr Physiol,2013,164(2):276-290.
[4] 焦满静,曹佳培,陈勤娜,等.莠去津对中华绒螯蟹蜕皮激素分泌的影响[J].河北大学学报:自然科学版,2013,33(2):181-184. JIAO Manjing,CAO Jiapei,CHEN Qinna,et al.Effects of atrazine on ecdyson secretion in Eriocheir sinensis[J].Journal of Hebei University:Natural Science Edition,2013,33(2):181-184.
[5] COVI J A,CHANG E S,MYKLES D L.Conserved role of cyclic nucleotides in the regulation of ecdysteroidogenesis by the crustacean molting gland[J].Comp Biochem Physiol A Mol Integr Physiol,2009,152(4):470-477.
[6] MYKLES D L,ADAMS M E,GADE G,et al.Neuropeptide action in insects and Crustaceans[J].Physiol Biochem Zool,2010,83(5):836-846.
[7] 康现江,温秀荣,穆淑梅,等.中华绒螯蟹高血糖素的分离及其功能初探[J].河北大学学报:自然科学版,2007,27(1):68-73.KANG Xianjiang,WEN Xiurong,MU Shumei,et al.Extraction and function of hyperglycemic hormone in Eriocheir sinensis[J].Journal of Hebei University:Natural Science Edition,2007,27(1):68-73.
[8] SKINNER D M.Molting and regeneration[J].The Biology of Crustacea,1985,9(43):144-146.
[9] HOPKONS P M.The eyes have it:a brief history of crustacean neuroendocrinology[J].Gen Comp Endocrinol,2012,175:357-366.
[10] LEE K J,WATSON R D.Antipeptide antibodies for detecting crab(Callinectes sapidus)molt-inhibiting hormone[J].Peptides,2002,23:853-862.
[11] YODMUANG S,UDOMKIT A,TREETRATTRAKOOL S,et al.Molecular and biological characterization of molt-inhibiting hormone of Penaeus monodon[J].J Exp Mar Biol Ecol,2004,312:101-114.
[12] 姚燕,周开亚,宋大祥.中华绒螯蟹蜕皮抑制激素基因的表达及抗体制备[J].动物学报,2006,52(1):209-214.YAO Yan,ZHOU Kaiya,SONG Daxiang.Expression and polyclonal antibody preparation of molt inhibiting hormone 1(MIH l)from the mitten crab(Eriocheir sinensis)[J].Acta Zoologica Sinica,2006,52(1):209-214.
[13] 康现江,米娅,孙辉建,等.中华绒鳌蟹眼柄神经内分泌结构的研究Ⅰ.神经分泌细胞的种类与分布[C]∥动物学专辑—上海市动物学会1997年会议论文集.上海:华东师范大学出版社,1998:22-26.
[14] CHAN S M,GU P L,CHU K H,et al.Crustacean neuropeptide genes of the CHH/MIH/GIH family:implications from molecular studies[J].Gen Comp Endocr,2003,134(3):214-219.
[15] REDDY P R,REDDY P S.Isolation of peptide hormones with pleiotropic activities in the freshwater crab[J].Aquaculture,2006,259(1):424-431.
[16] GU P L,YU K L,CHAN S M.Molecular characterization of an additional shrimp hyperglycemic hormone:cDNA cloning,gene organization,expression and biological assay of recombinant proteins[J].FEBS letters,2000,472(1):122-128.
[17] TIU S CHAN S M.The use of recombinant protein and RNA interference approaches to study the reproductive functions of a gonad‐stimulating hormone from the shrimp Metapenaeus ensis[J].Febs Journal,2007,274(17):4385-4395.
[18] TSUTSUI N,OHIRA T,KAWAZOE I,et al.Purification of sinus gland peptides having vitellogenesis-inhibiting activity from the whiteleg shrimp Litopenaeus vannamei[J].Marine Biotechnology,2007,9(3):360-369.
[19] ZHANG Yichen,SUN Yan,LIU Yichen,et al.Molt-inhibiting hormone from Chinese mitten crab:Cloning,tissue expression and effects of recombinant peptide on ecdysteroid secretion of YOs[J].Gen Comp Endocr,2011,173(3):467-474.
[20] LEE K J,WATSON R D.Antipeptide antibodies for detecting crab(Callinectes sapidus)molt-inhibiting hormone[J].Peptides,2002,23(5):853-862.
[21] GU,P L,TOBE,S S,CHOW,B K,et al.Characterization of an additional molt inhibiting hormone-like neuropeptide from the shrimp(Metapenaeus ensis)[J].Peptides,2002,23(11):1875-1883.
[22] GU P L,CHU K H,CHAN S M.Bacterial expression of the shrimp molt-inhibiting hormone(MIH):antibody production,immunocytochemical study and biological assay[J].Cell Tissue Res,2001,303(1):129-136.
