酿酒酵母SH 003生物转化2-苯乙醇条件的优化
2015-07-23黄筱萍黄国昌刘兰熊大维张婷江西省科学院微生物研究所江西南昌330029
黄筱萍,黄国昌,刘兰,熊大维,张婷(江西省科学院微生物研究所,江西南昌330029)
酿酒酵母SH 003生物转化2-苯乙醇条件的优化
黄筱萍,黄国昌,刘兰,熊大维,张婷
(江西省科学院微生物研究所,江西南昌330029)
摘要:以L-苯丙氨酸为底物,利用酿酒酵母转化合成2-苯乙醇,对影响酿酒细胞转化的因素进行考察。确定酵母菌转化的菌龄,通过单因素和正交试验,优化转化培养基组成和培养条件。优化后的培养基组成:葡萄糖120 g/L,酵母粉5 g/L,L-苯丙氨酸8 g/L,MgSO40.2 g/L,KH2PO40.05mol/L,K2HPO40.05mol/L,28℃200 r/min培养转化24 h,2-苯乙醇产率达4.37g/L,比优化前提高30.1%。
关键词:2-苯乙醇;酿酒酵母;优化;生物转化
β-苯乙醇(β-phenylethanol,2-PE)亦称2-苯乙醇,具有柔和、愉快而持久的玫瑰香气而广泛用于各种食用香精和烟用香精中。目前主要是通过有机合成或从天然物中萃取获得该产品。随着食品生物技术的飞速发展和人们越来越重视食品的安全性,追求有机食品、生态食品、绿色食品已成为一种时尚,国内外食品生产研发人员也越来越倾向于使用天然食品添加剂[1]。天然2-苯乙醇是通过玫瑰精油中提取获得,受到植物原料等因素影响,无法进行大规模工业生产,且价格昂贵[2]。由此,通过微生物发酵法生产天然苯乙醇香料的工艺研究得到国内外业内人士的广泛关注与重视。多种酵母具有合成2-苯乙醇的能力,如马克斯克鲁维酵母[3]、发酵毕赤酵母[4]、乳酸克鲁维酵母、酿酒酵母及异常汉逊酵母等[5],主要通过艾氏途径(Ehrlich pathway)合成2-苯乙醇,但通常产率较低,主要是严重的产物抑制成为酵母合成转化2-苯乙醇的瓶颈。EtschmannM[6]和崔志峰[7]分别报道了在优化的条件下单相分批发酵酵母菌株产2-苯乙醇达3.8 g/L和3.6 g/L,荣绍峰[8]筛选出一株酿酒酵母菌种,在优化的条件下2-苯乙醇含量达3.2 g/L,汪琨[9]等用5 L发酵罐小试生产2-苯乙醇,产量最高达4.1 g/L,梅建风[10]通过正交和响应面优化试验,在最优的培养条件下,2-苯乙醇产量达4.8 g/L,是至今摇瓶单批发酵产率最高的报道。因此筛选对2-苯乙醇耐受性好、转化率高的菌株成为国内外持续研究开发的关键。前期工作中,本实验室从葡萄园土壤中筛选获得一株对2-苯乙醇耐受性较高的菌株SH003,具有较好的生物转化合成2-苯乙醇能力,并鉴定为酿酒酵母。本试验通过单因子、正交试验,进一步优化转化条件,探讨各因素的影响水平,得到较优的培养基组成和转化条件。动相为甲醇∶水=1∶1(mL/mL),流速为1.0mL/min,检测波长260 nm,柱温30℃,进样量10μL。
1 材料与方法
1.1试验材料
1.1.1菌种
酿酒酵母SH003:由江西省科学院微生物研究室分离鉴定。
1.1.2培养基
斜面及保藏培养基:麦芽汁琼脂培养基。
种子培养基(g/L):葡萄糖30,蛋白胨5,酵母粉3,麦芽汁3。
基础转化培养基(g/L):葡萄糖100,酵母粉3,L-苯丙氨酸10,KH2PO45,MgSO40.2。
1.1.3主要试剂
L-苯丙氨酸:河北冀海生物科技有限公司,纯度99.5%;2-苯乙醇标准品:Sigma公司,纯度98.5%;甲醇:色谱纯;超纯水:自制;其他试剂均为国产分析纯。1.2主要设备
LC-20A高效液相色谱仪、1250紫外分光光度计:日本岛津公司;HC-C18反相色谱柱(250mm×4.6mm,5μm):美国Agilent公司;Prachtum 224-1CN分析天平:德国Sartorius公司。
1.3方法
1.3.1种子液制备
从斜面挑取1~2环菌苔至30 m L种子液中,于28℃、180 r/min培养24 h。
1.3.2转化培养
种子液按10%的接种量接种于含有L-苯丙氨酸转化培养液中,于28℃200 r/min培养24 h,转化液于10 000 r/min离心10min,上清液采用高效液相色谱法检测发酵液中的L-苯丙氨酸和2-苯乙醇含量。
1.3.3酵母细胞生物量的测定
菌体细胞OD600与菌体干重(DCW)的关系:转化液用纯水稀释15、20、25、30、40倍,以同样稀释度的未接种培养基为空白,用分光光度计测定波长600 nm处的OD值。取同样稀释度的转化液50m L于已称重量的离心管中,于8 000 r/min离心10min,用纯水洗2次,于100℃烘干至恒重,测菌体干重。获得菌体干重与OD600之间的线性曲线,通过测定菌体OD600计算菌体干重。
1.3.4反相高效液相色谱法测定L-苯丙氨酸和2-苯乙醇含量
发酵液经10 000 r/min离心10min,取上清液,稀释,用0.22μm聚醚水性滤膜过滤。于HPLC分析。流
2 结果与讨论
2.1酵母菌体干重与OD600的关系
按方法1.3.3,得图1,为酵母菌菌体干重与OD600间的关系曲线,呈良好的线性关系,可通过测定菌液的OD600获得菌体干重。2.2酿酒酵母SH003生长曲线和种龄对转化合成2-苯乙醇的影响
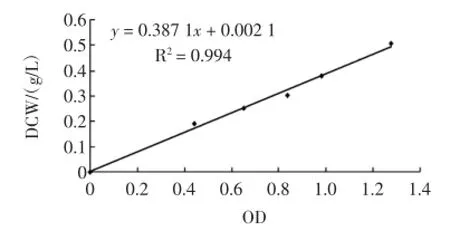
图1 酵母细胞OD600与菌体干重的关系曲线Fig.1 The relationship curve between ofOD600and dry cellweight (DCW)
酿酒酵母SH003接种种子培养液中,于28℃200 r/min摇瓶培养,每2 h取样,样品稀释放20倍,于紫外分光光度计测定OD600值,同时接种基础转化培养基中,于28℃200 r/min摇瓶培养24 h,测定2-苯乙醇产量,结果见图2。
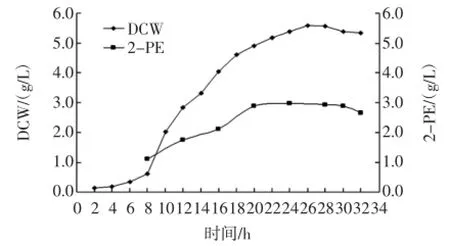
图2 SH 003种子生长曲线和种龄对转化合成2-PE的影响Fig.2 Thegrow th curveofseed SH003 and theeffectofseed culturing tim eon 2-PE production
由图2可知,菌种培养6 h后,进入对数生长期,培养22 h,菌体干重增速减缓,为稳定期,26 h菌体干重最高,达5.58 g/L,继续培养则略有下降。从菌龄8 h开始接种进行转化2-苯乙醇,随着种龄的增长,生物合成转化2-苯乙醇产量增加,种龄在20 h~28 h 时2-苯乙醇产量相差不大,达2.9 g/L~3.0 g/L,但继续增加种龄,则合成2-苯乙醇产量明显下降,这可能是处于衰亡期菌体细胞自溶和转化酶活力下降有关,因此以下试验均采用培养24 h的菌体细胞作为转化种子液。
2.3碳源种类对生物转化2-苯乙醇的影响
根据酿酒酵母可同化碳源试验,选用葡萄糖、蔗糖、麦芽糖、半乳糖、甘油、玉米淀粉为碳源,浓度均为80 g/L,L-苯丙氨酸为8 g/L,其余成分均相同,结果见表1。

表1 不同碳源对转化合成2-苯乙醇的影响Table 1 Effectsof carbon sources concentrate on 2-PE production by bioconversion
表1结果表明,SH003能较好地利用蔗糖和葡萄糖作为碳源转化成2-苯乙醇,亦能利用麦芽糖,但以玉米淀粉、甘油和半乳糖为碳源转化产物浓度很低,因此以后的试验选用蔗糖或葡萄糖为碳源。
2.4糖浓度对转化2-苯乙醇的影响
在以葡萄糖为碳源的基础上,考察了不同糖浓度对转化2-苯乙醇的影响,糖浓度范围在20 g/L~200 g/L之间,L-苯丙氨酸为8 h/L,结果见图3。

图3 葡萄糖浓度对2-苯乙醇合成的影响Fig.3 Theeffect ofglucose concentration on 2-PE bioconversion
从图3中可以看出,在葡萄糖浓度为20g/L~100g/L时。随着葡萄糖浓度的增加,2-苯乙醇产量逐渐增加,当糖浓度大于100 g/L时,2-苯乙醇产量增加不明显,当糖浓度大于140 g/L时,2-苯乙醇产量略有下降。在低糖浓度时,菌体干重随着糖浓度的增加而增加,当糖浓度大于80 g/L时,菌体干重保持较平稳的状态,这表明菌株SH003对高浓度的葡萄糖耐受性较强。
2.5氮源对转化2-苯乙醇的影响
酵母菌能利用无机氮和有机氮,在培养基中添加底物L-苯丙氨酸8 g/L,考察不添加氮源和分别添加3种常用的氮源对酵母菌转化合成2-苯乙醇的影响。表2为摇瓶培养24 h的结果。
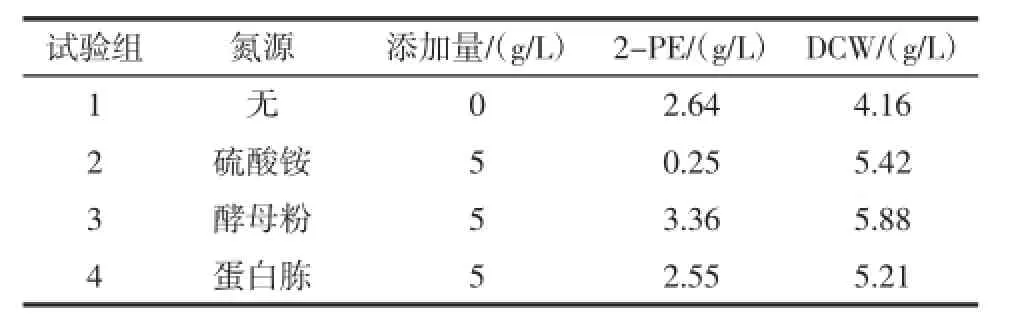
表2 不同氮源对生物转化2-苯乙醇的影响Table 2 Theeffect of differentnitrogen sourceson 2-PE production
表2表明,在未添加其它氮源仅以底物L-苯丙氨酸为唯一氮源的条件下,2-苯乙醇产量仅次于添加了酵母粉的产量,但菌体干重略低于添加了其它氮源菌体干重。当培养基中添加了无机氮源硫酸铵后,虽然其菌体得率最高,但2-苯乙醇产量非常低,仅为0.25 g/L,可能是由于大量NH4+离子存在,菌体不利用L-苯丙氨酸转氨反应释放的NH3,导致艾氏代谢途径不能顺利进行。添加蛋白胨为N源亦未能提高2-苯乙醇的产量,而添加酵母粉可明显提高2-苯乙醇的产量,因此选用酵母粉作为辅助氮源。
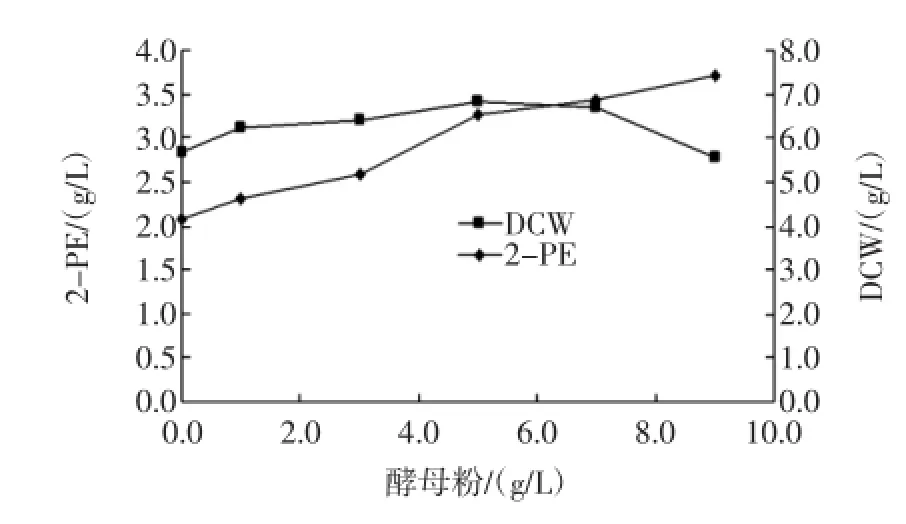
图4 酵母浸出粉浓度对生物转化2-PE的影响Fig.4 The Effectofyeastextraction concentration on 2-PE bioconversion
分别在转化培养基中添加0、1、3、5、7、9 g/L的酵母粉,在相同的转化条件下分别测定2-苯乙醇的产量,结果见图4。由图4可知,随着转化培养液中酵母粉浓度的增加,2-苯乙醇产物的浓度亦有所增加,当酵母粉浓度达到5 g/L时,产物浓度最高,为3.4 g/L,而随着添加酵母粉浓度的继续升高,产物2-苯乙醇浓度反而开始下降,但菌体干重则随着酵母粉的浓度增加而明显增加,这表明添加适量的酵母粉有利于菌体转化合成2-苯乙醇,而过量酵母粉只有利于菌体的生长。
2.6磷酸盐及pH对酵母菌转化合成2-苯乙醇的影响
磷是染色体和高能磷酸化合物的主要组成物质,是细胞代谢必不可缺的元素之一。采用磷酸盐类缓冲液调节培养基初始pH和控制代谢过程中的pH以及加入CaCO3控制转化过程的pH,考察pH对产物生成的影响,图5为在基础转化培养基中加入不同浓度的CaCO3(灭菌后加入),对SH003菌株生物转化2-PE的作用。
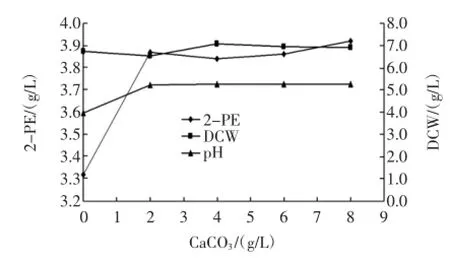
图5 CaCO3对转化液pH和2-PE产量的影响Fig.5 Theeffect of CaCO3on pH and 2-PE bioconversion
由图5可以看出,加入CaCO3调节转化液中的pH,最高产量可达3.92 g/L,较不控制pH的对照提高15.3%,转化结束终止pH亦较高,为5.2~5.3,而未加入CaCO3的对照转化液终止pH为3.97,因此在转化过程中控制转化液的pH为5.2左右有利于转化的顺利进行。细胞生物量没有较大的波动,这表明转化液中的pH对菌体生长影响不大。以上结果表明,在转化液中添加2 g/L的CaCO3有利于产物的合成。
由于CaCO3难溶于水,过量的CaCO3对用树脂原位吸附2-PE和后续的提取工艺造成不利的影响,因此采用磷酸盐缓冲液控制转化液中的pH,图6为不同摩尔浓度的pH6.8磷酸钾缓冲液对生物合成转化2-PE的影响。
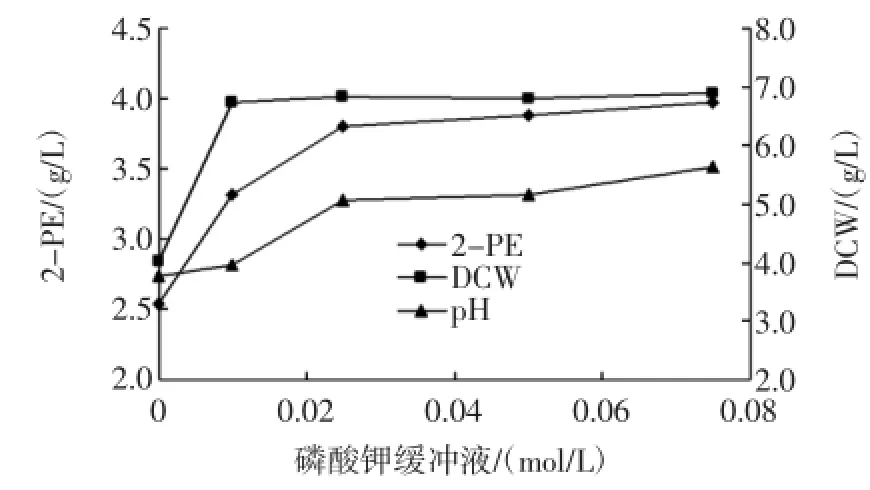
图6 磷酸钾缓冲液浓度对转化液pH和2-PE产量的影响Fig.6 Theeffectof potassium phosphate buffer solution(pH6.8)on pH and 2-PE production
由图6可以看出,随着磷酸盐缓冲液(pH6.8)摩尔浓度的增加,2-PE产量明显培加,当磷酸钾缓冲液为0.025mol/L时,产量为3.8 g/L,之后随着浓度的增加,产量增加明显减缓,当磷酸钾缓冲液浓度达0.075mol/L时,2-PE产量达3.98 g/L,增加36.2%,转化液终止pH 为5.6,生物量亦明显增加,这表明添加适量的磷酸钾缓冲液可较好地控制转化过程中的pH,有利于细胞生长和产物合成。
2.7无机盐对酵母菌SH003生物转化2-苯乙醇的作用
细胞生长繁殖和产物代谢过程中均需要无机盐和微量元素,考察了在不同浓度的NaCl、MgSO4·7H2O、ZnSO4对合成2-苯乙醇的影响。MgSO4·7H2O对2-苯乙醇的合成有明显的促进作用,当MgSO4·7H2O浓度达0.6 g/L时2-苯乙醇产率最高,达3.88 g/L,低浓度的ZnSO4对2-苯乙醇的合成无明显影响,随着浓度升高有轻微的抑制作用,而NaCl对2-苯乙醇的合成无影响。因此在培养基中可不添加ZnSO4和NaCl。
2.8培养基主要组分的正交试验
通过单因素优化试验初步确定了影响酵母菌SH003生物转化2-苯乙醇的主要影响因子为酵母粉、葡萄糖、磷酸钾和MgSO4·7H2O,由于单因素试验不能综合反应各因素、水平间的交互作用,因此在单因素试验结果的基础上,即0.75mol/L磷酸盐和0.6 g/L MgSO4·7H2O的条件下,采用L9(34)正交试验对培养基主要组分L-苯丙氨酸、葡萄糖和酵母粉进行优化,试验设计和结果分析见表3和表4。
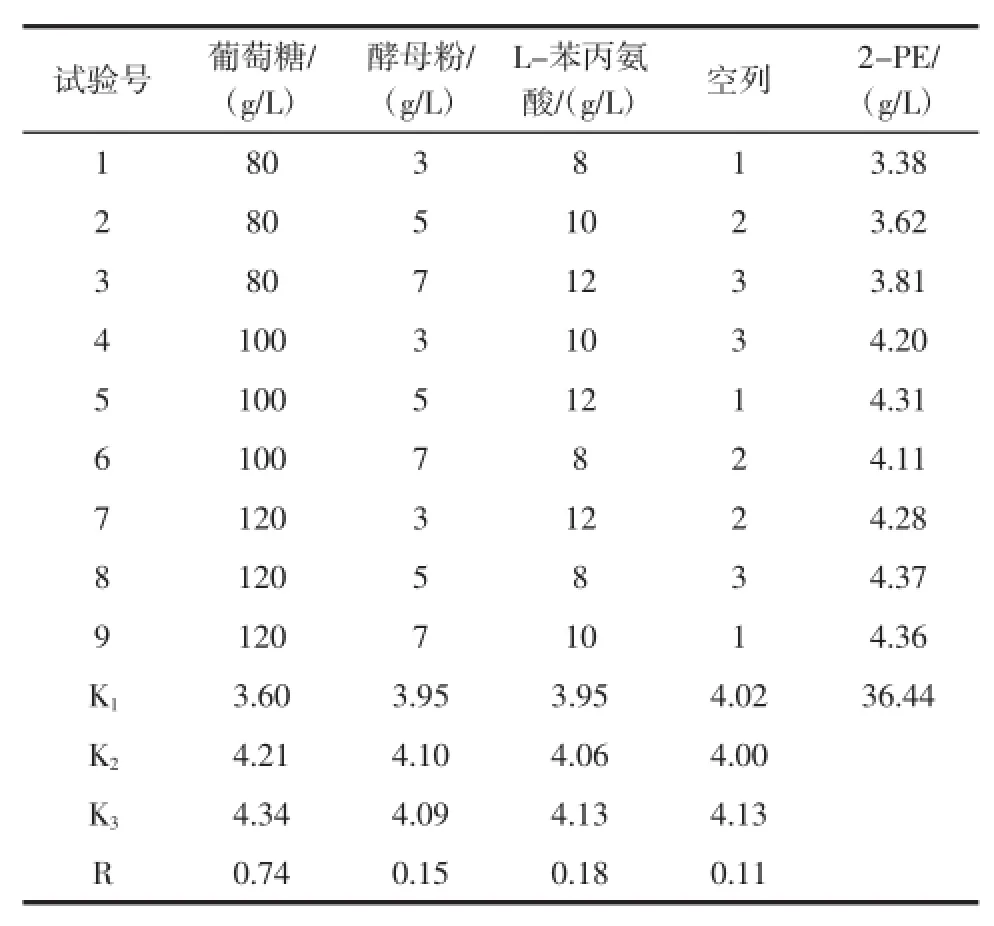
表3 L9(34)正交试验设计及结果分析Table3 L9(34)orthogonaldesign and statisticalanalysis
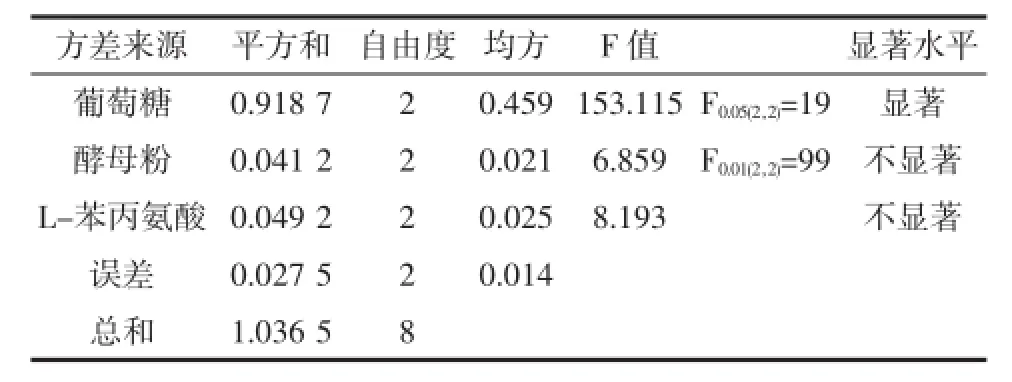
表4 正交试验方差分析表Table4 Analysisof variance for orthogonal test
正交试验试验结果表明,在优化的单因子磷酸盐和MgSO4·7H2O基础上设计的正交试验,2-PE产量均有较大的提高,而最佳培养基组成为葡萄糖120 g/L,酵母粉5 g/L,L-苯丙氨8 g/L。葡萄糖浓度对酵母细胞SH003合成转化2-苯乙醇具有显著影响,而酵母粉和L-苯丙氨酸对生物合成2-苯乙醇无显著影响。
从表3中正交试验结果K值表明,底物L-苯丙氨酸浓度越高,2-苯乙醇产量越高,为验证底物浓度对转化合成2-PE的影响,在优化的条件下,即葡萄糖120 g/L,酵母5 g/L,添加不同浓度底物进行了试验,结果见表5。

表5 不同碳源对转化合成2-苯乙醇的影响Table 5 Effectsof L-pheny lalan ine concentrateon 2-PE production by bioconversion
结果表明,随着底物浓度提高,2-PE产量略有增加,但转化率急剧下降,当2-PE产量达4.4 g/L时,已达到细胞转化合成产物的极限值,再提高底物浓度也不会增加产量,综合考虑产量和底物转化率,我们认为底物浓度添加量在8 g/L比较适宜。
2.9温度对转化合成2-苯乙醇的影响
在上述优化的培养基培养基组成条件下,分别进行了在20、25、28、30、32、35、38℃转化试验,不同的转化温度下对生物转化2-苯乙醇有显著的影响,细胞在28℃~32℃转化产物浓度较高,而低于26℃和高于32℃产物浓度明显下降,这可能是在低温条件下菌体生长较缓慢,酶活在低温条件下活性降低,而过高的温度也可导致一些酶失活和菌体快速衰老而影响产物合成,因此最适的转化温度为28℃~30℃。
2.10溶氧对转化合成2-苯乙醇的影响
在摇瓶转速为200 r/min的条件下,考察了250mL三角瓶中培养基装量分别为25、50、75、100、125mL时对合成转化2-苯乙醇产量的影响,酵母菌在生长和转化过程中需要大量的氧进行菌体繁殖和产物代谢,当摇瓶中培养液装量较多时,氧的供应量不足而导致2-苯乙醇的产量有下降趋势。精确的溶氧调控参数需在小型发酵罐中获得。
3 小结
本试验通过酿酒酵母SH003菌株种子液生长曲线及种龄对转化合成2-苯乙醇的影响,确定了最适种龄为20 h~24 h。通过单因素试验对转化培养基进行优化,确定了对合成转化2-苯乙醇影响较大的因素和转化培养基组成,合适的转化碳源为葡萄糖和蔗糖,氮源为酵母粉,组成培养基合适的磷酸钾缓冲液pH为6.8,在培养基中添加MgSO4和CaCO3有利于细胞合成2-苯乙醇。在单因素的基础上,通过正交试验进一步对葡萄糖、酵母粉和L-苯丙氨酸浓度进行优化,优化后的培养基配方为:葡萄糖120 g/L,酵母粉5 g/L,L-苯丙氨酸8 g/L,MgSO40.2 g/L,KH2PO46.8 g/L,K2HPO48.7 g/L。优化后生物合成2-苯乙醇产量最高达4.37 g/L,比优化前产量提高了30.1%。最适转化温度为28℃~30℃,在转速200 r/min时,装液量为50mL/250mL三角瓶。
参考文献:
[1] 卢健,卢少明,马集锋.β-苯乙醇的现状与发展前景[J].广东化工, 2012,39(11):123-124
[2]唐育岐,刘天明,赵修报,等.高产2-苯乙醇酵母菌株的筛选及培养基优化[J].中国食品添加剂,2012(3):137-142
[3]FabreCE,Duviau V J,Blane P J,etal.Identification ofvolatile flavor compoundsobtained in culture of Kluyveromycesmarxianus[J]. Biotechnol Lett.1995,17(9):1207-1212
[4]HuangCJ,Lee SL,Chou CC.Production of2-phenylethanol,a flavor ingredientby Pichia fermentans L-5 under various culture conditions[J].Food Res Int,2001,34(1):277-282
[5]Etschmann M,Sell D,Schrader J.Screening of yeasts for the production of the aroma compound 2-phenylethanol in a molassesbasedmedium[J].Biotechnol Lett,2003,25(2):531-536
[6]Etschmann M,BluemkeeW,SellD,etal.Biotechnological production of2-phenylethanol[J].App lMicrobiol Biotechnol,2002,59(2): 1-8
[7]崔志峰,沈倩佳,杨霄,等.酵母生物转化合成2-苯乙醇的培养条件优化[J].食品与发酵工业,2008,34(8):52-54
[8]荣绍丰,付艳丽,王涛,等.酿酒酵母AS2.1182发酵生产β-苯乙醇的研究[J].食品与发酵工业,2009,35(8):69-77
[9]汪琨,沈佳倩,魏秀燕,等.酿酒酵母CWY132发酵罐小试生产2-苯乙醇[J].食品与发酵工业,2011,37(4):102-106
[10]梅建风,闵航,吕镇海.利用酵母细胞生物催化合成2-苯乙醇[J].催化学报,2007,28(11):993-998
DOI:10.3969/j.issn.1005-6521.2015.22.040
收稿日期:2014-11-05
基金项目:江西省科技支撑项目(20133BBE50018)
作者简介:黄筱萍(1965—),女(汉),研究员,硕士,主要从事生物发酵、活性物质提取精制的研究。
The Optim ization of Bioconversion Conditions for the Production of 2-phenylethanolw ith Saccharomyces cerevisiae SH003
HUANGXiao-ping,HUANGGuo-chang,LIULan,XIONGDa-wei,ZHANGTing
(Institution ofMicrobiology,JiangxiAcademyof Sciences,Nanchang 330029,Jiangxi,China)
Abstract:The bioconversion conditions for the production of 2-phenylethanolwith Saccharomyces cerevisiae SH003werestudied.Culture timeofseed liquid wasdetermined.The experimentsofsingle factorand orthogonal design were carried out to optimize the compositions of bioconversion and cultivation conditions for 2-phenylethanol production.The optimized medium contains 120 g/L glucose,5 g/L yeast extract,8 g/L L-phenylalanine,0.2 g/LMgSO4,0.05mol/L KH2PO4and 0.05mol/LK2HPO4.Incubated at28℃and 200 r/min for24 h,the yield of2-phenylethanol reached up to 4.37 g/L,increased by 30.1%compared with the original condition.
Keywords:2-phenylethanol;Saccharomycescerevisiae;optimization;bioconversion
