Notch1对局灶性脑缺血再灌注损伤后神经细胞凋亡的影响
2015-07-07程连臣王昊徐川梁慧英房凯
程连臣,王昊,徐川,梁慧英,房凯
(临汾市第四人民医院 麻醉科,山西 廊坊 041000)
Notch1对局灶性脑缺血再灌注损伤后神经细胞凋亡的影响
程连臣,王昊,徐川,梁慧英,房凯
(临汾市第四人民医院 麻醉科,山西 廊坊 041000)
目的 研究Notch1对脑局灶性缺血再灌注损伤后神经细胞凋亡的影响,为缺血性脑血管病临床治疗寻找新的靶点。 方法 72只SD雄性成年大鼠随机分为等量4组:假手术组(Sham组),缺血再灌组(I/R组),Notch1抑制剂组(DAPT组),溶剂对照组(Vehicle组)。采用线栓法大脑中动脉阻塞(MCAO)模型制作大鼠局灶性脑缺血再灌注模型,缺血90 min为标准。Sham组仅分离血管,不插入线栓,Notch1抑制剂组或Vehicle组在模型建立再灌注恢复后立即向缺血对侧侧脑室分别注射DAPT或单纯溶剂(PBS+DMSO),每天1次,分别于术后1、3、7 d断头取脑,病理学观察缺血再灌注侧皮层损伤情况,TUNEL法检测神经细胞凋亡指数(AI),Weatern blot检测PARP裂解片段含量、Notch1活性片段NICD、Akt和Bad磷酸化水平。 结果 与Sham组相比,I/R组神经细胞凋亡指数及PARP裂解片段含量增加,NICD、磷酸化Akt及Bad水平升高,差异有明显统计学意义(P<0.05);与I/R组相比,给予Notch1抑制剂DAPT后,神经细胞凋亡指数及PARP裂解片段含量明显增加,NICD、磷酸化Akt及Bad水平明显下降,差异有显著性(P<0.05),而溶剂对照Vehicle组的各项指标无明显差异。 结论 Notch1在脑缺血再灌注损伤中具有抑制神经细胞凋亡作用,其作用机制可能与增强Akt磷酸化水平,促进Bad失活有关。
缺血再灌注损伤;Notch1;神经细胞;凋亡
Notch 信号通路在细胞分化、增殖、存活和发育中起重要作用,Notch 信号通路还参与免疫炎症反应,在各种炎症性疾病发生发展过程中起重要作用[1]。Notch 1参与了一些神经变性疾病的发病过程,如缺血性卒中。确定Notch1 信号对脑缺血再灌注后神经凋亡的影响及其机制,对今后脑缺血再灌注损伤的基础研究和临床治疗有着重大帮助。但是,目前缺乏Notch1 参与调节神经细胞凋亡的直接证据且机制不明[2]。本研究通过制作SD 大鼠大脑中动脉阻塞(MCAO)模型,模拟临床缺血性脑卒中病人,同时采用γ-分泌酶抑制剂(DAPT)抑制Notch1 信号通路,研究Notch1信号通路变化在脑局灶性缺血再灌注损伤后对神经细胞凋亡的影响,并尝试阐述其作用机制,进而为ICVD 的临床进一步治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:72只雄性SD(Sprague Dawley)近交大鼠,由武汉大学动物实验中心提供(周龄8~9 周,体质量250~280 g,健康,清洁级,许可证号2003-0004。)
1.1.2 主要试剂:丙烯酰胺/N 美国Sigma 公司;N-亚甲叉双丙烯酰胺(Arc/Bis) 美国Sigma 公司;四甲基乙二胺(TEMED) 美国Sigma 公司;十二烷基磺酸钠(SDS) 美国Sigma 公司;甘氨酸(Glycine) 美国Sigma 公司;三羟甲基氨基甲烷(Tris) 美国Sigma 公司;PMSF 美国Sigma 公司;四甲基偶氮唑蓝(MTT) 美国Sigma 公司;多聚甲醛 美国Sigma 公司;DMSO 美国Sigma 公司;过硫酸铵(AP) 美国Amresco 公司。
1.2 方法 72只SD雄性成年大鼠随机均分为4组:假手术组(Sham组),缺血再灌组(I/R组),Notch1抑制剂组(DAPT组),溶剂对照组(Vehicle组)。采用线栓法大脑中动脉阻塞(MCAO)模型制作大鼠局灶性脑缺血再灌注模型,缺血90 min为标准。脑缺血预处理模型的制作:采用腹腔注射2%戊巴比妥钠40 mg / kg麻醉固定大鼠,行颈部正中切口,分离暴露出右颈总动脉及其分支颈外动脉和颈内动脉,结扎并切断颈外动脉。在颈外动脉残端剪一小口,将直径0.20~0.25 mm尼龙线自颈外动脉插入经右颈总动脉导入颈内动脉缓慢入颅,通过右颈总动脉分叉处约(18.5±10.5) mm,当感到有明显阻力时停止,栓塞右大脑中动脉20 min拉出尼龙线至颈外动脉,结扎颈外动脉残端,使血流再灌注。术后动物保温(20~24 ℃)喂养24 h。Sham组仅分离血管,不插入线栓,Notch1抑制剂组或Vehicle组在模型建立再灌注恢复后立即向缺血对侧侧脑室分别注射DAPT或单纯溶剂(PBS+DMSO),缺血再灌组(I/R组)是模型成功后再灌注,不注射DAPT或单纯溶剂(PBS+DMSO),每天1次,分别于术后1、3、7 d断头取脑,
病理学观察缺血再灌注侧皮层损伤情况,按常规方法制备标本,固定、切片、观察。
TUNEL法检测神经细胞凋亡指数(AI):标本预处理,从组织分离的细胞的预处理,在载玻片上滴加 50~100 μL细胞悬液并使之干燥。用PBS洗2次,每次5 min;色缸中加入含2%过氧化氢的PBS,于室温反应5 min。用PBS洗2次,每次5 min;用滤纸小心吸去载玻片上组织周围的多余液体,立即在切片上加2滴 TdT酶缓冲液,置室温1~5 min;用滤纸小心吸去切片周围的多余液体,立即在切片上滴加 54 μL TdT酶反应液,置湿盒中于37 ℃反应 1h(注意:阴性染色对照,加不含TdT酶的反应液);将切片置于染色缸中,加入已预热到37 ℃的洗涤与终止反应缓冲液,于37 ℃保温30 min,每10 min将载玻片轻轻提起和放下1次,使液体轻微搅动;组织切片用PBS洗3次,每次 5 min后,直接在切片上滴加2滴过氧化物酶标记的抗地高辛抗体,于湿盒中室温反应30 min;用PBS洗4次,每次5 min;在组织切片上直接滴加新鲜配制的0.05%DAB溶液,室温显色3~6 min;用蒸馏水洗4次,前3次每次1 min,最后1次5 min;于室温用甲基绿进行复染10 min。用蒸馏水洗3次,前2次将载玻片提起放下10次,最后1次静置30s。依同样方法再用100%正丁醇洗3次;用二甲苯脱水3次,每次2 min,封片、干燥后,在光学显微镜下观察并记录实验结果。
Western blot检测PARP裂解片段含量、Notch1活性片段NICD、Akt和Bad蛋白表达及磷酸化水平:用全蛋白抽提试剂1 mL(南京凯基生物科技发展有限公司)提取总蛋白,采用BCA法测定蛋白浓度。变性后取40 μg经10% SDS-PAGE电泳分离,转移到硝酸纤维素膜上,室温封闭1 h,加入兔抗鼠(Abcam公司,美ITI)Notchl NICD多克隆抗体(1:400 ) , 4 ℃封闭过夜,洗膜后加入辣根过氧化物酶标记的二抗(1:200 Santa Cruz公司),室温孵育1 h后ECL显影,X光片暗室中感光,图像分析系统进行扫描并记录光密度强度。以β-actin为内参照,以相对灰度值进行统计学分析。
2 结果
2.1 脑缺血再灌损伤后Notch1活性 Sham组Notch1活性片段NICD水平较低,条带染色浅,提示Notch1存在于正常脑组织中。脑缺血再灌后各时间点Notch1活性片段NICD水平均高于Sham组(P<0.05),各点相比,NICD在缺血再灌后1 d已经升高,3 d达高峰,7 d回落,但较Sham组相比仍较高(P<0.05),提示缺血再灌注损伤Notch1 活性增强。见图1。
2.2 脑缺血再灌注损伤后神经细胞凋亡且与Notch1活性关系
2.2.1 缺血再灌注损伤后脑组织出现明显病理学损害:HE染色显示,Sham组细胞形态和结构无明显异常,细胞沿轴突整齐排列,细胞质、细胞核结构清晰。I/R组随着再灌注时间的延长出现不同程度细胞形态和结构异常,胞体和胞核固缩,深染,核仁不清楚,甚至出现神经细胞核破裂。尼氏染色可见明显白色梗死灶,存活神经细胞(镜下蓝染者)数量减少。见图2。
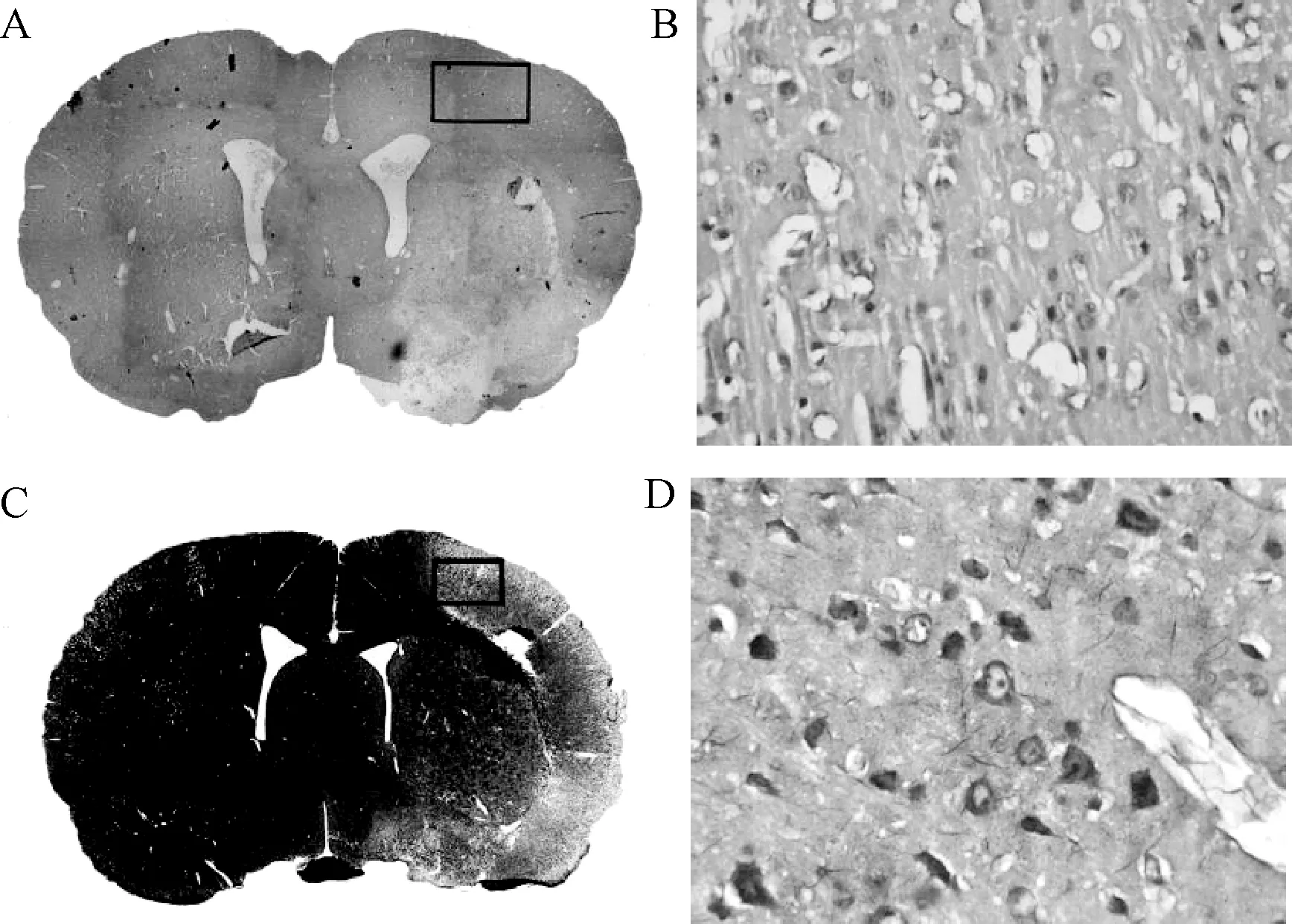
图2 大鼠局灶性脑缺血再灌注损伤7 d后HE 及尼氏染色A和C分别是10×4 HE染色和尼氏染色,□为缺血半暗带区,后续图像均于此区域拍摄采集;B和D分别是缺血半暗带区10×40 HE染色和尼氏染色Fig.2 The HE and Nissl staining of focal cerebral ischemia reperfusion injury after 7 daysA and C were 10×4 HE staining and Nissl staining,represented the ischemic penumbra, follow-up images were taken in this area acquisition; B and D were respectively the ischemic penumbra area of 10×40 HE staining and Nissl staining
2.2.2 脑缺血再灌注损伤后神经细胞凋亡指数升高:Sham组有少量散在TUNEL染色阳性的凋亡神经细胞,提示正常组织生理活动中神经细胞也发生凋亡。与Sham组对比,I/R组在缺血再灌注1 d后TUNEL阳性细胞数开始升高,在3 d达到顶峰,随后下降。计算凋亡指数AI(Sham组 0.14,I/R组0.36),表明缺血再灌注损伤后神经细胞凋亡增加。核染呈棕黄色为阳性的凋亡细胞(见图3。)

图3 脑缺血再灌注损伤及损伤后给药半暗带区神经细胞凋亡情况 (×400)Fig.3 The cerebral ischemia reperfusion injury and penumbra of neurocytes apoptosis condition administered after damage in rats (×400)
2.2.3 脑缺血再灌注损伤后PARP裂解片段增加:TUNEL法检测的同时,利用Western印迹法检测各时间点脑组织中对应缺血半暗带区凋亡特异性蛋白标志——PARP 89kD裂解片段,并进行统计学分析。结果表明,Sham组PARP 89kD 裂解片段极少(5%),I/R组各时间点PARP 89kD裂解片段显著增加(30%),均高于Sham 组(P<0.05)。不同时间点相比,PARP 89KD裂解片段在缺血再灌注损伤后1 d已经开始增多(1 d,9%;3 d,19%;7 d,34%),并呈持续升高趋势(P<0.05),提示神经细胞凋亡持续发生。
2.2.4 缺血再灌注损伤后神经细胞凋亡与Notch1活性呈正相关:选取各时间点神经细胞凋亡指数与NICD水平进行了相关性分析,结果表明2者存在显著正相关关系(r=0.978,P<0.05)。
2.3 抑制Notch1活性促进脑缺血再灌注后神经细胞凋亡 TUNEL 结果显示,Vehicle组大鼠给药1、3、7 d,神经细胞凋亡指数与I/R 组无明显统计学差异。DAPT组各时间点凋亡指数明显高于Vehicle组,差异有统计学意义(P<0.05),且变化规律与Vehicle 组一致,仍以缺血再灌后3 d为顶点曲线变化。说明单纯溶剂对脑缺血再灌注损伤后神经细胞凋亡没有影响,而DAPT抑制Notch1活性后可促进凋亡的发生,结果见图4。
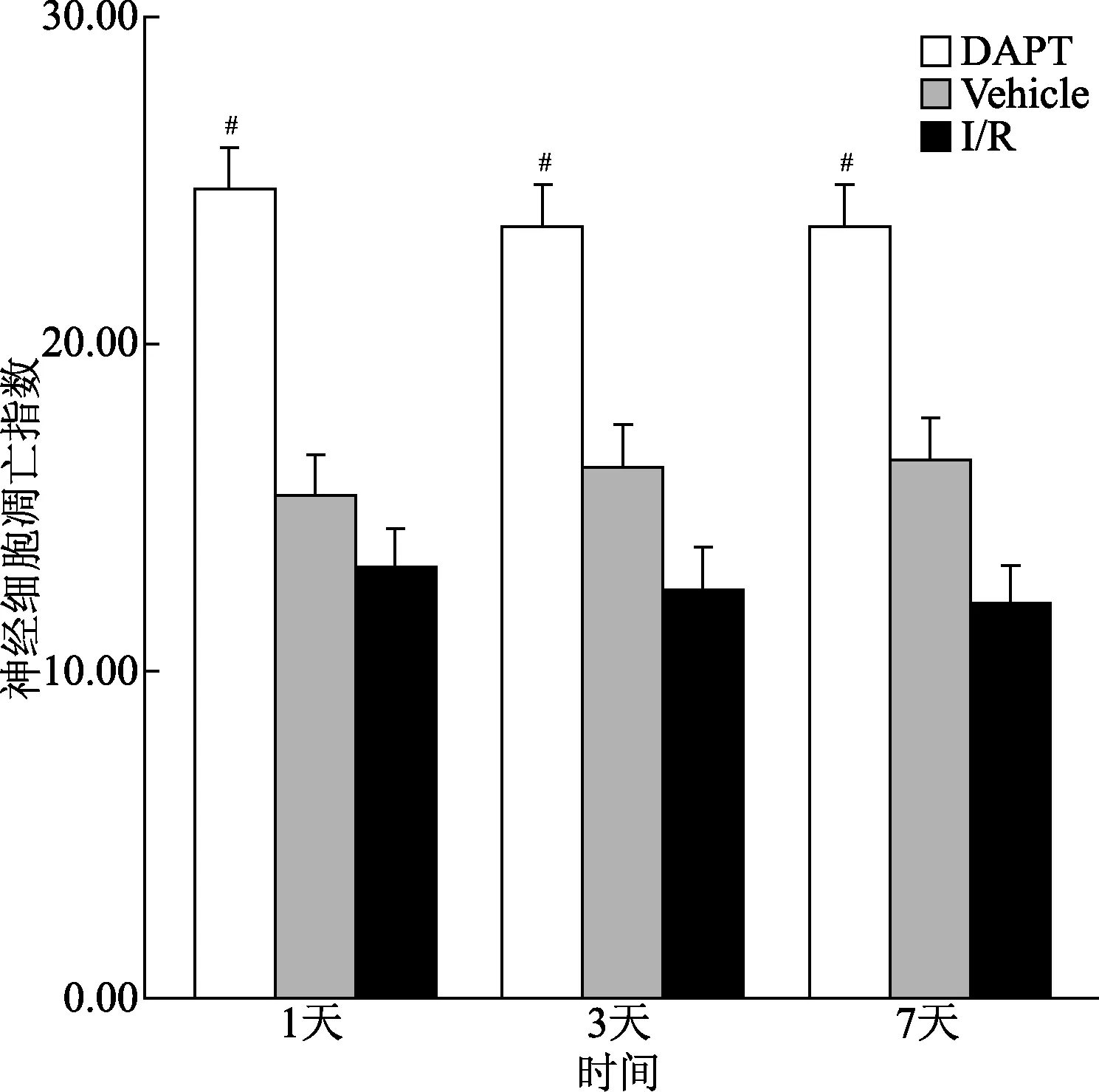
图4 各组不同时间的神经细胞凋亡指数#P<0.05,与Vehicle组比较Fig.4 Nerve cell apoptosis index at different time points#P<0.05,compared with vehicle group
2.4 脑缺血再灌注损伤后Notch1 通过Akt、Bad 影响神经细胞凋亡过程
2.4.1 脑缺血再灌注损伤后Akt 磷酸化水平增加并与Notch1正相关:各组之间Akt总蛋白表达水平无明显统计学差异。但是,相较于Sham组,I/R组p-Akt水平发生显著改变,缺血再灌1 d时有所降低,3 d时明显升高,7 d时回落,但较Sham组相比仍较高(P<0.05)。同时,为了验证Akt变化与Notch1 之间有无关联,进行了相关性分析,结果表明2者存在显著正相关关系(r=0.998,P<0.05)。
2.4.2 脑缺血再灌注损伤后Bad 磷酸化水平增加:Western结果显示,相较于Sham组,I/R组p-Bad水平在缺血再灌1 d时开始升高,3 d时到达顶峰,7 d时回落,各时间点均高于Sham 组(P<0.05)。
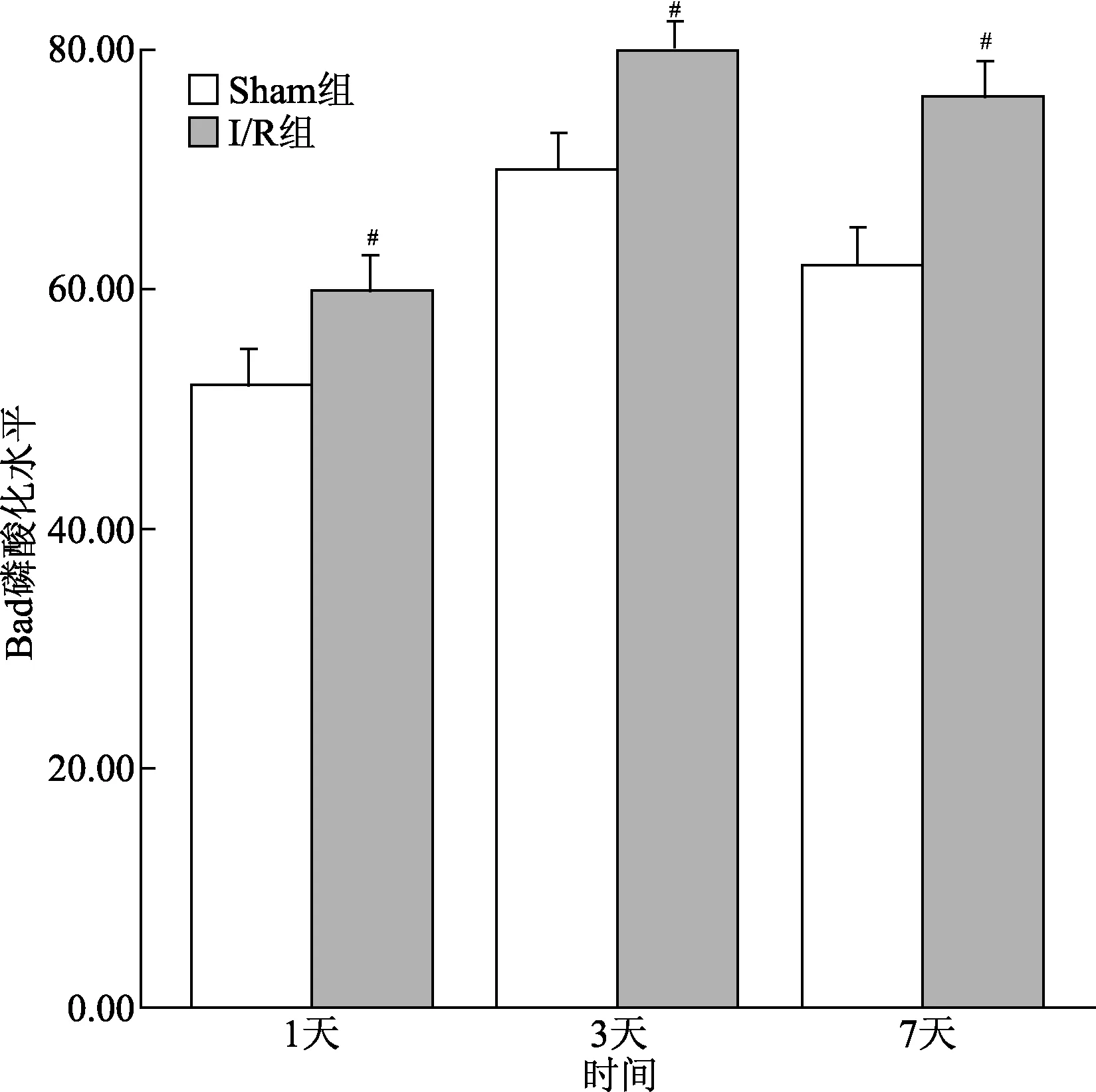
图5 脑缺血再灌注损伤后Bad磷酸化水平#P<0.05,与Sham组比较Fig.5 Bad phosphorylation after cerebral ischemia reperfusion injury#P<0.05,compared with Sham group
2.4.3 DAPT抑制Akt磷酸化水平:对比I/R组,Vehicle组大鼠给药1、3、7 d后,Akt磷酸化水平差异无统计学意义,说明溶剂对脑缺血再灌注损伤后Akt表达无影响。与Vehicle组比较,DAPT组各时间点Akt磷酸化水平明显减低(P<0.05)。结果表明DAPT给药后抑制Notch1的同时使Akt 表达降低。

图6 各组Akt 磷酸化水平#P<0.05,与Vehicle组比较Fig.6 Akt phosphorylation after Cerebral ischemia reperfusion injury#P<0.05,compared with vehicle group
3 讨论
NICD是Notch1受体的活化形式,被认为是Notch信号通路激活的标志,NICD水平可代表Notch1蛋白的活性。本研究结果显示脑缺血再灌后Notch1活性片段NICD水平均高,提示缺血再灌注损伤Notch1活性增强,缺血再灌注损伤后神经细胞凋亡增加,脑缺血再灌注损伤后神经细胞凋亡与Notch1活性之间有关联,说明单纯溶剂对脑缺血再灌注损伤后Notch1表达没有影响,而给予DAPT 可有效抑制Notch1表达,与其他学者结果相似[3-7]。抑制Notch1活性神经细胞凋亡指数升高,但是单纯溶剂对脑缺血再灌注损伤后神经细胞凋亡没有影响,而DAPT 抑制Notch1活性后可促进凋亡的发生。PI3K/Akt信号通路是一个在细胞生长、细胞生存和代谢中起主要调节作用的信号转导通路,目前已有研究报道[8-12],Notch1 通过PI3K/Akt信号通路抑制肿瘤组织中药物引起的或p53介导的细胞凋亡,本研究结果说明各组之间Akt总蛋白表达水平无明显统计学差异,但是p-Akt 水平发生显著改变,Bad 作为Akt 的下游底物,同时检测到Bad 总蛋白表达无明显统计学差异及其磷酸化水平不同,结果表明DAPT 给药后抑制Notch1 的同时使Akt 表达减低,与其他结果相同[13-15]。
结合本实验得出如下结论:Notch1 在脑缺血再灌注损伤中可能具有抑制神经细胞凋亡作用,在脑缺血再灌注损伤后抑制Notch1 可促进神经细胞发生凋亡;Notch1 在脑缺血再灌注损伤后抑制神经细胞凋亡的作用机制可能与增强Akt 磷酸化水平,促进Bad 失活有关。
[2] Meyers PM, Schumacher HC, Connolly ES, et al.Current status of endovascular Stroke tereatment[J].Circulation, 2011, 123(22):2591-2601.
[3] Wechsler LR.Intravenous thrombolytic therapy for acute ischemic stroke[J].N Engl J Med, 2011, 364(22):2138-2146.
[4] Appelboom G, Strozyk D, Meyers PM, et al.Current recommendations for endovascu areinterventions in the treatment of ischemic stroke[J].Curr Atheroscler Rep, 2010, 12(4):244-250.
[5] Jang H, Rabb H.The innate immune response in ischemic acute kidney injury[J].Clin Immunol, 2009, 130(1):41-50.
[6] Stroo I, Stokman G, Teske GJ,et al.Chemokine expression in renal ischemia/reperfusion injury is most profound during the reparative phase[J].Int Immunol, 2010, 22(6):433-442.
[7] Lakhan SE, Kirchgessner A, Hofer M.Inflammatory mechanisms in ischemic stroke: thrapeutic approaches[J].J Transl Med, 2009, 7:97.
[8] Sugawara T, Fujimura M, Noshita N, et al.Neuronal death/survival signaling pathways in cerebral ischemia[J].NeuroRx, 2004, 1(1):17-25.
[9] Frijns CJ, Kappelle LJ.Inflammatory cell adhesion molecules in ischemic cerebroe vascular disease[J].Stroke, 2002, 33(8): 2115-2222.
[10] Li M, Zhang XJ, Cui LL,et al.The neuroprotection of oxymatrine in cerebral ischemia reperfusion is related to nuclear factor erythroid 2-related factor 2(nrf2)-mediated antioxidant response: role of nrf2 and hemeoxygenase-1 expression[J].Biol Pharm Bull, 2011, 34(5): 595-601.
[11] Qi J, Hong ZY, Xin H, et al.Neuroprotective effects of leonurine on ischemia reperfu-sion induced mitochondrial dysfunctions in rat cerebral cortex[J].Biol Pharm Bull, 2010, 33(12): 1958-1964.
[12] Zhao J, Yu SS, Zheng WP, et al.Curcumin improves outcomes and attenuates focal cerebral ischemic injury via antiapoptotic mechanisms in rats[J].Neurochem Res, 2010, 35(3):374-379.
[13] Mattson MP, Duan W, Pedersen WA, et al.Neurodegenerative disorders and ischemic brain diseases[J].Apoptosis, 2001, 6:69-81.
[14] Hara MR, Snyder SH.Cell signaling and neuronal death[J].Ann Rev Pharmacol Toxicol, 2007, 47:117-141.
[15] Fortini ME.Notch signaling:the core Pathway and its posttranslational regulation[J].Dev Cell, 2009,16: 633-647.
(编校:谭玲)
Effect of Notch1 on neuronal apoptosis after focal cerebral ischemia reperfusion injury
Cheng Lian-chen,WANG Hao,XU Chuan,LIANG Hui-ying,FANG Kai
(Department of Anesthesiology, Fourth People’s Hospital of Linfen City, Langfang 041000,China)
ObjectiveTo study effect of nerve cell apoptosis after injury of Notch1 on focal cerebral ischemia reperfusion, and find new targets for the treatment of ischemic cerebrovascular disease.Methods72 male adult SD rats were randomly divided into four equal groups: sham operation group (Sham group), ischemia reperfusion group (I/R group), Notch1 inhibitor group (DAPT group), solvent control group (Vehicle group).By the suture method of middle cerebral artery occlusion (MCAO) for rat focal cerebral ischemia reperfusion model, the rats ischemic for 90minutes as the standard.The Sham group only isolated vascular, suture was not inserted. After the recovery of ischemia-reperfusion, the rats in inhibitor of Notch1 group or Vehicle group were immediately injected with DAPT or pure solvent (PBS+DMSO) to the contralateral ventricle, once daily, respectively.After 1 d, 3 d, 7 d, rats were cut off the head to take out the brain tissue, pathological observation of ischemia perfusion of cortex damage detection index, neural cell apoptosis by TUNEL (AI), Western blot detection PARP cleavage fragment content, activity of Notch1 fragment of NICD, Akt and Bad phosphorylation.ResultsCompared with Sham group, the apoptotic index, PARP cleavage fragment content, NICD, phosphorylation of Akt, Bad level increased in I/R group, and there were significant difference (P<0.05); compared with I/R group, apoptotic index and PARP fragments were markedly increased, NICD, phosphorylation Akt and Bad levels decreased significantly in DAPT group, and the differences were significant (P<0.05), while among the solvent control indexes of the Vehicle group. ConclusionNotch1 can inhibit nerve cell apoptosis in cerebral ischemia reperfusion injury, the mechanism may be related to enhance Akt phosphorylation, promote Bad inactivation.
ischemia-reperfusion injury; Notch1; neurons ;apoptosis
程连臣,男,学士,主治医师,研究方向:危重病人的麻醉,E-mail:qch1821460125@163.com。
R743.3
A
1005-1678(2015)02-0059-04
