EMS诱变西瓜种子条件分析
2015-07-05王学征朱娜娜高清宇刘璐张雅楠栾非时
王学征,朱娜娜,高清宇,刘璐,张雅楠,栾非时
EMS诱变西瓜种子条件分析
王学征1,2,朱娜娜1,2,高清宇3,刘璐1,2,张雅楠1,2,栾非时1,2
(1.东北农业大学园艺学院,哈尔滨150030;2.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨150030;3.黑龙江大学哲学学院,哈尔滨150080)
以东北农业大学西甜瓜育种研究室自育的西瓜品系“W1-17”为材料,以EMS为诱变剂,采用5个EMS诱变浓度(0.2%、0.6%、1.0%、1.4%和1.8%),4个处理时间(3、6、9和12 h),分析诱变后种子发芽率、相对出苗率和相对成苗率情况,最终确定EMS处理浓度1.0%、诱导时间9 h为西瓜品系“W1-17”种子最佳诱变条件。
西瓜;化学诱变;EMS
西瓜(Citrullus lanatus)是世界性园艺作物,具有食用和医疗保健价值。近年来,在西瓜育种方面,产量和品质性状研究均受限制,主要是在西瓜长时间育种过程中,筛选和育种目标太过单一造成遗传基础狭窄。针对这一问题,创建突变体库筛选突变体可为育种提供新种质材料,解决遗传狭窄问题,推进西瓜种质创新。除此之外,创建突变体库还可为西瓜基因遗传分析、基因定位与图位克隆及基因功能分析奠定基础。
EMS作为一种高效、稳定的化学诱变剂,主要能够诱发点突变,其诱变效果效率高、频率高、范围广。EMS化学诱变产生点突变的频率较高,而染色体畸变率相对较少,故可对作物某一种特殊性状进行改良。EMS处理后所形成突变群体在功能基因研究上具有独特优势,与其他诱变剂相比,EMS诱变后产生的突变频率高,多为显性突变体,易于突变体筛选。
构建饱和突变体库是进行功能基因组研究重要途径,拟南芥、水稻等模式植物功能基因组研究均已证明其在阐明基因功能方面具有重要作用。Laudencia-Chingcuanco等从创建的六倍体小麦EMS突变体库中得到一个突变株,对这一突变株进行分离得到Dy10和AX1高分子质量谷蛋白亚基缺陷突变株,试验中首次尝试将基因Dy10脱离出Dx5+Dy10的基因组合进行研究[1]。Hirano等研究辐射诱导产生的拟南芥突变体分子本质,研究表明290脉冲离子束处理可以有效产生大片段的基因缺失,将成为植物育种和基因功能分析尤其是衔接基因的有效诱变剂[2]。Vicente-Dólera等利用不同浓度EMS诱变西葫芦,研究表明致死率达40%,65 mmol·L-1的EMS处理液为最佳诱变处理条件[3]。Galpaz等经EMS诱导获得黄瓜突变体,研究得到类胡萝卜素异构酶基因的化学表征[4]。EMS诱变不需进行遗传转化,易形成点突变,不易对染色体造成畸变,因而被广泛用于构建突变体库[5-6]。目前国内已构建拟南芥(2013)[7]、菊花(2013)[8]、小麦(2010)[9]、玉米(2014)[10]、大豆(2013)[11]、燕麦(2011)[12]、甘蓝型油菜(2014和2010)[13-14]、花生(2013)[15]等物种EMS突变体库。
本研究以东北农业大学西甜瓜育种研究室自育西瓜品系W1-17为材料,以EMS为诱变剂,采用5个EMS诱变浓度,4个处理时间,旨在确定EMS对西瓜品系W1-17种子最佳诱变处理条件,探讨EMS诱变处理对西瓜植株效应,为进一步构建西瓜突变体库,拓宽西瓜资源遗传背景和开展西瓜功能基因组学研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 供试西瓜种子
供试西瓜材料W1-17是东北农业大学园艺学院西甜瓜育种研究室提供的高代自交系,果肉红色、肉质脆嫩、口感极佳,具有早熟和适应性广等特点。
1.1.2 供试药剂
EMS诱变剂(甲基磺酸乙酯)购于美国Sigma公司,为无色溶液(区别于其公司生产的固体EMS诱变剂)。
1.2 方法
1.2.1 EMS配制方法
EMS诱变剂采用pH 7磷酸缓冲液配制而成[16]。
1.2.2 EMS处理方法
EMS处理西瓜种子过程如下:将W1-17西瓜种子用指甲刀切口后,100粒为1次重复;在通风橱中浸入20 mL不同浓度EMS溶液中,以磷酸缓冲液浸种为对照,然后在28℃摇床上分别震荡3、6、9、12 h;浸种结束后,在通风橱中每个处理加入1 mol·L-1硫代硫酸钠(Na2S2O3)10 mL,混匀后,将溶液倒掉;然后加入20 mL 100 mmol·L-1硫代硫酸钠(Na2S2O3),轻摇5 min,将溶液倒掉,再用100 mmol·L-1Na2S2O3洗3遍;加入20 mL蒸馏水轻摇5 min,将溶液倒掉,用水洗3遍;将种子平铺在湿润滤纸上,稍干后,28℃培养箱内催芽。
1.2.3 EMS对西瓜品系W1-17种子最佳诱变处理条件的确定
1.2.3.1 催芽方法和发芽率测定
EMS诱变处理后,将各组种子分组包在湿润的纱布中,将纱布做好标记后,整齐摆放在铺有湿毛巾的培养盘中,盖上湿毛巾后,28℃培养箱内催芽,每隔12 h清洗种子和毛巾,观察并记录种子发芽情况。发芽以种子露白2 mm为标准,共催芽7 d,随后将种子播种在温室的培养钵中。
1.2.3.2 测定出苗率、成苗率的指标和方法
播种后每天观察植株萌发情况,只要有1个重复发现种子萌发即为该处理的起始萌发时间,萌发标准是子叶顶出土层1.5 cm。种子萌发后,需要每天早上统计每个处理出苗数,计算出苗率,20 d后计算相对出苗率,40 d后计算成苗率和相对成苗率。
计算公式如下:
出苗率(%)=(出苗总数/供试种子数)×100%;
成苗率(%)=(成活苗总数/供试种子数)×100%;
相对出苗率(%)=(处理的出苗率/对照出苗率)×100%;
相对成苗率(%)=(处理的成苗率/对照成苗率)×100%。
1.3 数据处理
研究组的血钙浓度恢复正常时间指标(3.24±1.45)天显著短于参照组(4.54±1.04)天,统计学有差异(t=5.736,P<0.05)。
数据处理采用DPS 7.05统计软件完成,采用Microsoft Excel 2003软件进行平均值和作图分析。
2 结果与分析
2.1 EMS诱变对西瓜W1-17种子发芽率的影响
2.1.1 EMS不同诱变时间处理对西瓜“W1-17”种子发芽率的影响
由图1可知,在同一EMS浓度下,西瓜“W1-17”发芽率随诱变时间延长而逐渐降低。浓度为0.2%,诱变3 h时种子发芽率为99.33%,诱变12 h时发芽率降为92.33%,降幅为7%;浓度分别为0.6%、1.0%和1.4%时,处理12 h的种子发芽率比处理3 h时分别下降11.66%、23.00%和33.34%;浓度为1.8%诱变12 h时,发芽率仅为14.33%,比同一浓度诱变3 h时,下降51.34%。

图1 不同EMS浓度对西瓜“W1-17”种子发芽率的影响Fig.1Effect of different EMS concentration on germination rate of watermelon"W1-17"
以上结果说明,EMS对西瓜种子发芽率有明显抑制效应,可以用于对西瓜突变体的诱变,在同一浓度EMS诱变条件下,随处理时间延长,种子发芽率逐渐降低;且EMS浓度越高,诱导时间对发芽率的影响越显著。
2.1.2 EMS不同诱变浓度处理对西瓜“W1-17”发芽率的影响
由表1和图2可知,当EMS诱变时间一定时,随EMS浓度增加,不同处理西瓜种子发芽率锐减。EMS诱变处理3 h时,0.2%EMS处理种子发芽率为99.33%,而1.8%EMS处理发芽率为65.67%,下降34.33%;诱导6和9 h时,由0.2%EMS处理到1.8%EMS处理发芽率分别下降46.67%和77.67%;诱导12 h时,发芽率下降幅度为85%。说明同一诱变时间处理下,随EMS浓度增加,种子发芽率显著降低,EMS浓度越高对发芽率抑制作用越显著。
由表1和图3可知,当EMS诱变浓度一定时,随EMS诱变时间增加,各处理西瓜种子发芽率递减。EMS诱变浓度为1.0%时,处理3 h的种子发芽率为82.67%,处理12 h的种子发芽率为59.67%,下降23%;EMS诱变浓度为1.8%时,处理3 h的种子发芽率为65.67%,处理12 h的种子发芽率为14.33%,下降51.34%。说明同一诱变浓度处理下,随EMS诱变时间增加,种子发芽率显著降低。
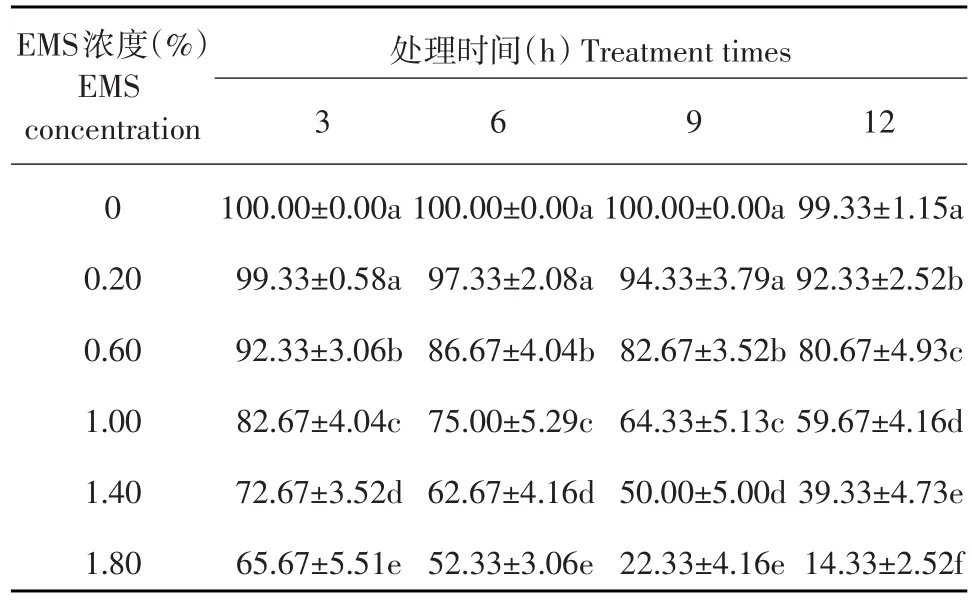
表1 不同EMS处理组合对西瓜“W1-17”种子发芽率的影响Table 1Effect of different EMS disposal ways on germination rate of watermelon"W1-17"seeds
2.2 EMS诱变对西瓜“W1-17”相对出苗率和成苗率的影响
将上述发芽试验中各处理种子播种于园艺实验中心1号温室,观察出苗率,在成苗定植前,再观察各处理成苗率。根据两数据分别计算相对出苗率和相对成苗率(见表2)。
由表2可知,EMS处理对西瓜“W1-17”相对出苗率和相对成苗率有一定抑制作用,且随处理浓度加大抑制作用增强。EMS处理浓度>1.0%时,随处理时间延长抑制作用增强。当EMS>1.0%,处理时间>6 h时,各组合相对出苗率显著低于对照(P<0.05),当EMS<1.0%,处理时间低于6 h时,各处理相对出苗率和对照相比无显著差异。相对成苗率也表现出相似规律,1.0%~1.8%EMS处理6、9、12 h组合相对成苗率显著低于对照(P<0.05),其余处理与对照差异不显著。
EMS诱变对西瓜相对出苗率和成苗率的影响在不同处理时间、浓度组合互作上差异显著(P<0.05),表明西瓜对EMS处理存在敏感性,各处理组合不是单因素简单相加,只有在合适浓度和时间组合下才能得到适宜处理条件。其中,1.0%EMS浸种9 h相对出苗率为58.67%,相对成苗率为49.18%,接近半致死剂量。因此,此组合可确定为西瓜“W1-17”种子发生诱变的最佳EMS剂量组合。

图2 EMS处理时间一定时西瓜“W1-17”种子发芽率的降幅Fig.2Decline of watermelon"W1-17"germination rate under different EMS treatment time

图3 EMS浓度一定时西瓜“W1-17”种子发芽率的降幅Fig.3Decline of watermelon"W1-17"germination rate under different EMS concentration

表2 不同EMS处理对西瓜种子“W1-17”相对出苗率的影响Table 2Effects of EMS on the relative seedling emergence rate of watermelon"W1-17"seeds under different times
3 讨论与结论
目前使用化学方法诱发植物基因突变进行种质创新已成为植物育种有效手段,选择适宜化学诱变剂对于获得理想诱变结果非常重要。在所有化学诱变剂中,EMS作为高效、稳定的化学诱变剂,拥有诱变效率高、频率高和范围广优点[17-18]。除此之外,EMS诱变产生点突变的频率较高,染色体畸变相对较少,可对作物某一性状进行改良。因此,EMS诱变构建的突变群体在基因功能研究上具有独特优势[19]。近年来,EMS被广泛用于多种作物诱变育种[20-21],但EMS诱变西瓜育种研究未见报道。研究发现,诱变试验中确定最佳诱变条件是关键[22]。本试验设计5个浓度梯度(0.2%、0.6%、1.0%、1.4%和1.8%)和4个时间(3、6、9和12 h)组合,通过对西瓜W1-17种子发芽率[23]、相对出苗率、相对成苗率进行综合分析,以确定最佳EMS剂量处理条件。
EMS是构建突变体育种的重要手段,诱变条件选择最为关键[24]。本试验发现,1.8%6 h组合、1.0%9 h组合、1.4%9 h组合、1.0%12 h组合发芽率均接近50%;随浓度增大,发芽率逐渐降低;浓度对发芽率影响比时间的影响大;通过试验证实,在不同浓度和时间处理下,发芽率呈现不同下降趋势,对于浓度选择具有重要意义。
现代分子生物学技术将EMS化学诱变技术同分子标记技术结合用于突变位点和遗传信息定位[25],可定向改变西瓜性状,获得理想育种材料和培育新品种。西瓜“W1-17”诱变后代的诱变效应及突变体筛选等研究仍处于探索阶段,有些诱变机理尚未完全明确。因此,有必要从细胞学、分子生物学和生理生化等方面继续深入探究诱发突变机理[26],分析后代不同变异类型遗传规律和发生频率,结合分子标记及其他生物标记技术,提高筛选准确性和突变体利用效率,构建饱和突变体库。
[1]Laudencia-Chingcuanco D.Isolation and characterization of EMS-induced Dy10 and Ax1 high molecular weight glutenin subunit deficient mutant lines of elite hexaploid wheat(Triticum aestivum L.)cv.[J].Journal of Cereal Science,2012,56(2):296-299.
[2]Hirano T,Kazama Y,Ohbu S,et al.Molecular nature of mutations induced by high-LET irradiation with argon and carbon ions in Arabidopsis thaliana[J].Mutation Research-Fundamental and Mo⁃lecular Mechanisms of Mutagenesis,2012,735(1-2):19-31.
[3]Vicente-Dolera N,Pinillos V,Moya M.et al.An improved meth⁃od to obtain novel mutants in Cucurbita pepo by pollen viability [J].Scientia Horticulturae,2014,169:14-19.
[4]Galpaz N,Burger Y,Lavee T.et al.Genetic and chemical charac⁃terization of an EMS induced mutation in Cucumis melo CRTISO gene[J].Archives of Biochemistry and Biophysics.2013,539(2): 117-125.
[5]Viccini L F,Silveira R S,do Vale A A.et al.Citral and linalool content has been correlated to DNA content in Lippia alba(Mill.) NE Brown(Verbenaceae).[J].Industrial Crops and Products, 2014,59:14-19.
[6]Greene E A,Codomo C A,Taylor N E.et al.Spectrum of chemi⁃cally induced mutations from a large-scale reverse-genetic screen in Arabidopsis[J].Genetics,2003,164(2):731-740.
[7]黄雅琼.一个用于研究根尖生长素回流过程的拟南芥EMS突变体库的构建与筛选分析[D].武汉:华中农业大学,2013.
[8]蔡海燕.EMS诱导菊花突变体库的构建和光周期不敏感突变体的分子鉴定[D].泰安:山东农业大学,2013.
[9]徐艳花,陈锋,董中东,等.EMS诱变的普通小麦豫农201突变体库的构建与初步分析[J].麦类作物学报,2010(4):625-629.
[10]樊双虎,郭文柱,路小铎,等.玉米EMS突变体库构建及突变体初步鉴定[J].安徽农业科学,2014(11):3162-3165,3185.
[11]谢圣男,王宏光,杨振,等.大豆绥农14突变体库构建及株高性状分析[J].核农学报,2013,27(3):307-313.
[12]张娜.燕麦EMS突变体库的建立及β-葡聚糖合成关键基因AsCsLF6的Tilling分析[D].杨凌:西北农林科技大学,2011.
[13]曲高平,孙妍妍,庞红喜,等.甘蓝型油菜EMS突变体库构建及抗除草剂突变体筛选[J].中国油料作物学报,2014(1):25-31.
[14]张凤启.利用EMS诱变构建甘蓝型油菜突变体库的初步研究[D].南京:南京农业大学,2010.
[15]宋佳静.花生突变体库的构建及APETALA2基因的表达分析[D].郑州:河南农业大学,2013.
[16]张兵.EMS诱导黄瓜突变体的初步研究[D].泰安:山东农业大学,2012.
[17]叶俊,吴建国,杜婧,等.水稻“9311”突变体筛选和突变体库构建[J].作物学报,2006(10):1525-1529.
[18]蔡光泽.激光诱变小麦生育期性状和穗部性状的生物学效应研究[J].激光生物学报,2003(4):254-258.
[19]史桂荣.化学诱变剂在玉米育种上的应用[J].黑龙江农业科学,1994(6):44-46.
[20]安学丽,蔡一林,王久光,等.化学诱变及其在农作物育种上应用[J].核农学报,2003(3):239-242.
[21]梁任繁,何龙飞.EMS在作物育种应用中的研究进展[J].种子, 2008(2):47-49.
[22]骆海波,邹颉,贺从安,等.甲基磺酸乙酯(EMS)对萝卜早期发育性状的诱变效应[J].基因组学与应用生物学,2013(5):608-611.
[23]袁小环,武菊英,杨学军,等.基于半致死浓度的观赏草萌发期和幼苗期耐盐性评价[J].中国草地学报,2012(6):49-53.
[24]Wang J G,Guo Y,Che D D.RAPD analysis of M1generation of gladiolus hybridus hort treated by EMS[J].Journal of Northeast Agricultural University:English Edition,2009(1):5-9.
[25]Gong S F,Fu H J.ISSR Analysis of M1generation of gladiolus hy⁃bridus hort treated by EMS[J].Journal of Northeast Agricultural University:English Edition,2010(2):22-26.
[26]王长里,付晶,杨学举.EMS诱导小麦突变体的研究及展望[J].安徽农业科学,2008,36(19):8038-8039.
Analysis of EMS mutation conditions of watermelon seed
WANG Xuezheng1,2,
ZHU Nana1,2,GAO Qingyu3,LIU Lu1,2,ZHANG Yanan1,2,LUAN Feishi1,2(1.School of Horticulture, Northeast Agricultural University,Harbin 150030,China;2.Ministry of Agriculture Key Laboratory of Biology and Germplasm Enhancement of Horticultural Crops in Northeast China,Harbin 150030,China;3.Philosophy School,Heilongjiang University,Harbin 150080,China)
This paper took the"W1-17"watermelon cultivar as material,this material was from the Northeast Agricultural University Watermelon and Muskmelon Breeding Research Laboratory,using EMS as mutagen,using five EMS mutagenesis concentration(0.2%,0.6%,1.0%,1.4%,1.8%),four processing time (3,6,9 and 12 h),analyzed the germination rate,relative germination rate,relative seedling rate after different treatment,finally determined the concentration of EMS 1%,9 h was the optimum conditions of watermelon strain"W1-17"seeds.
watermelon;chemical mutagenesis;EMS
S651
A
1005-9369(2015)07-0035-05
时间2015-7-9 14:42:20[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150709.1442.001.html
王学征,朱娜娜,高清宇,等.EMS诱变西瓜种子条件分析[J].东北农业大学学报,2015,46(7)∶35-39.
Wang Xuezheng,Zhu Nana,Gao Qingyu,et al.Analysis of EMS mutation conditions of watermelon seed[J].Journal of Northeast Agricultural University,2015,46(7)∶35-39.(in Chinese with English abstract)
2015-01-04
国家自然科学基金项目(31372088);国家西甜瓜现代产业技术体系项目(CARS-026-02)
王学征(1978-),女,教授,博士,研究方向为西瓜甜瓜遗传育种。E-mail:xz6206815@163.com
