酵母发酵马铃薯淀粉废弃物产单细胞蛋白的能力强化
2015-07-05张立宏冯丽平史春辉王震宇张广洋
张立宏,冯丽平,史春辉,王震宇,张广洋,
柏英1,宋金柱1,曹广丽1,杨谦1,3*
酵母发酵马铃薯淀粉废弃物产单细胞蛋白的能力强化
张立宏1,冯丽平1,史春辉2,王震宇1,张广洋1,
柏英1,宋金柱1,曹广丽1,杨谦1,3*
(1.哈尔滨工业大学生命科学与技术学院,哈尔滨150001;2.黑龙江省食品药品检验检测所,哈尔滨150088;3.城市水资源与水环境国家重点实验室,哈尔滨工业大学,哈尔滨150090)
以马铃薯生产淀粉产生废弃物为发酵培养基,选用酿酒酵母(Saccharomy cescerevisiae)与产朊假丝酵母(Candida utilis)为原始菌株,经紫外诱变后,筛选出两株蛋白产量显著提高并遗传稳定的突变株:S57和U112,蛋白产量均为8.43 g·L-1。将两种菌种混合比例设定为1∶1,按照1%(V/V)进行接种,在葡萄糖浓度为35 g·L-1培养基中对两株菌种进行共培养,利用响应面分析法对其发酵产蛋白能力进行优化,研究pH、温度及转速。对结果进行分析,确定在培养基初始pH 7.7,培养温度为27.7℃且转速为187 r·min-1时,蛋白产量达到理论最大值,为9.02 g·L-1。验证试验显示,蛋白产量达到(9.19±0.05)g·L-1,证明模型可信,COD去除率达到80%。
酿酒酵母;产朊假丝酵母;马铃薯淀粉废弃物;SCP;强化生物转化
张立宏,冯丽平,史春辉,等.酵母发酵马铃薯淀粉废弃物产单细胞蛋白的能力强化[J].东北农业大学学报,2015,46(7)∶9-15.
Zhang Lihong,Feng Liping,Shi Chunhui,et al.Strengthen bioconversion of potato starch waste into single-cell protein with fermentation bySaccharomyces[J].Journal of Northeast Agricultural University,2015,46(7)∶9-15.(in Chinese with English abstract)
利用马铃薯生产淀粉过程中,产生大量薯渣和汁水[1],薯渣中含有丰富纤维素和半纤维素等碳源,汁水中含有丰富的粗蛋白物质和氨基酸等氮源,两者营养组分齐全[2-3]。将其排放到环境中,不但是对营养物质的浪费,还可能引发环境问题。Suzuki等研究以薯渣为原料,采用微生物液体和固体发酵生产动物饲料、酒精等,效果显著[4-5]。Krzywonos等研究者致力于汁水处理[6-7],但建设汁水处理系统昂贵。通过微生物发酵方式将淀粉生产过程中产生马铃薯薯渣和汁水转化为有益能源[8]、食物[9]和单细胞蛋白等,对解决环境污染、食物短缺和能源危机具有重要意义[10]。
哈尔滨工业大学生物工程中心研究出一种马铃薯薯渣液态发酵(薯渣+汁水)生产单细胞蛋白新工艺,该工艺通过纤维素降解真菌和产蛋白酵母等微生物发酵工程技术获得粗蛋白含量超过42%的高品质蛋白质饲料,同时把70%以上的SO42-转化为含硫氨基酸,SO32-去除率达到100%。目前,该工艺方法已成功通过中试,即将应用于通河县淀粉厂[11]。
为进一步优化该工艺方法,提高马铃薯薯渣汁水蛋白质微生物转化能力,本研究选用酿酒酵母(Saccharomy cescerevisiae)与产朊假丝酵母(Candida utilis)为原始菌株,对其进行紫外诱变以获得单细胞蛋白产量较高的突变菌株,应用中心组合设计和响应面分析法进一步优化其发酵工艺参数。丰富工业菌种资源,为更好工业化处理马铃薯薯渣汁水生产单细胞蛋白饲料奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株
野生型酿酒酵母(Saccharomy cescerevisiae)及突变株S57(由野生型酿酒酵母紫外诱变获得),野生型产朊假丝酵母(Candida utilis)及突变株U112(由野生型产朊假丝酵母紫外诱变获得),由哈尔滨工业大学生物工程中心筛选、诱变,保存。
1.1.2 培养基
YPD培养基(液、固),分别用于菌液活化及诱变。
3%马铃薯薯渣汁水,为菌种发酵培养基。方法参见文献[12]。
1.2 方法
1.2.1 酿酒酵母和产朊假丝酵母生长曲线测定
分别从平板中挑取两株酵母菌,接种于装有50 mL YPD培养液三角瓶中,28℃,180 r·min-1活化24 h作为种子液。将种子液按1%(V/V)比例分别接种于3个装有50 mL YPD培养液三角瓶中,按照同样方式进行培养,每隔2 h取样,测定其OD600(以未接种菌种YPD培养液为空白对照),绘制出两种酵母生长曲线。在后续试验中,接种时均使用处于对数生长期菌种,将对数期菌液OD600稀释为1.0,并用血球计数板计数。
1.2.2 酿酒酵母和产朊假丝酵母紫外诱变、筛选及稳定性检测
将种子液稀释至10-5,于灭菌平皿中铺匀,放在超净台内进行紫外照射处理(25 W,253 nm,40 cm),照射时间设定为0、0.15、0.30、0.50、0.65、0.80、1 h。每个培养皿取0.2 mL紫外照射后菌液,分别涂布YPD平板,28℃培养48 h,菌落计数,获得最佳紫外诱变时间,观察结果并选取生长情况较好菌落进行蛋白产量测定试验。
首先对筛选出的突变菌株进行活化,接种于优化过的培养基中发酵72 h,测定发酵产物中精蛋白含量,产量明显增加菌种将用于下一步试验。本文对该试验稍作改进,采用酶标仪对发酵液中精蛋白含量进行测量,将产量显著提高的突变菌株连续传代培养10次,每一代菌株均进行发酵试验,对发酵液成分进行测定和比较,评定各菌株稳定性,筛选出目标菌株进行后续试验。
1.2.3 酿酒酵母和产朊假丝酵母突变菌株混合发酵工艺参数优化
将获得的两个目标菌株进行混合培养,采用Plackett-Burman设计法、中心组合设计和响应面分析法对最优发酵条件进行研究[13-14]。
1.2.4 微生物蛋白转化能力测定
精蛋白及蛋白质转化率测定参见文献[9]。
1.2.5 COD测定
COD(化学需氧量)测定及计算参考文献[15],测定基本培养基均为原始马铃薯薯渣汁水培养基,考查对象分别为两种原始酵母分别单独培养,两种诱变菌株分别单独培养,使用优化后条件进行两种诱变株共培养。计算各种情况COD去除率并进行比较,观察有机氮去除与COD去除间关系。
2 结果与分析
2.1 酿酒酵母和产朊假丝酵母生长曲线
根据测得的OD600绘制两株酵母菌生长曲线,如图1所示。
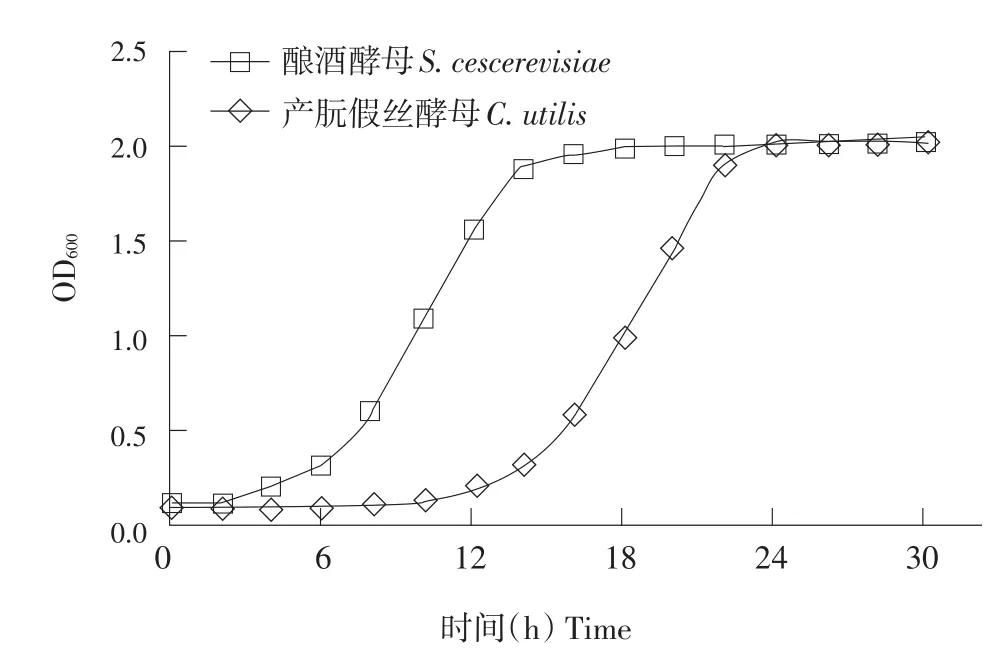
图1 酿酒酵母和产朊假丝酵母生长曲线Fig.1Growth curves of S.cerevisiae and C.utilis
由生长曲线可见,酿酒酵母培养前4 h为调整期,4 h后进入对数生长期,14、15 h后进入稳定期,后续试验选用培养10 h菌液。产朊假丝酵母较前者生长较慢,培养前12 h为调整期,然后进入对数生长期,24 h后菌种生长进入稳定期,后续试验选用培养20 h菌液。试验时应保证接种量一致,接种前应使用无菌蒸馏水将两种菌液OD600均调节为1.0,活菌计数显示细胞浓度约为108个·mL-1。
2.2 两种酵母的诱变筛选
2.2.1 紫外诱变
紫外照射后每个平皿中吸取0.2 mL菌液,涂布YPD平板,菌落长出后通过菌落计数方式找到最优照射时间梯度。结果见图2,酿酒酵母在照射0.3 h时致死率约为90%,产朊假丝酵母在照射0.5 h时致死率约为90%。突变菌株将在照射0.3 h的酿酒酵母平板和0.5 h的产朊假丝酵母平板中挑取筛选。
2.2.2 高产蛋白菌种的筛选
将诱变获得的突变菌株活化后接入马铃薯薯渣汁水培养基中进行发酵,72 h后利用双缩脲反应测定精蛋白含量。菌株S57、S68、S107与U85、U112、U200均为单细胞蛋白产量显著提高突变菌株,蛋白产量见表1。结果表明,紫外诱变是获得蛋白产量较高突变酵母菌株的有效方法,对工业生产菌种筛选有重要意义。
2.2.3 诱变菌株稳定性
经诱变获得的菌株需要测定其生长稳定性及产蛋白能力稳定性,将突变菌株S57、S68、S107与U85、U112、U200连续培养10代,以精蛋白含量为参考指标来评定其稳定性,结果见图3、4。
图2 紫外诱变前后酿酒酵母和产朊假丝酵母菌落生长情况对比Fig.2Comparison of clones growth situation before and after mutation of S.cerevisiae and C.utilis
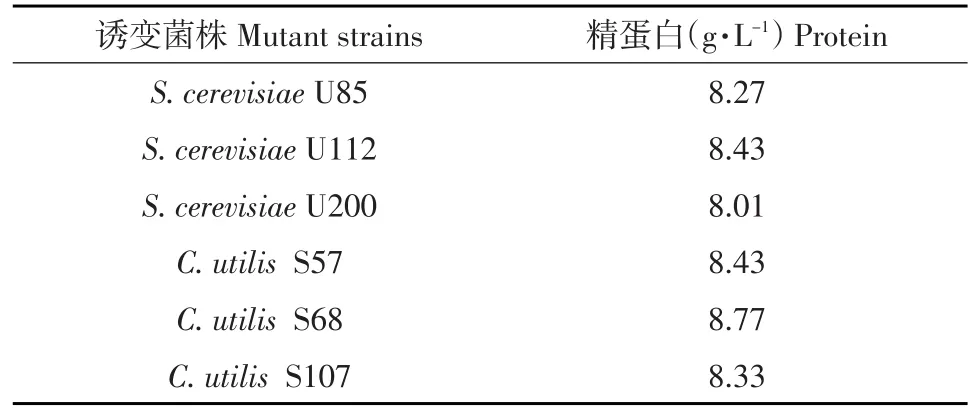
表1 各突变酵母菌株精蛋白产量Table 1Mutant strains with protein yield
如图3所示,菌株S57遗传稳定性良好,其余菌株随培养代数增加精蛋白含量呈现下滑趋势,遗传稳定性较差,因此S57被选为试验菌株。
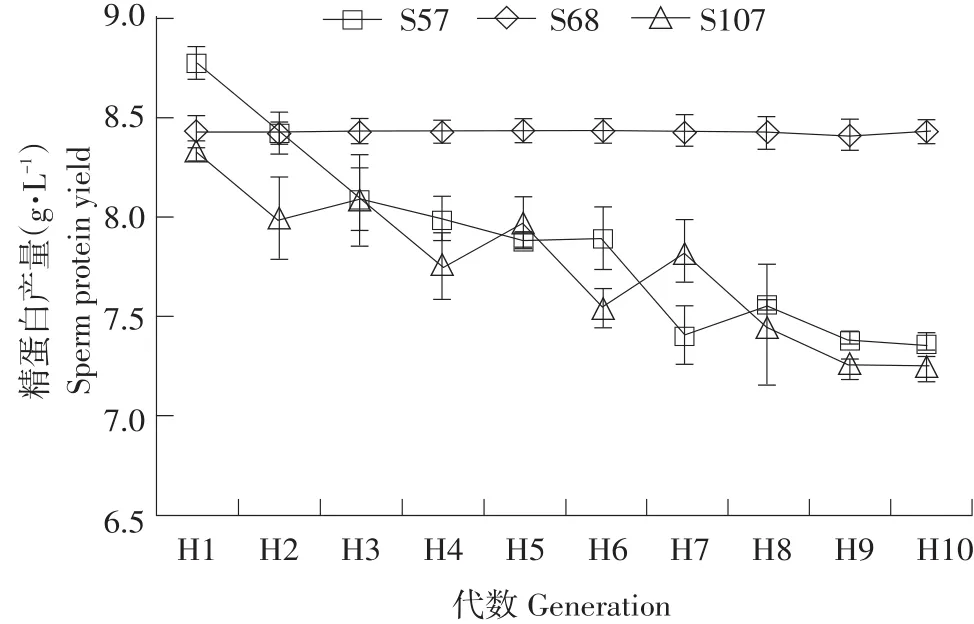
图33 株酿酒酵母突变菌株稳定性分析Fig.3Stability analysis of three mutant strains of S.cerevisiae
如图4所示,菌株U85在传代培养过程中精蛋白产量波动较大,而U112和U200稳定性强,考虑U112所产精蛋白含量高于U200,所以选取U112为下一步试验对象。
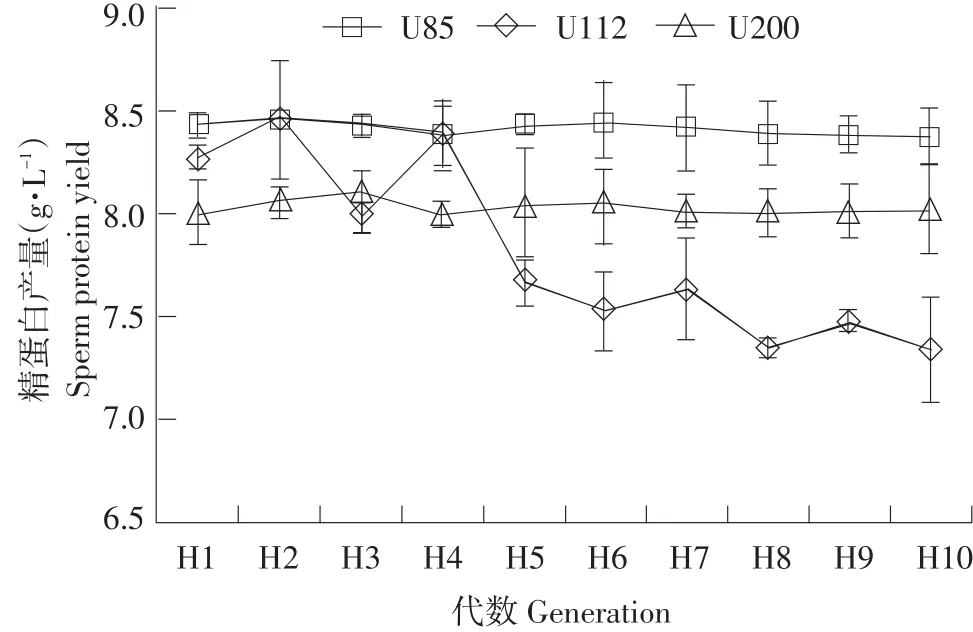
图43 株产朊假丝酵母突变菌株稳定性分析Fig.4Stability analysis of three mutant strains of C.utilis
2.3 S57和U112共培养发酵条件优化
将S57和U112共培养发酵马铃薯薯渣汁水培养基,并优化其发酵工艺参数,达到提高蛋白产量和质量目的。
2.3.1 Plackett-Burman设计法筛选重要因素
根据两种酵母生长和发酵特性以及前人和本实验室研究成果设计试验因素及水平,选择温度(℃)、初始pH、混菌比例,接种量(%)、葡萄糖质量分数(%)、转速(r·min-1)作为Plackett-Burman(PB)试验设计的6个因素,分别是F1、F2、F3、F4、F5、F6,每个因素分别取高低2个水平,响应值R为发酵上清液双缩脲反应的OD540。为保证试验准确,每组试验重复3次,结果见表2。对上述试验结果做t检验,分析各因素主效应结果见表3。见,转速对整体试验影响小于初始pH和培养温度,符合PB试验结果。根据上述三元二次回归方程求解得:X1=7.70,X2=187.11,X3=27.70,在初始pH 7.7,摇床转速187.1 r·min-1,发酵温度27.7℃时,混菌共培养发酵得到的单细胞蛋白产量达到最高理论值9.02 g·L-1,OD540为2.08。
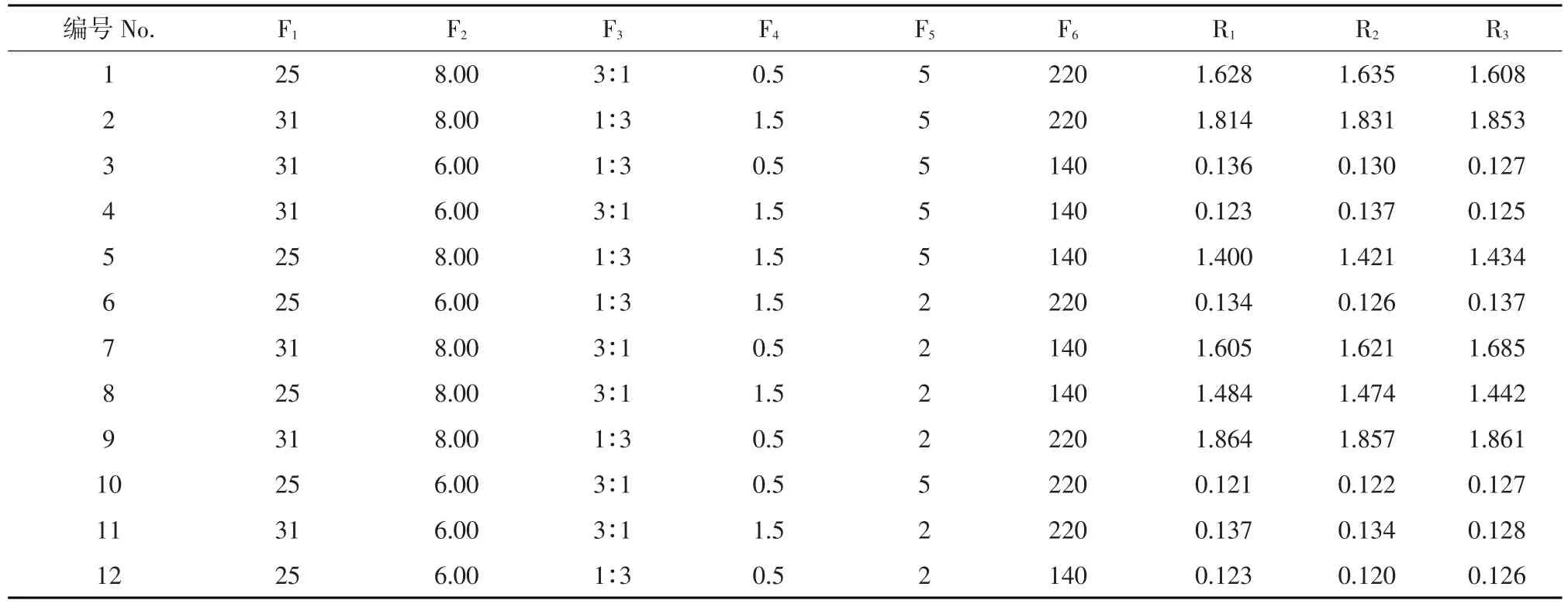
表2 PB试验设计与结果Table 2Experimental design and responses of PB design
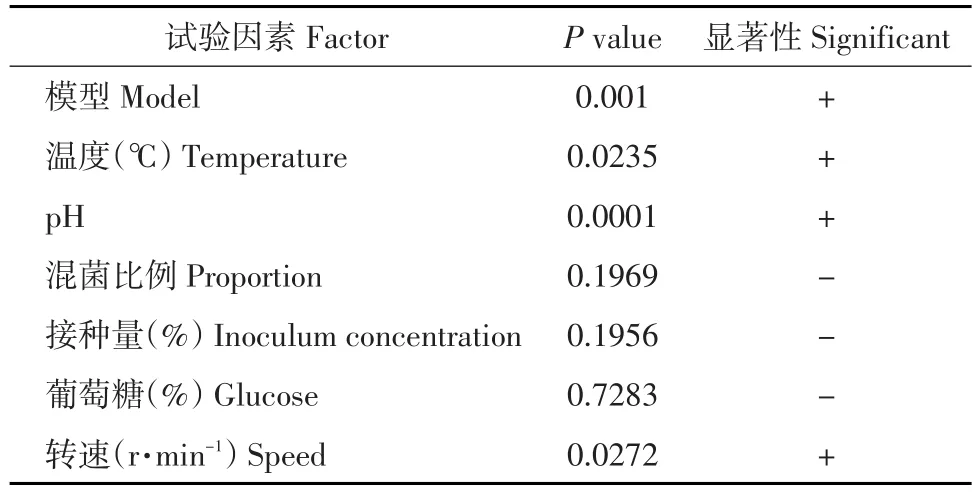
表3 各因素影响的主效应分析Table 3Main effects of six factors for PB design

表5 Central Composite Design试验设计与结果Table 5Experimental design and response of Central Composite Design
由表3可知,两株突变酵母菌株共培养发酵的PB试验设计模型整体P<0.01,整个模型呈极显著。其中,发酵温度、初始pH和转速影响最为显著,显著性排列为初始pH>发酵温度>转速,可作为进一步优化的因素。
2.3.2 应用响应面分析法确定重要因素的最佳水平
Plackett-Burman试验设计筛选确定3个重要因素,即发酵温度,初始pH与转速。将3个因素分别作为a、b、c,根据Central Composite Design中心组合设计试验,设计及结果见表4与表5。其余发酵条件不是发酵过程中的显著影响因子,因此设定为固定值。
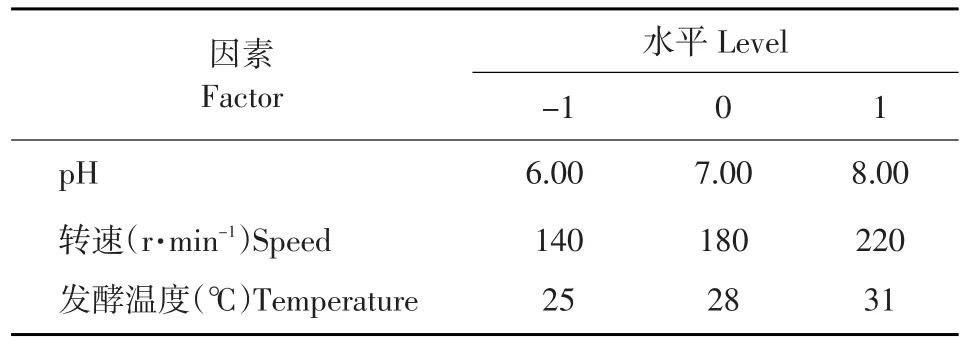
表4 响应面因素水平Table 4Factors and levels in RSM
根据表5试验结果,通过Design Expert软件分析得到确定混菌发酵的初始pH、转速及发酵温度回归方程,Y=0.183+0.47X1+0.077X2-
其中,X1、X2、X3分别代表pH、转速(r·min-1)、发酵温度(℃)。
整个模型P=0.0001,可信度>99%,因此响应面分析法的模型可信。复相关系数R2=0.9564,校正决定系数R2=0.9171,说明方程拟合较好。可
通过软件分析可得到有关发酵因子两两之间相互影响情况的三维图形,可直观观察到发酵模型中所设发酵条件变化对发酵体系的影响。
如图5(a)所示,当pH处于较低状态时,菌体蛋白基本不生长,之后菌体蛋白产量随pH升高而提高,到达一定程度后因pH过大导致细胞活性受到影响,蛋白产量不再提高。从图5(b)可看到,当温度处于一定范围内时,混菌发酵生产的菌体蛋白产量会随温度升高而提高,超过某一值后产量下降。如图5(c)所示,当摇床处于较低转速时,蛋白产量会随转速提高而升高,摇床转速超过187 r·min-1时,蛋白产量不增加反而下降,说明在发酵过程中因转速变化产生的溶氧变化对发酵效果产生很大影响。
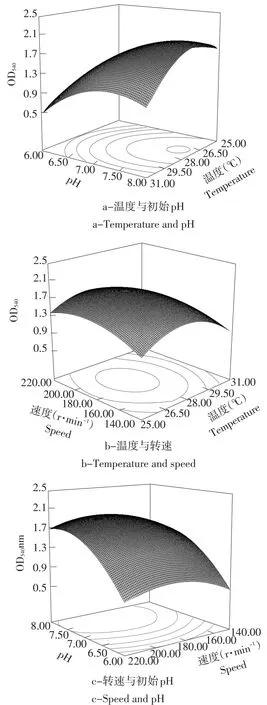
图5 各因素交互作用对共培养发酵生产单细胞蛋白产量影响Fig.5Response surface plots showing the interactive effects of every two factors on SCP yield with coculture
2.3.3 验证试验
在最优发酵条件温度27.7℃,pH 7.70,转速187 r·min-1发酵体系下,将两株突变酵母菌株共培养发酵马铃薯薯渣汁水培养基,发酵后测定发酵液中菌体蛋白产量,结果为(9.19±0.05)g·L-1(N= 5)。与方程求得的理论最大值9.02 g·L-1相比略高,处于可接受范围内,说明响应面法确定最佳发酵条件的准确性与可行性。
2.4 各发酵液COD的测定
对于发酵结果的评价,COD是重要参考标准。分别测定未处理马铃薯薯渣汁水培养基(对照)、酿酒酵母和产朊假丝酵母单独发酵液,诱变后S57和U112单独发酵液,利用响应面法优化后S57和U112共同培养发酵液COD值,结果见图6。优化后S57和U112共同培养发酵液对比原始汁水COD去除率达到80%。
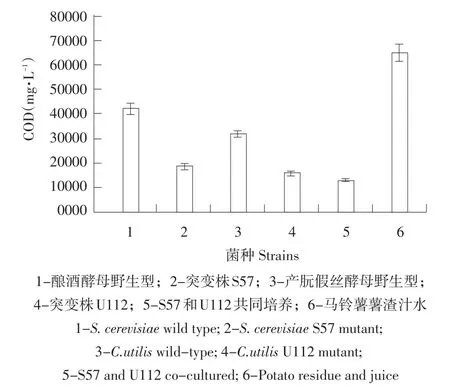
图6 各菌株发酵薯渣汁水培养基的发酵液COD测定Fig.6COD of potato starch waste fermentation product with different strains treatment
3 讨论与结论
哈尔滨工业大学生物工程中心已成功研究出一种马铃薯薯渣液态发酵(薯渣+汁水)生产单细胞蛋白的新工艺,不仅可以利用黑曲霉和木霉有效处理薯渣中的纤维素和半纤维素,可有效利用酵母将汁水中的糖和有机物质(粗蛋白和氨基酸)转化为单细胞蛋白[11]。为提高单细胞蛋白产量,利用紫外诱变获得酵母优势突变菌株是有效手段。经过紫外诱变后,获得酵母优势突变菌株S57和U112,蛋白产量均为8.43 g·L-1,和原始菌株相比有明显提高。在试验过程中发现,S57和U112原始菌株酿酒酵母和产朊假丝酵母对数生长期不一致,分别为4~14 h和12~22 h,制作种子液时要考虑到两株菌种的生长差异,在试验时两株菌种才能处于同样生长状态。
Schultz等研究表明,使用多种微生物共同发酵生产单细胞蛋白营养更全面[16],产朊假丝酵母一直被作为单细胞蛋白生产的主要菌种,经试验研究发现,利用酿酒酵母和产朊假丝酵母共同发酵马铃薯薯渣汁水不仅可大幅提高蛋白产量,发酵产物会有淡淡酒香,促进动物食欲,大幅增加饲料适口性,提高饲料品质。本研究采用Plackett-Burman试验设计和响应面分析法优化酵母突变株S57和U112混合发酵马铃薯薯渣汁水培养基产单细胞蛋白的发酵工艺参数,影响显著因素为初始pH>发酵温度>转速,得到最佳发酵条件为初始pH 7.70,转速187 r·min-1,发酵温度27.7℃。产朊假丝酵母与酿酒酵母比例为1∶1,葡萄糖添加浓度为35 g·L-1,接种量控制在1%时,理论计算得到的最大菌体蛋白产量为9.02 g·L-1,经试验验证,得到菌体蛋白产量为(9.19±0.05)g·L-1,发酵液对于原始汁水COD去除率为80%。试验证明,S57和U112混合培养发酵马铃薯薯渣汁水培养基的产蛋白量优于单个菌种发酵,使最终得到的发酵产物具有酒香,COD去除率也达国家排放标准,证明两株各具优势的菌株经过混合培养对马铃薯薯渣汁水进行发酵处理是可行的有效途径。
本研究以马铃薯薯渣和汁水混合物为培养基,与以往只针对薯渣或汁水的研究相比,解决了薯渣中氮源较低问题,更进一步解决了汁水污染问题[4-7]。本研究通过优化两株突变酵母共培养发酵的工艺参数,提高蛋白产量和质量。通过紫外诱变强化酵母的生物转化能力以达到提高蛋白产量和质量目的,为提高马铃薯薯渣汁水的生物转化提供新角度(和传统发酵条件优化相比),可丰富工业菌种资源。后续研究可通过提高纤维素和半纤维素降解,为发酵提供足够的还原糖改善发酵工艺。
[1]Mayer F,Jan-Otto H.Potato pulp:Microbiological characteriza⁃tion,physical modification,and application of this agricultural waste product[J].Applied Microbiology and Biotechnology,1997 (4).435-440.
[2]张向东,杨谦,余佳,等.利用短小芽孢杆菌发酵马铃薯渣生产单细胞蛋白饲料的研究[J].东北农业大学学报,2011,42(5):26-30.
[3]Liu B N,Song J Z,Li Y,et al.Towards industrially feasible treat⁃ment of potato starch processing waste by mixed cultures[J].Appl Biochem Biotechnol,2013,171(4):1001-1010.
[4]Suzuki S,Fukuoka M,Tada S,et al.Production of cellulose 123 author's personal copy polygalacturonase by recombinant Aspergil⁃lusoryzaein solid-state fermentation using potato pulp[J].Food Sci Technol Res,2010,16(5):517-521.
[5]Li J Z,Zhang P,Bao L X,et al.Yeasts for single-cell protein pro⁃duction by soybean whey fermentatio[J].Journal of Harbin Insti⁃tute of Technology,2009(2):12.
[6]Krzywonos M,Cibis E,Lasik M,et al.Thermo-and mesophilic aerobic batch biodegradation of high-strength distillery wastewa⁃ter(potato stillage)—utilisation of main carbon sources[J].Biore⁃sour Technol,2010,100(9):2507-2514.
[7]Lasik M,Nowak J,Krzywonos M,et al.Impact of batch,repeat⁃ed-batch(with cell recycle and medium replacement)and contin⁃uous processes on the course and efficiency of aerobic thermophil⁃ic biodegradation of potato processing wastewater[J].Bioresour Technol,2010,101(10):3444-3451.
[8]Hashem M,Soumia M,Darwish I.Production of bioethanol and as⁃sociated by-products from potato starch residue stream by Saccha⁃romyces cerevisiae[J].Biomass and Bioenergy,2010,34(7):953-959.
[9]王文侠.马铃薯渣酶法水解液制备单细胞蛋白饲料的研究[J].中国饲料,2005(6):33-35.
[10]Liu B G,Li Y,Yang Q,et al.Production of single-cell protein with two step fermentation for treatment of potato starch process⁃ing waste[J].Cellulose,2014,21(5):3637-3645.
[11]杨谦,张向东,宋金柱,等.马铃薯薯渣液态发酵生产单细胞蛋白的工艺方法[P].中国,200810064422.X,2008.
[12]李莹.薯渣饲料中增加赖氨酸含量的工艺及相关生物信息学分析[D].哈尔滨:哈尔滨工业大学,2011:9.
[13]李良,何畔,傅礼玮,等.响应面法优化毛酸浆黄色素的提取[J].东北农业大学学报,2014,45(7):112-116.
[14]张微微,张永根,刘震,等.响应面法优化马铃薯渣固态发酵生产奶牛饲料工艺条件研究[J].东北农业大学学报,2013,44(12): 113-118.
[15]Li Z,Zhong S,Lei H Y,et al.Production of a novel bioflocculant by Bacillus licheniformis X14 and its application to low tempera⁃ture drinking water treatment[J].Bioresource Technology,2009, 100(14):3650-3656.
[16]Schultz N,Chang L,Hauck A,et al.Microbial production of sin⁃gle-cell protein from deproteinized whey concentrates[J].Applied Microbiology and Biotechnology,2006,69(5):515-520.
Strengthen bioconversion of potato starch waste into single-cell protein with fermentation bySaccharomyces/
ZHANG Lihong1,FENG Liping1,SHI Chunhui2,WANG Zhenyu1,ZHANG Guangyang1,BAI Ying1,SONG Jinzhu1,CAO Guangli1,YANG Qian1,3(1.School of Life Science and Technology,Harbin Institute of Technology,Harbin 150001,China;2. Heilongjiang Institute for Food and Drug Control,Harbin 150088,China;3.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,Harbin 150090,China)
Using the potato starch waste as fermentation medium to product single-cell protein(SCP) by microorganisms.This study aimed to strengthen conversion of potato starch processing waste into single-cell as high-quality feed.The mutant strains S57 and U112(fromSaccharomy cescerevisiaeand Candida utilisrespectively)were selected after UV irradiation for more SCP production,SCP yield of 8.43 g·L-1,both.Use the inoculum concentration of 1%and inoculum rate of 1∶1 between two kinds of Saccharomyces,glucose concentration of 35 g·L-1to do the fermentation,by using response surfaceanalysis,the optimized fermentation conditions were temperature of 27.7℃,speed of 187 r·min-1, pH 7.7,and the highest SCP yield was 9.02 g·L-1the oretically.The test results were SCP yield of(9.19± 0.05)g·L-1and COD removal rate of 80%.
Saccharomy cescerevisiae;Candida utilis;potato starch waste;SCP;strengthen bioconversion
TS235.2
A
1005-9369(2015)07-0009-07
时间2015-7-9 14:42:22[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150709.1442.002.html
2015-01-29
黑龙江省重大攻关项目(GA08C201);“十二五”农村领域国家科技计划课题(2014BAJ21B02-04)
张立宏(1989-),男,工程师,硕士,研究方向为废弃物资源化处理。E-mail:1098443546@qq.com
杨谦,教授,博士生导师,研究方向为废弃物资源化处理。E-mail:microbio207@gmail.com
