杨树胞外蛋白的提取分离及2-D电泳体系的建立
2015-07-04罗永亚汪南阳林芳芝王俊霖
陈 颖,乐 利,罗永亚,杨 华,汪南阳,林芳芝,王俊霖
(南京林业大学 南方现代林业协同创新中心,生物与环境学院,南京210037)
胞外蛋白(extracellular proteins,ECP)又被叫做细胞壁蛋白(cell wall proteins,CWPs),质外体蛋白(apoplastic proteins,APPs)和分泌蛋白[1],是质外体中对细胞生长发育和信号转导起关键调控作用的物质,通常在高尔基体内合成,被分泌到细胞壁及胞外的基质中,只占质外体所有成分的5%~10%。但胞外蛋白是胞外信号的感知者,是信号跨越细胞膜的传递者,又是细胞壁结构骨架的搭建者。越来越多的实验证据表明胞外蛋白与细胞骨架、胞外基质、细胞膜及胞内物质之间不断地进行着“交流”[2-3]。
根据其与细胞壁成分的结合度可将胞外蛋白分为三类:一类是松散型结合蛋白,主要属于调控细胞壁生长分化的酶类;第二类胞外蛋白称为弱结合型蛋白,是以弱的非共价键与细胞基质结合的蛋白,在胞外可以进行扩散和迁移,因与细胞的生物胁迫和非生物胁迫应答有关,又称为防御蛋白;第三类胞外蛋白与胞壁成分结合紧密,称为紧密结合型蛋白,因与细胞壁的框架构建有关,又称为壁结构蛋白[4]。把胞外蛋白称“质外体蛋白”的学者偏于前两类蛋白的研究,而把胞外蛋白称“细胞壁蛋白”的学者大都偏向于二、三类蛋白的研究。本研究把叶片细胞壁提取的蛋白叫做细胞壁蛋白(CPWs),把从茎段液流中提取的蛋白叫做质外体蛋白(APPs)。
随着分子生物学技术的不断发展,亚细胞蛋白质组学研究成为当今生命科学研究的热点。亚细胞蛋白质组学在细胞膜、细胞器(线粒体和叶绿体中)的研究相对较多,而由于人们对胞外蛋白作用的忽视及提取的困难使其研究落后于胞内蛋白。目前对胞外蛋白组的研究主要集中在模式植物拟南芥上[4],另外在甘蓝、紫花苜蓿、烟草、玉米、鹰嘴豆、葡萄、水稻、豌豆、黄瓜等农作物和蔬菜上也有所涉及[5-11],但胞外蛋白组学在林木上的研究相对较少。
杨属植物(Populus)是林木基因组研究的模式植物,具有基因组小、童期短、生长快、易转化、易再生等特点,是当今世界中纬度地区栽培面积最广、木材产量最多的树种之一,中国种植面积就已超过7×106hm2[12]。目前杨树基因组学的研究较为深入,在环境胁迫下胞外蛋白组的研究却相对较少。通过对杨树胞外蛋白组的变化研究,一方面可以揭示胞外蛋白在环境胁迫中的响应机制,另一方面可以为其他林木胞外蛋白研究提供重要的理论和技术指导。本研究以美洲黑杨杂种优良无性系‘NL895’(Populusdeltoides×Populuseuramericanacv.)组培苗的叶片和茎段为试材,对杨树胞外蛋白的提取、分离、纯化、单向和双向电泳检测等技术进行了系统地研究。其中叶片胞外蛋白(细胞壁蛋白)的提取采用了LiCl和CaCl2法,茎段胞外蛋白(木质部液流蛋白)的提取采用了真空渗入法,初步建立了杨树胞外蛋白的双向电泳研究体系。
1 材料和方法
1.1 材 料
美洲黑杨杂种优良无性系NL895杨组培苗叶片和茎段来自于南京林业大学实验室。
1.2 苗木的扩繁和培养
组培苗的扩繁方法参照文献[13],蛋白提取等试验材料取自组培苗的茎段和叶片(图版Ⅰ,A、B)。
1.3 杨树叶片胞外蛋白的提取与纯化
杨树叶片胞外蛋白提取参照Kong等[8]、朱畇昊等[11]、Feiz等[14]提取法加以改进,分两步提取,具体流程如下。
细胞壁(CW)提取:(1)将NL895杨叶片用液氮研磨成粉末,加适量5mmol·L-1醋酸钠(pH 4.6)溶解,然后转移到50mL离心管中,在4℃、6 000×g(Beckman CoulterTM)离心15min,重复1次上述操作。(2)将沉淀转入三角瓶中,加入含0.4mol·L-1蔗糖的醋酸钠溶液(5 mmol·L-1,pH 4.6)中摇匀,用超声波细胞破碎仪(XO-1000D)将细胞破碎,共3次,每次10min,并对破碎后的细胞粉碎程度进行镜检。破碎后的细胞在4 ℃、4 000×g离心15min,弃上清。(3)上述沉淀中依次加入含0.4、0.6、1.0mol·L-1蔗糖的醋酸钠溶液(1mol·L-1)各冲洗3次,每次在4 ℃、4 000×g离心15min,弃上清。(4)沉淀再用5mmol·L-1醋酸钠溶液(pH 4.6)洗涤6次,洗涤后每次4 ℃、4 000×g离心15 min。(5)弃上清,沉淀再用超纯水冲洗4 次,冲洗后每次在4℃、4 000×g离心15min,最后一次在4℃、12 000×g 离心30 min,弃上清,其沉淀放入-20 ℃冷冻干燥即得细胞壁组分。
酚-甲醇/醋酸铵沉淀法胞外蛋白(ECPs)的提取与纯化:(1)弱键结合的CWPs提取。上述细胞壁沉淀中加入0.2mol·L-1CaCl2醋酸钠溶液(pH 4.6)冲洗2次,每次在4 000×g离心15min。(2)紧密型结合型CWPs提取。提取的细胞壁沉淀加入含0.2mol·L-1LiCl的醋酸钠溶液(pH 4.6)冲洗2次,每次在4 000×g离心15min,以下两者提取的步骤相同。(3)合并2次上清液,加入1/3体积Tris-平衡酚混匀,吸取苯酚相,转入离心管中,再加入5倍体积0.1 mol·L-1乙酸铵/甲醇溶液混匀,于-20 ℃条件下沉淀过夜。(4)次日将沉淀在4℃、12 000×g离心20min,弃上清加入2倍沉淀体积的甲醇,漩涡震荡2min,12 000×g离心20min。(5)弃上清,加入2倍沉淀体积的丙酮,漩涡震荡2 min,12 000×g离心20min。重复1次该操作,最后沉淀于-20 ℃冰箱中冷冻干燥,干粉即为细胞壁蛋白质(CWPs),-70 ℃保存。
TCA/丙酮沉淀法胞外蛋白(ECPs)的提取与纯化:参照林梓浩等[6]和Komatsu等[15]法,在提取的细胞壁组分中加入含0.2 mol·L-1CaCl2的醋酸钠缓冲液(25mmol·L-1,pH 4.6),涡旋5min,于4 ℃冰箱中浸提3h,4℃下15 000×g离心30min,留取上清液。该步骤重复1次后,再加入含3mol·L-1LiCl的醋酸钠缓冲液(25mmol·L-1,pH 4.6)15mL,涡旋5min,4 ℃冰箱中浸提3h后,4 ℃下15 000×g离心30min。取上清液加入4倍体积预冷的10% TCA/丙酮溶液(内含0.1% DTT,1 mmol·L-1PMSF),并在-20 ℃冰箱沉降过夜,4℃下15 000×g离心30min,弃上清,沉淀用丙酮清洗3次,每次4 ℃下15 000×g离心30 min,弃上清,沉淀于-20 ℃冰箱中冷冻干燥,干粉即为细胞壁粗蛋白(CWPs)。
1.4 杨树茎段胞外蛋白提取
参照Dani等[16]与Zhu等[17]的真空渗入法,并加以改进。(1)称取适量杨树茎段剪成2cm 长小段,用超纯水漂洗和分光光度计检测蛋白的含量。(2)将漂洗好的茎段浸入20mmol·L-1醋酸钠(含20mmol·L-1CaCl2)液体中,用70kPa真空抽气泵抽气20min,然后在5min内慢慢放气至室内大气压,将茎段取出吸干表面水分,并剪除两端褐化部分。(3)将材料放入底端带孔的离心管中,将其套入另一个大的离心管内,4 ℃、3 000×g离心60min,收集离心管底部的胞外提取液。(4)向提取液中加入1.5倍体积预冷的甲醇(含1%冰乙酸),在-28℃下浸提过夜。(5)次日,4 ℃、3 500×g 离心30 min,收集沉淀,依次用100%、70%甲醇洗涤沉淀,去除甲醇后的胞外蛋白粉在-70 ℃保存(即质外体蛋白,APPs)。
1.5 细胞壁显微检测与胞外蛋白质含量测定
用1.0%碘-碘化钾染色液、蓝墨水染色液浸润超声破碎的细胞,然后做徒手切片,并在显微镜下检测细胞结构的变化情况。胞外蛋白提取液中蛋白的含量测定参照Laemmli[18]法进行,用牛血清白蛋白做标准曲线,计算样品中蛋白质的含量。
1.6 杨树胞内酶(蛋白)污染的检测
为防止提取液中胞内蛋白的污染,采用细胞内6-P-葡萄糖(G-6-PDH)脱氢酶活性测定法(胞内标志酶)检测胞质蛋白的污染率。参照Komatsu等[15]与Zhou等[19]法,向100μL 茎 段 胞 外 蛋 白 质提取液、叶片细胞壁蛋白提取液和叶片总蛋白提取液中分别加入2.9mL 含55mmol·L-1Tris-HCl(8.0)、3.3 mmol·L-1MgCl2、0.2 mmol·L-1NADP、3.3mmol·L-1G-6P(6-P-葡萄糖)的混合液,在340nm 处检测G-6-PDH 脱氢酶的活性。用胞外蛋白提取液中G-6-PDH 脱氢酶活性占总蛋白提取液中G-6-PDH 脱氢酶活性的百分比来检测提取的胞外蛋白是否有胞内蛋白污染,重复3次。
1.7 杨树胞外蛋白的1-D和2-D电泳分析
1.7.1 胞外蛋白样品处理及1-D 电泳分析 样品的处理:将提取的胞外蛋白加入样品处理液混匀,在沸水浴中煮5min,冷却后在4 ℃、12 000×g下离心15min,取上清液点样,进行SDS-PAGE 电泳分析。分离胶浓度12.9%,初始电压80V,15min后改为200V 恒压,至溴酚兰迁移到距凝胶底部约1~2cm 时终止电泳。用PD Quest 1-DE 7.4.0图像处理软件进行图谱分析。
1.7.2 2-D 电泳体系优化 2-D 电泳参照林梓浩等[6]的方法并加以改进。(1)等电聚焦(IEF):按10 μL/mg胞外蛋白含量加入蛋白裂解液[含7 mol·L-1尿素,2 mol·L-1硫脲,4% Chaps,1% DTT,2% Ampholyte(pH 3~10),1mmol·L-1PMSF],充分摇匀后进行超声波处理20 min;37 ℃水浴45 min,12 000×g离心15min,取上清液150μL,加入300μL溶胀液[含6mol·L-1尿素,2mol·L-1硫脲,2%Chaps,0.4%DTT,1%Ampholyte(pH 3~10)]水化上样液,涡旋混匀。将样品液加入IPG strip聚焦盘中,再放入IPG 胶条(GE Healthcare),滴加2~3mL 矿物油水化12h 后,在等电聚焦仪(Bio-Rad)上进行第一向等电聚焦电泳(IEF)。IEF聚焦参数为250V 慢速升压45min,1 000V 快速升压1h45min,10 000V 线性升压5h,10 000V非线性快速升压聚焦,使总聚焦伏特小时数达60 000Vh完成聚焦,最后为500V 保持任意时间,水化和聚焦温度为20 ℃。(2)平衡:等电聚焦结束后,将胶条在平衡液Ⅰ[内含50mmol/L Tris-HCl(pH 8.8),6 mol·L-1尿素,30%甘油,20g·L-1SDS,20g·L-1DTT]中振荡平衡15 min,再在平衡液Ⅱ[内含50mmol·L-1Tris-HCl(pH 8.8),6 mol·L-1尿素,30%甘油,20g·L-1SDS,25g·L-1碘乙酰胺]中振荡平衡15 min。(3)第二向SDS-PAGE:同1-D 电泳操作步骤。(4)凝胶蛋白染色:SDS-PAGE结束后,取出凝胶,用去离子水漂洗2~3次,加入适量的R-250染色液,于摇床上轻轻染色3h,随后用脱色液洗脱至背景清晰。
1.8 杨树胞外蛋白电泳图谱分析
显色后的凝胶用ChemiDoc XRS 凝胶成像系统(Bio-Rad)扫描获取图像。单向电泳采用Quantity One 1-D 分析软件进行条带的识别和分析。双向电泳采用PDQuest 2-DE 7.4.0对图谱进行蛋白点的检测。
2 结果与分析
2.1 杨树叶片细胞壁破碎程度检测及显微检测
细胞壁的提取与叶片的破碎程度有关,叶片越破碎,细胞壁越易提取出来。在图版Ⅰ,C~E 中,在用液氮研磨后的叶片进行光镜检测时,可以看到叶片组织块较大,破碎程度小(图版Ⅰ,C);经超声破处理5 min 后,叶片组织块开始变小(图版Ⅰ,D),当超声破处理10min后,叶片已成为非常小的碎片,这对后面的细胞壁蛋白的提取是有利的,因此在细胞壁的提取过程选择超声波处理10min效果较好(图版Ⅰ,E)。
将5min 和10min超声处理的细胞碎片悬浮液用碘化钾和蓝墨水染色后,可以看到胞内结构易着色,而细胞壁不易着色(图版Ⅰ,F~G)。细胞破碎时间不同,细胞的结构变化相差很大,超声波处理5min后,可以看到大量细胞壁网络,但胞内细胞质保留较多(图版Ⅰ,F),而10min超声破碎处理,其叶片细胞中细胞质大部分已经去除,只看到细胞壁连接而成的网络,还可以观察到大量气孔存在,说明10min超声破碎清除胞内物质的效果较好(图版Ⅰ,G)。
2.2 杨树叶片胞内蛋白污染检测
G-6-PDH 脱氢酶是植物细胞内呼吸过程中重要的糖代谢酶,代表植物细胞的活力程度,也是判断细胞活力强弱的标志酶,常被用来检测细胞器提取液的纯净程度或污染程度[19]。从表1中可以看出,叶片细胞壁蛋白提取较纯,该酶占总蛋白提取液的2.9%,而茎段质外体蛋白提取液中该酶活性占总蛋白酶活性的14.1%,低于细胞壁提取液的纯度,但仍在允许的范围之内。
2.3 杨树胞外蛋白的电泳图谱分析
2.3.1 杨树叶片胞外蛋白SDS-PAGE分析 从图1的C、D 泳道电泳胶中可以看出,分别用加CaCl2和LiCl提取的NL895杨叶片细胞壁蛋白条带差异很大,CaCl2纯化的蛋白较LiCl提取的蛋白条带清晰、带宽,而LiCl纯化的胞外蛋白清晰度差,条带数和条带宽度都远小于CaCl2。在此提取方法中CaCl2提取的细胞壁蛋白主要是以弱键形式与细胞壁结合的蛋白,大多属于酶类,说明在细胞壁的提取液中与细胞壁和胞外基质活动相关的酶类含量丰富,细胞代谢活动旺盛(图1,C泳道)。
从图1中还可以看出,提取样品叶片的质量与提取蛋白的含量关系密切,同样用CaCl2提取胞外蛋白的方法中,用7g(图1,C 泳道)叶片样品电泳的多肽条带清晰度差,条带弥散不集中,但用15g(图1,B泳道)叶片量提取的蛋白与前者比较,条带数明显增加,条带清晰、带宽,可以观察到的条带有12~14条,分子量主要分布在13~65kD 之间,其中丰度较高的亚基分布在4 3、3 0和25kD附近。在43kD 附近有较为丰富的蛋白存在,R-250染色深,亮度大。通过与总蛋白电泳胶(图1,A 泳道)比较,1,5-2-P核酮糖羧化酶的大亚基(55kD)在B 泳道电泳胶中非常弱,说明细胞壁蛋白提取的纯度较高(图1,B)。而总蛋白的SDS-PAGE 图谱中可以看到 标 志 酶1,5-2-P 核 酮 糖 羧 化 酶 的 大 亚 基(55 kD)存在,总蛋白图谱中多肽的条带多于胞外蛋白的条带数(图1,A 泳道)。经真空渗入法提取的茎段胞外蛋白SDS-PAGE电泳见图1,E泳道,可见在43kD 附近有较大的多肽带存在,在40kD 以下有少量条带存在,而在高分子量区域50~97kD 区域中多肽条带稀少,说明杨树的茎段质外体蛋白主要分布在小分子量蛋白区域。
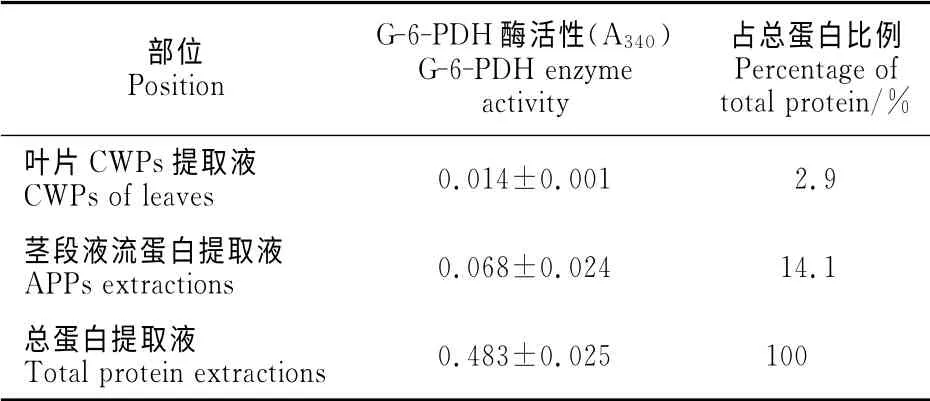
表1 胞外蛋白提取液中胞内蛋白污染检测Table1 Detection of intracellular contamination in ECPs

图1 NL895杨胞外蛋白的1-D电泳图谱Fig.1 SDS-PAGE image analysis of NL895poplar leaf CWPs(A-D)and stem(E)ECPs
2.3.2 杨树叶片胞外蛋白的2-DE电泳分析
(1)不同pH 胶条和提取方法对杨树叶片细胞壁蛋白2-DE图谱的影响 为探究杨树细胞壁蛋白最佳的pH 范围,采用了pH 3~10和4~7、长为17 cm IPG 胶条进行研究。结果表明(图2),从叶片提取的NL895杨细胞壁蛋白经2-D 双向电泳后,在不同pH 介质中出现的蛋白质多肽斑点差异较大。在pH 3~10介质条件下(图2,A),电泳图谱中蛋白质斑点较少,而且不清晰,统计斑点数在50个左右,大部分在43~20kD 之间。而在pH 4~7介质条件下(图2,C),电泳图谱中蛋白质斑点较pH 3~10介质条件下增多且斑点清晰,且在66~45kD 之间出现了蛋白斑点,45~35kD 之间是斑点最密集区域,25.0~18.0kD 之间斑点也比较密集,蛋白点最密集的条带在31kD 左右,斑点数最多,最清晰,经软件统计的斑点数达150个左右,再次说明杨树细胞壁蛋白(CaCl2)提取部分,弱碱结合的细胞壁蛋白的分子量主要分布在低分子量、酸性区域,即小分子量蛋白居多。
从上样量来看,500μg(图2,B)上样量蛋白点较少,清晰度较差,特别是低丰度的蛋白分辨率差;1 000μg(图2,C)上样量无论从蛋白点的斑点数、清晰度、低丰度蛋白的表达量来讲都最好,蛋白质点呈圆形,重复性好,斑点数达300多个;而1 200μg(图2,D)上样量由于上样量高,导致大多数蛋白质点没有完全分离,叠加在一起。

图2 NL895杨叶片细胞壁蛋白2D 电泳图谱(17cm IPG,pH 4~7)Fig.2 2-DE image analysis of NL895poplar CWPs extraction by andphenol-MeOH/NH4Ac(17cm IPG,pH 4~7)
尽管酚-甲醇/醋酸铵沉淀法在1 000μg上样量、17cm 胶条、pH 4~7条件下获得了较为满意的蛋白质图谱,但由于胶条较窄,出现部分蛋白质点的重叠和堆积,斑点仍然较少。在用TCA/丙酮沉淀法提取的细胞壁蛋白中,改进了提取技术,采用加大离心力到15 000×g、延长离心至30min,并在提取液中添加DTT 和PMSF,使细胞壁蛋白的提取效果大大增加,采用500μg(图3)上样量、24cm 胶条、pH 4~7条件下获得了满意结果,蛋白质电泳图谱清晰度提高,特别是蛋白质斑点数大大增加,斑点数达550多个,比酚-甲醇/醋酸铵沉淀法多了200多个斑点,是较为有效的一种纯化方法。

图3 NL895杨叶片丙酮沉淀法细胞壁蛋白的2D 电泳图谱(500μg,24cm IPG,pH 4~7)Fig.3 2-DE image analysis of NL895poplar CWPs extraction by TCA/acetone precipitation(500μg,24cm IPG,pH 4~7)
(2)杨树茎段胞外蛋白的2-D 电泳分析 NL895杨细胞壁蛋白经2-D 电泳后,在不同pH 介质胶条下电泳出现的蛋白质斑点与在叶片中的pH范围不同。在pH 3~10介质条件下(图4,A),电泳图谱中蛋白质斑点较多,而且清晰,在高分子量部分70~97kD 区域也有斑点存在,但较少,在31~66kD 区域蛋白主要分布在pH 5~7之间的中性区域;31~43kD 之间蛋白斑点最多,特别是在43kD左右,蛋白斑点最为集中,依然说明茎段胞外蛋白主要分布在小分子量的区域。而在pH 4~7 介质条件下,电泳图谱中蛋白质斑点并没有表现出比pH 3~10之间多的现象,也是主要在31~66kD 之间蛋白斑点最多,但斑点堆积现象明显(图4,B)。
3 讨 论
目前胞外蛋白的提取方法主要有两种,一种是细胞毁坏型即通常采用先提取细胞壁,再从细胞壁中纯化出蛋白[14-15],主要应用于叶片;另一种是细胞非毁坏型即通过真空渗入法[17,19]将胞外蛋白提取出来,主要应用于茎段。不同植物胞外蛋白的提取技术相差很大,在本研究中叶片细胞壁蛋白采用了第一种方法,在细胞壁的超声破碎过程中,10 min超声波对细胞壁的破碎程度最好,超声波处理后溶液明显比处理前溶液均匀,且粉末更加细致,这样大大增加了与提取液接触面积,进而提高了蛋白样品质量。通过染色镜检叶肉细胞中的胞内物质,可看出该法已将其大部分去除,检测到大部分结构为去除胞内成分的细胞壁,结果与朱畇昊等[11]的方法一致,证明该法对细胞壁的破碎是可行的。用真空渗入法提取叶片胞外蛋白时,由于杨树叶片汁液流动不及农作物,因而提取的胞外蛋白量非常少,需要大量的叶片材料(资料未给出),因此利用前一种方法提取叶片胞外蛋白较好。在茎段质外体液流蛋白的提取过程中,采用了多年生实生苗杨树(春季嫩梢)和组培苗的茎段提取作对比,发现实生苗由于枝条较粗且已木质化,酚氧化酶活性强,在提取过程中亦褐化,给提取质外体液流蛋白带来困难(资料未给出),而利用组培苗的幼嫩茎段提取质外体液流蛋白,其效果较好。

图4 NL895杨茎段胞外蛋白双向电泳图Fig.4 2-DE image analysis of NL895poplar apopalst proteins from stems
在样品的用量方面,大部分文献中通常介绍样品量在5~10g之间,但在杨树胞外蛋白提取过程中,发现低量(7g左右),只有用CaCl2纯化的蛋白多肽条带清晰,用LiCl提取的蛋白电泳后条带不清晰,浓度低,不能用于分析。采用高质量(10g 以上)样品提取的胞外蛋白条带清晰、带宽、浓度高,说明杨树细胞壁蛋白的提取需要较高的样品用量,这与林梓浩等[6]在黄瓜中细胞壁蛋白提取只用5g的量相差很大,说明不同的植物细胞壁蛋白具有特异性,另外也可能与提取的方法有关。
在蛋白纯化中,采用的方法主要有丙酮干粉法和饱和酚法。酚-甲醇/醋酸铵沉淀法主要是用于从富含次生代谢物的复杂样品中提取蛋白质的方法[20];在酚-甲醇/醋酸铵沉淀法中本实验获得了300多个蛋白质斑点,提取效果较好,与黄雅芳等[21]结果相似;而采用丙酮/沉淀法纯化的细胞壁蛋白效果要好于上述方法,且采用24cm 的大胶条更有利于杨树细胞壁蛋白斑点的展现,斑点达550个,是较为理想的纯化方法。在本研究中影响双向电泳蛋白斑点数量和清晰度的因素主要有2 个:一是胶条pH 范围,pH4~7胶条对杨树细胞壁蛋白的分辨率较有利,分离出的蛋白质斑点多而密集、清晰度高,减少了蛋白斑点的堆积和重叠,而用pH 3~10 胶条蛋白质斑点较少,低丰度蛋白不清晰,蛋白斑点堆积、重叠。相反,茎段质外体蛋白采用pH 3~10的胶条效果更好,说明不同器官之间蛋白质分子量区域有差异,需要的pH 值也不同。二是胶条长度,采用24cm 胶条比17cm 的胶条得到的蛋白斑点多。
杨树是林木研究的模式树种,而胞外蛋白在应答环境胁迫和环境适应性中具有非常重要的作用[3]。本研究利用NL895杨组培苗的叶片和茎段初步建立了杨树胞外蛋白的双向电泳技术体系,为开展杨树细胞壁蛋白的研究提供了前提条件,为差异蛋白的分析奠定了基础。茎段质外体蛋白的提取、纯化的方法还需进一步完善和探索。

图版Ⅰ NL895杨组培苗(A、B)、叶片细胞碎片超声波处理(C~E)及超声波叶碎片显微检测(F、G)PlateⅠ Plantlets of NL895poplar(A,B);detection of the cell breaking status by microscopic(C-G)
[1] LEE S J,SARAVANAN R S,DAMSCENO C M B,etal.Digging deeper into the plant cell wall proteome[J].PlantPhysiologyandBiochemistry,2004,42(12):979-988.
[2] DAVIA J,CHEN D,etal.Searching for new cell wall protein genes inArabidopsis[J].PlantPhysiologyandBiochemistry,2009,47(2):81-85.
[3] PECHANOVA O,HSU C Y,ADAMS J P.Apoplast proteome reveals that extracellular matrix contributes to multistress response in poplar[J].BMCGenomics,2010,11(1):674.
[4] JAMET E,ALBENNE C,BOUDART G,etal.Recent advances in plant cell wall proteomics[J].Proteomics,2008,8(4):893-908.
[5] BHUSHAN D,PANDET A,CHATTOPADGYAY A,etal.Extracellular matrix proteome of chickpea(CicerarietinumL.)illustrates pathway abundance,novel protein functions and evolutionary prospect[J].JournalofProteomeResearch,2006,5(7):1 711-1 720.
[6] LIN Z H(林梓浩),LI Y H(李玉红),DONG C J(董从娟),etal.Establishment of a two-dimensional electrophoresis system for cell wall proteomics analysis of cucumber leaves[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2013,41(9):91-105(in Chinese).
[7] CHEN X Y,KIM S T,CHO W K,etal.Proteomics of weakly bound cell wall proteins in rice calli[J].JournalofPlantPhysiology,2009,166(7):675-685.
[8] KONG F J,ATSUSHI OYANAGI,SETSUKO KOMATSU.Cell wall proteome of wheat roots under flooding stress using gel based and LC MS/MS based proteomics approaches[J].BiochimicaetBiophysicaActa,2010,18(4):124-136.
[9] NEGRI A S,PRINSI B,SCIENZA A,etal.Analysis of grape berry cell wall proteome:A comparative evaluation of extraction methods[J].JournalofPlantPhysiology,2008,165(13):1 379-1 389.
[10] BAYER E M,BOTTRILL A R,VIGOUROUX M,etal.Arabidopsiscell wall proteome defined using multidimensional protein identification technology[J].Proteomics,2006,6(1):301-311.
[11] ZHU J H(朱畇昊),CHEN SH N(陈绍宁),HU X L(胡秀丽),etal.Improvements on the extraction of plant cell wall protein[J].JournalofHenanAgriculturalUniversity(河南农业大学学报),2009,43(5):557-559(in Chinese).
[12] FANG SH Z(方升佐).Silvi culture of poplar plantation in China:A review[J].ChineseJournalofAppliedEcology(应用生态学报),2008,19(10):2 308-2 316(in Chinese).
[13] CHEN Y(陈 颖),XU C P(徐彩平),WANG N Y(汪南阳),etal.Effects of salicylic acid on oxidation resistance of‘Nanlin 895’poplar plantletsinvitrounder salt stress[J].JournalofNanjingForestryUniversity(Nat.Sci.Edi.)(南京林业大学学报·自然科学版),2012,36(6):17-22(in Chinese).
[14] FEIZ L,IRSHAD M,PONT-LEZICA RF,etal.Evaluation of cell wall preparations for proteomics:a new procedure for purifying cell walls fromArabidopsishypocotyls[J].PlantMethods,2006,2(1):10.
[15] KOMATSU S,KOBAYASHIY,NISHIZAWA K,etal.Comparative proteomics analysis of differentially expressed proteins in soybean cell wall during flooding stress[J].AminoAcids,2010,39(5):1 435-1 449.
[16] DANI V,SIMON W J,DURANTI M,etal.Changes in the tobacco leaf apoplast proteome in response to salt stress[J].Proteomics,2005,5(3):737-745.
[17] ZHU J,CHEN S,ALVAREZ S,ASIRVATHAM VS,etal.Cell wall proteome in the maize primary root elongation zone.I.Extraction and identification of water-soluble and lightly ionically bound proteins[J].PlantPhysiology,2006,140(1):311-325.
[18] LAEMMLI U K.Cleavage of structural proteins during assembly of head of bacteriophage T4[J].Nature,1970,227(8):680-685.
[19] ZHOU L,BOKHARI S A,DONG C J,LIU J Y.Comparative proteomics analysis of the root apoplasts of rice seedlings in response to hydrogen peroxide[J].PLoSONE,2011,6(2):e16723.
[20] CARRETTE O,BURKHARD P,SANCHEZ J C,etal.State of the art two dimensional gel electrophoresis:a key tool of proteomics research[J].NatureProtocols,2006,1(2):812-823.
[21] HUANG Y F(黄雅芳),YANG R(杨 瑞),WANG ZH ZH(王志忠),etal.The establishment of optimizational two-dimensional electrophoresis system for melon fruit[J].ChineseAgriculturalScienceBulletin(中国农学通报),2014,30(19):98-104(in Chinese).
