甜瓜蔓枯病抗性鉴定及PAL基因表达分析
2015-07-04毕研飞徐兵划张永兵伊鸿平钱春桃陈劲枫
毕研飞,郭 静,徐兵划,张永兵,伊鸿平,钱春桃*,陈劲枫
(1 南京农业大学 园艺学院作物遗传与种质创新国家重点实验室,南京210095;2 新疆农业科学院 哈密瓜研究中心,乌鲁木齐830000)
蔓枯病(gummy stem blight)又称黑腐病,是影响瓜类蔬菜生产的重要病害之一,它可以危害甜瓜、黄瓜、西瓜、西葫芦等作物,大田发病率可达20%~30%,在连作地或温室高达80%,病害严重的年份常常会造成毁灭性减产[1-5]。目前,生产上防治蔓枯病的常用方法是化学防治,但化学防治效率低、易造成环境污染。另外,在公众食品安全意识日益强化的社会背景下,使用化学农药防治蔓枯病的方法已经越来越不适宜现代农业生产。因此,筛选抗病资源具有重要的生态价值和经济价值。
国内外针对瓜类蔓枯病抗病资源鉴定的研究较多,筛选获得了多份抗病材料。戴富明等[6]对20份来自美国和中国的西瓜品种进行人工接种抗病性鉴定,发现从美国引进的AG、AS、AJ对蔓枯病的抗性较强。王晓东等[7]对新疆17个哈密瓜品种进行抗蔓枯病鉴定,筛选到‘新蜜杂1号’和‘新蜜19号’2个抗蔓枯病品种。李英等[8]从26份黄瓜材料中筛选出4份(酸黄瓜、‘朝优3号’以及2个酸黄瓜回交后代HH1-8-57和HH1-8-2)对蔓枯病有较高抗性的材料。Wehner等[9]对田间851个黄瓜品系进行蔓枯病抗性鉴定,获得PI200815、AR79-75 和Transamerica等9 个高抗品系。Molly Jahn 等[10]通过田间和温室接种鉴定了798份甜瓜资源,并从中筛选出4 份高抗材料(PI157082、PI511890、PI482398、PI483399)。Gusmini等[11]通过接种鉴定筛选出了PI279461、PI482379和PI254744等10个抗病西瓜种质。
蔓枯病病原菌[Didymellabryoniae(Auersw)]存在生理小种的分化,若品种仅携带单个抗病基因,则会导致其抗性降低甚至失去抗性[12-14]。相关研究表明,不同抗性基因的聚合有助于提高作物的抗性和抗谱[15-18]。因此选育聚合抗源是提高甜瓜抗蔓枯病的有效途径之一。然而,有关甜瓜不同聚合抗源抗性的鉴定及筛选还鲜见报道。抗蔓枯病基因PAL的表达与植物的抗病性密切相关,当植物受到病原菌侵染时PAL被诱导表达,以提高植物的抗性,且其表达时间和表达量与植物抗性呈正相关[19-22]。但目前关于甜瓜PAL的研究较少,且主要集中从生理生化角度研究不同诱导条件下其酶活性变化,而从分子水平进行甜瓜PAL基因在蔓枯病菌胁迫条件下表达特性的研究还未见报道。
本实验通过对5份单基因抗源和6份聚合抗源材料进行甜瓜苗期蔓枯病菌的梯度接种鉴定,并利用RT-PCR技术对抗蔓枯病基因PAL在不同抗性材料中的差异表达进行分析。旨在筛选抗性显著提高的聚合抗源,揭示其抗性提高的相关分子机制,为甜瓜抗蔓枯病聚合育种提供理论依据。
1 材料和方法
1.1 甜瓜抗源材料和接种菌株
5份甜瓜单基因抗源材料PI140471、PI157082、PI511890、PI482398 和PI420145,分别含有抗病基因Gsb-1、Gsb-2、Gsb-3、Gsb-4[10]和Gsb-6[23],其 中PI140471、PI157082、PI511890和PI482398由美国康乃尔大学Molly John教授提供,PI420145是由本课题组的Joseph 等筛选得到,并命名为Gsb-6。6份聚合基因材料分别由5份单基因抗源杂交并结合相关分子标记筛选获得:082-890(PI157082×PI511890)、082-398(PI157082×PI482398)、145-471(PI420145×PI140471)、145-082(PI420145×PI157082)、145-890(PI420145×PI511890)和890-398(PI511890×PI482398)。感病品种‘白皮脆’,由项目合作单位新疆农业科学院提供。
2013年春季(3月10号)、秋季(8月1号)在南京农业大学人工气候室内进行育苗。将种子消毒、浸种后,28℃催芽,挑选饱满、整齐一致的播种于72 孔穴盘中。育苗期间平均昼/夜温度为24℃~28℃/17℃~19℃,光合有效辐射500μmol·m-2·s-1,相对湿度维持在60%~70%。待幼苗第一片真叶展平时,挑选长势较好且一致的植株移栽至12cm×10cm×8cm(口径/底径/高)营养钵中,每钵1株。基质由草炭、蛭石(V∶V=1∶1)混合而成。
试验用蔓枯病菌为本实验室分离纯化并保存的A 型菌株,参照李英等[24]的方法进行产孢培养。用解剖针挑取菌丝接种于PDA培养基平板的中央,经25℃黑暗培养7d后,再在40 W 紫外灯下30 cm 间歇照射4d(12h紫外/12h黑暗)产生孢子。在显微镜下利用血球计数板将分生孢子悬浮液配成5×105个/mL、5×107个/mL 和5×109个/mL备用。
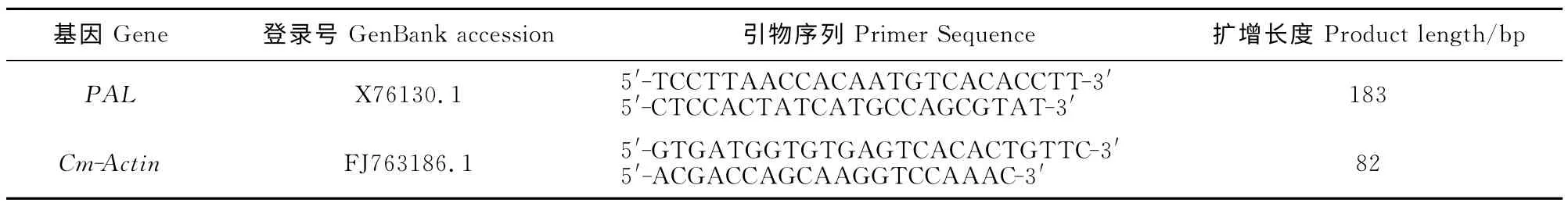
表1 防卫基因表达分析的引物序列及产物大小Table 1 Primer sequences and product sizes by expression analysis of defense genes
1.2 试验方法
1.2.1 苗期梯度接种鉴定 完全随机设计,试验材料分为A、B、C 等3组,每组每份材料35株,均种植于南京农业大学园艺学院牌楼试验基地温室内。参照Zhang等[12]的方法,待幼苗长到3~4片真叶时进行人工喷雾接种,用微型喷雾器对3组分别喷洒浓度为5×105、5×107和5×109个/mL 的蔓枯病病菌孢子悬浮液。接种后覆盖塑料棚膜遮光密闭,相对湿度保持92%~95%,温度23℃~27℃,3d后揭开棚膜,于7和10d调查统计病情。
叶片侵染分级标准:0级.无可见侵染;1级.老叶上边缘坏死或斑点<10 mm,新叶无病;2 级.老叶同上,新叶边缘坏死;3级.所有叶均有感染,叶坏死面积<25%;4级.叶坏死面积>25%,≤50%;5级.叶坏死面积>50%。
根据平均病情级别数(RI)确定蔓枯病抗性级别:高抗(HR).RI<1.0;抗(R).1.0≤RI<2.0;中抗(MR).2.0≤RI<3.0;感(S).3.0≤RI<4.0;高感(HS).RI≥4.0。平均病级计算公式:
RI=∑(级值×株数)/总株数
根据接种鉴定结果,选取能准确区分聚合基因材料和单基因抗源材料抗性差异的接种浓度进行再次苗期接种,并于接种后0、12、24、48、72h,及5和7d取样,样品取后立即放入液氮速冻,置于-70℃超低温冰箱保存备用。每一时间点的样品进行3次独立生物学重复。
1.2.2 引物设计、RNA 提取和cDNA 合成 从GenBank中(http://www.ncbi.nlm.nih.gov/)搜索苯丙氨酸解氨酶基因[C.melo(cantaloupe)pal mRNA]的mRNA 序列,利用Primer 6.0软件设计引物并由英潍捷基(上海)贸易有限公司合成,内参基因参照Islam El-Sharkawy[25](表1)。利用RNA提取试剂盒(天根生化科技有限公司)提取总RNA,并用DNaseⅠ除去基因组DNA。利用反转录试剂盒(Takara公司)进行反转录得到cDNA 用于基因的特异性表达分析,方法参照试剂盒说明书。
1.2.3 mRNA 的RT-PCR 扩增利用SYBR Green试剂盒(Takara 公司)进行实时荧光定量PCR 分析。25μL 反应体系为SYBR? Premix(2×)12.5μL,上下游引物(2.5μmol·L-1)各0.8 μL,cDNA 1.0μL,ddH2O 9.9μL,每个样本进行3次技术重复。RT-PCR反应条件为95℃预变性30 s,95℃变性5s,60℃退火20s,65℃延伸30s,进行40个循环,在65℃延伸步骤收集荧光信号。最后,采用2-ΔΔCT 法进行相对定量数据分析。
2 结果与分析
2.1 不同抗性基因聚合后的抗病表现
不同抗性植株春、秋季的病级统计结果见表2,当接种浓度为5×105个/mL 时,只有感病品种‘白皮脆’出现病症,单基因抗源和聚合抗源都无发病症状。当接种浓度为5×107个/mL 时,PI157082 平均病级(RI)为2.0,表现为中抗,其他单基因抗源RI为1.3~1.6 之间,表现为抗,而聚合抗源145-471、082-890、890-398和082-398的平均病级RI<1.0,表现为高抗。当接种浓度为5×109个/mL时,不同抗源出现不同等级的病症,其中单基因抗源PI420145与PI140471 的平均病级分别为3.0~3.6,表现为感病,而聚合抗源145-471(PI420145×PI140471)的平均病级为0.39~0.51,仍表现为高抗,抗性显著高于单基因抗源亲本。
2.2 防卫基因的表达分析
选取抗病基因聚合后抗性显著提高的聚合抗源145-471(PI420145× PI140471)、单 基 因 抗 源PI420145、PI140471和感病品种‘白皮脆’为材料,利用实时荧光定量PCR(Real-time PCR)技术,以Cm-Actin为内参基因,分析PAL基因在甜瓜幼苗根(图1,A)、茎(图1,B)、叶(图1,C)中的表达情况。结果表明,PAL在根、茎、叶中均有表达,但表达存在一定差异,在叶中表达较高,根和茎中表达较低。
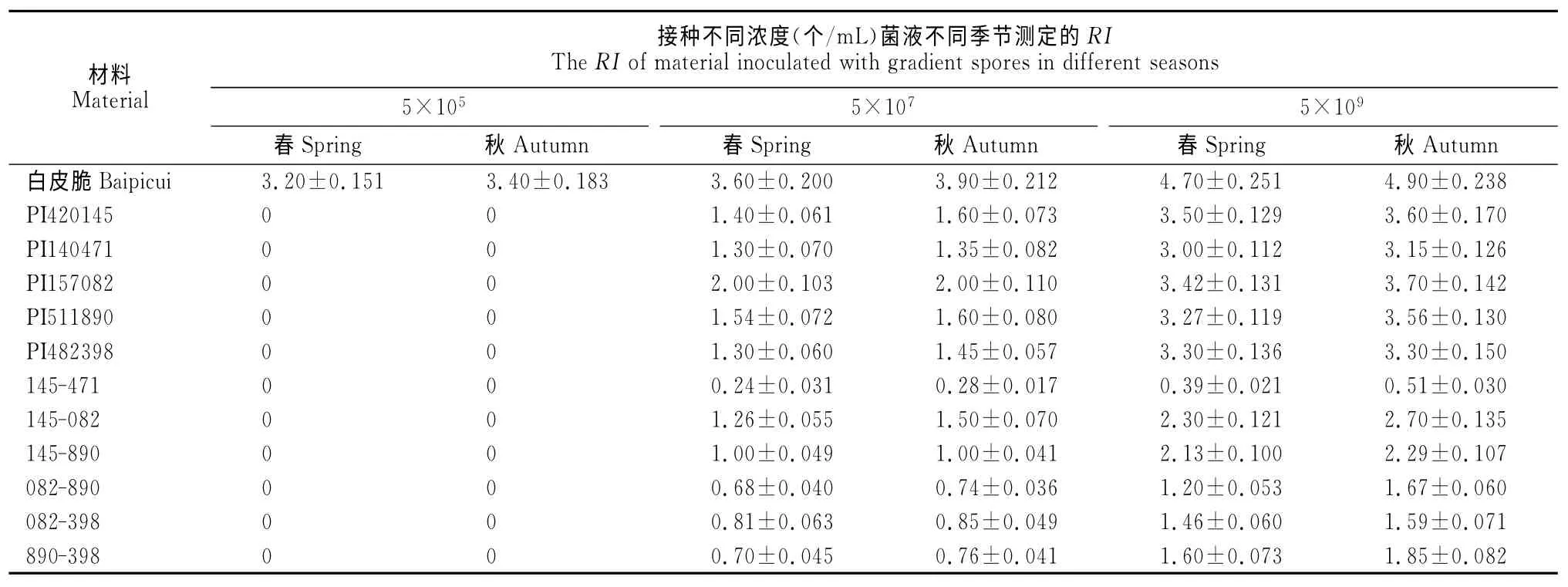
表2 接种鉴定结果统计(RI)Table 2 Estimation of disease rating(RI)
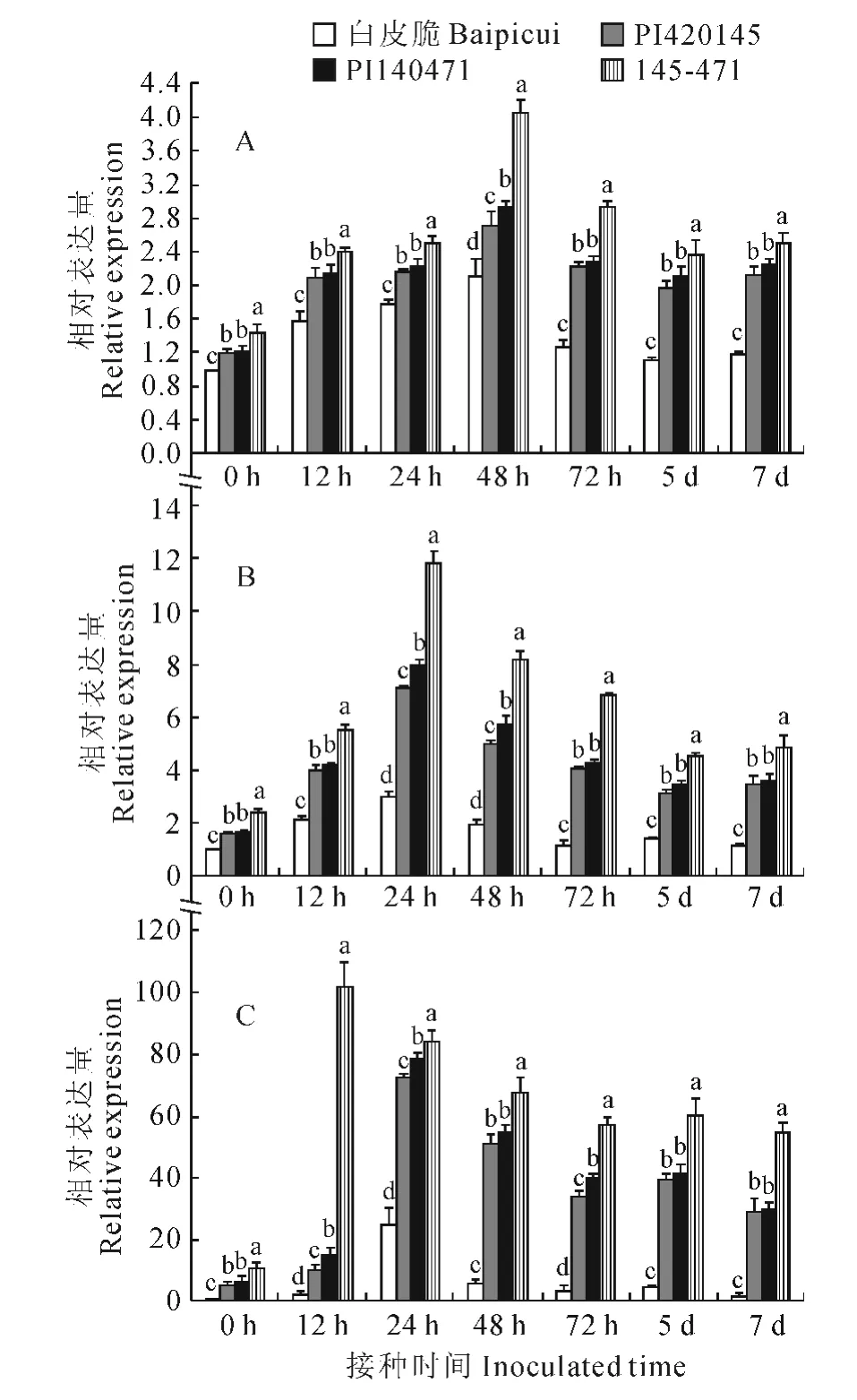
图1 蔓枯病菌胁迫下PAL 在不同抗性甜瓜根(A)、茎(B)和叶(C)中的表达Fig.1 Expression of PALin root(A),stem(B)and leaf(C)under gummy stem blight stress
接种后,‘白皮脆’根中PAL的表达在12~48 h内变化不大,72h时快速下降,5d时降至最低,但仍高于对照,为对照的1.1倍,7d时有所上调,但仍低于72 h 的表达量;单基因抗源PI420145、PI140471和聚合抗源145-471根中PAL表达的变化趋势基本一致,都在48h时达到最高峰,但峰值却不同,145-471分别为PI420145 和PI140471 的1.5倍和1.38倍。不同抗性材料茎中PAL表达变化趋势基本一致,先上调,24h时达到最高峰,然后下调,但变化幅度具有明显差异。茎中表达量达到最高峰时(24h),‘白皮脆’、PI420145、PI140471和145-471分别为对照的3倍、4.44倍、4.59倍和4.9倍。聚合抗源145-471叶片中PAL表达在12h时达到最高峰,为对照的9.3 倍,而‘白皮脆’、PI420145和PI140471在24h时达到最高峰,分别为对照的25倍、14.2 倍和12 倍。接种后,不同抗性甜瓜中PAL的表达量均高于对照,且与感病品种白皮脆相比,抗源中的表达量始终相对较高。
3 讨 论
传统的甜瓜抗蔓枯病苗期接种鉴定孢子液浓度为5×105个/mL,可以有效区分出抗、感材料的差异,但不能准确区分抗性材料之间的差异[12,26]。本研究利用3个蔓枯病病菌浓度(5×105、5×107和5×109个/mL)进行梯度接种鉴定实验,以准确鉴定单基因抗源与聚合抗源以及不同聚合抗源之间的抗性能力的差异。结果表明,单基因抗源对不同蔓枯病菌表现出一定程度的选择性抗性,而聚合抗源却一直表现为抗病,说明聚合基因可以提高甜瓜的抗性与抗谱,这与Matsumoto等[16]在黄瓜方面以及朱明涛等[17]在番茄方面的研究结果相一致。另外,不同聚合抗源之间的抗性表现也存在一定差异,145-471对不同浓度病原菌抗性表现基本一致,均为 高 抗。145-082、145-890、082-890、082-398 和890-398对不同浓度表现选择性抗性,当接种浓度为5×105个/mL 时均表现为高抗,5×107个/mL时,082-890、082-398和890-398表现高抗,145-082和145-890表现为抗;5×109个/mL 时,聚合抗源082-890、082-398 和890-398 表现为抗,而145-082和145-890表现为中抗。本研究筛选到的聚合抗源145-471可作为甜瓜优质、抗病和高产育种重要的中间材料,为获得新的高抗甜瓜品种(系)奠定了基础。
基因表达分析表明,防卫基因PAL在甜瓜不同组织均有表达,叶片的表达量最高,其次是茎,而根中的表达量比较低。接种蔓枯病菌后,不同抗性甜瓜及不同组织中PAL表达量变化存在明显差异。聚合抗源145-471叶片中PAL基因表达量在12h 时达到最高峰,而单基因抗源PI420145 和PI140471叶片中PAL基因表达的最高峰在24h。不同抗性甜瓜茎中PAL基因的表达在24h时均达到最高峰,而根PAL基因在12~24h表达变化幅度较小。由此可知,甜瓜幼苗对蔓枯病菌侵染的时空响应或适应性存在一定差异。防卫基因PAL表达量在接种后呈现出先升高后降低的趋势,且后期有所波动。这可以有效避免基因表达产物的过度积累而对植株自身造成损害,同时还可降低病原菌的适应性,与王红英等[27]在甜瓜和缪卫国等[28]在棉花上从生理生化方面研究酶活性变化的趋势基本一致。
本研究首次在转录水平上研究PAL与甜瓜蔓枯病抗性的关系,聚合抗源145-471中PAL基因的表达量高于或表达时间早于单基因抗源PI420145和PI140471,在一定程度上揭示了甜瓜聚合抗源抗性提高的原因。RT-PCR 方法分析PAL转录水平与研究PAL酶活性相比,方法简单、快捷、准确,为进一步研究PAL与甜瓜抗病性的关系提供了技术和理论支持。另外,与感病品种‘白皮脆’相比,抗病材料中PAL基因的表达量始终相对较高,表明PAL与甜瓜蔓枯病抗性有密切关系,其表达量可作为甜瓜前期蔓枯病抗性鉴定的重要参考指标。
[1]KEINATH A P,FARNHAM M W,ZITTER T A.Morphological,pathological,and genetic differentiation ofDidymellabryoniaeandPhomaspp.isolated from cucurbits[J].Phytopathology,1995,85(3):364-369.
[2]WU M ZH(吴明珠),YI H P(伊鸿平),FENG J X(冯炯鑫),etal.Ecobreeding of hamimelon and soilless cultivation of organic ecotype[J].EngineeringScience(中国工程科学),2000,2(8):83-88(in Chinese).
[3]LIU SH L(刘书林),GU X F(顾兴芳),SHI Y X(石延霞),etal.General research situation on gummy stem blight of cucurbitacae vegetables[J].ChinaVegetables(中国蔬菜),2013,(18):1-10(in Chinese).
[4]BI Y F(毕研飞),XU B H(徐兵划),QIAN CH T(钱春桃),etal.Research progress in melon resistance breeding to gummy stem blight[J].ChinaVegetables(中国蔬菜),2013,(20):10-16(in Chinese).
[5]WOLUKAU J N,ZHOU X H,LI Y,etal.Resistance to gummy stem blight in melon(CucumismeloL.)germplasm and inheritance of resistance from plant introductions 157076,420145,and 323498[J].HortScience,2007,42(2):215-221.
[6]DAI F M(戴富明),LU J P(陆金萍),GU W H(顾卫红),etal.Induction of fruiting-body ofDidymellabryoniaeand identification of watermelon resistance to the pathogen[J].ActaPhytophylacicaSinica,2003,30(2):138-142(in Chinese).
[7]WANG X D(王晓东),LI G Y(李国英).Producing pycinidia and varidty susceptibility of gummy stem bight fungus of muskmelon[J].XinjiangAgriculturalSciences,2004,41(5):341-344(in Chinese).
[8]李 英.瓜类蔓枯病菌的生物学特性和黄瓜抗病资源的筛选[D].南京:南京农业大学.2007.
[9]WEHNER T C,SHETTY N V.Screening the cucumber germplasm collection for resistance to gummy stem blight in North Carolina field tests[J].HortScience,2000,35(6):1 132-1 140.
[10]FRANTZ J D,JAHN M M.Five independent loci each control monogenic resistance to gummy stem blight in melon(CucumismeloL.)[J].Theor.Appl.Genet.,2004,108(6):1 033-1 038.
[11]GUSMINI G,SONG R H,WEHNER T C.New sources of resistance to gummy stem blight in watermelon[J].CropScience,2005,45(2):582-588.
[12]ZHANG Y P,MOLLY K,ANAGNOSTOU K.Screening melon for resistance to gummy stem blight in the greenhouse and field[J].Hort Science,1997,32(1):117-121.
[13]LIU L ZH(刘龙洲),ZHAI W Q(翟文强),CHEN Y L(陈亚丽),etal.QTL molecular marker location of gummy stem blight resistance in melon(Cucumismelo)[J].JournalofFruitScience(果树学报),2013,30(5):748-752(in Chinese).
[14]KEINATH A P,HOLMES G J,EVERTS K L,etal.Evaluation of combinations of chlorothalonil with azoxystrobin harpin,and disease forecasting for control of downy mildew and gummy stem blight on melon[J].CropProtection,2007,26:83-88.
[15]XU Y(许 勇),ZHANG H Y(张海英),KANG G B(康国斌),etal.Studies of molecular marker-assisted-selection for resistance to fusarium wilt in watermelon(Citrulluslanatus)breeding[J].ActaGeneticaSinica(遗传学报),2000,27(2):151-157(in Chinese).
[16]MATSUMOTO Y,WATANABE N,KUBOYAMA T,etal.Cross-species transferability of 86cucumber(CucumissativusL.)microsatellite markers to gherkin(C.anguriaL)[J].ScientiaHorticulturae,2012,136(4):110-114.
[17]ZHU M T(朱明涛),SUN Y L(孙亚林),ZHENG SH(郑 莎),etal.Pyramiding disease resistance genes by molecular marker-assisted selection in tomato[J].ActaHorticulturaeSinica(园艺学报),2010,37(9):1 416-1 422(in Chinese).
[18]YU H(余 辉),SONG W(宋 伟),ZHAO J R(赵久然),etal.Two major resistance genes pyramiding on maize inbred line Jing 24with marker assisted selection[J].MolecularPlantBreeding(分子植物育种),2014,12(2):240-245(in Chinese).
[19]CHENG ZH H(程智慧),LI Y H(李玉红),MENG H W(孟焕文),etal.The relationship between BTH-induced resistance to downy mildew in cucumber seedlings and content of HRGP and lignin in cell wall[J].ScientiaAgriculturaSinica(中国农业科学),2006,39(5):935-940(in Chinese).
[20]YU H J(于洪久),ZHU H D(朱洪德),LIU L J(刘丽君),etal.PAL and POD activities of soybean hypocotyls infected by pythium[J].SoybeanScience(大豆科学),2012,31(3):495-497(in Chinese).
[21]WADA K C,MIZUUCHI K,KOSHIO A,etal.Stress enhances the gene expression and enzyme activity of phenylalanine ammonia-lyase and the endogenous content of salicylic acid to induce flowering in pharbitis[J].JournalofPlantPhysiology,2014,171(11):895-902.
[22]KIM D S,HWANG B K.An important role of the pepper phenylalanine ammonia-lyase gene(PAL1)in salicylic acid-dependent signalling of the defence response to microbial pathogens[J].JournalofExperimentalBotany,2014,65(9):2 295-2 306.
[23]JOSEPH N W,ZHOU X H,CHEN J F.Identification of amplified fragment length polymorphism markers linked to gummy stem blight(Didymellabryoniae)resistance in melon(CucumismeloL.)PI420145[J].HortScience,2009,44(1):32-34.
[24]LI Y(李 英),ZHANG Y B(张永兵),JOSEPH N W,etal.Fruit-body isolation ofDidymellabryoniaeand sporulation conditions of its a stain[J].JournalofFruitScience(果树学报),2007,24(1):84-88(in Chinese).
[25]ISLAM E,DANIEL M,FRANCISCO B F,etal.Functional characterization of a melon alcohol acyl-transferase gene family involved in the biosynthesis of ester volatiles.Identification of the crucial role of a threonine residue for enzyme activity[J].PlantMol.Biol.,2005,59:345-362.
[26]XU B H(徐兵划),QIAN CH T(钱春桃),WANG H Y(王红英),etal.The expression analysis of defense genes in the genes pyramided melon(CucumismeloL)resistance to gummy stem blight[J].JournalofNanjingAgriculturalUniversity(南京农业大学学报),2014,37(5):63-68(in Chinese).
[27]WANG H Y(王红英),QIAN CH T(钱春桃),ZHANG Y B(张永兵),etal.Changes of several physiological characters in melons with different resistances after inoculation withDidymellabryoniae[J].ChinaCucurbitsandVegetables(中国瓜菜),2012,25(1):7-10(in Chinese).
[28]MIAO W G(缪卫国),SONG C F(宋从凤),QIAO Z CH(乔子辰),etal.The generation of reactive oxygen intermediates and expression of defense genes in transgenic hpa1Xoo cotton[J].JournalofNanjingAgriculturalUniversity(南京农业大学学报),2011,34(2):61-66(in Chinese).
