大豆GmF6′H1基因的克隆及功能验证
2015-07-04魏丽娟刘林德
王 蕾,张 娟,魏丽娟,刘林德
(1 鲁东大学 生命科学学院,山东烟台264025;2 鲁东大学 农学院,山东烟台264025)
香豆素是一类广泛存在于高等植物中的次生代谢产物,特别是在伞形科、芸香科、豆科、菊科、瑞香科和木犀科中含量较高[1-2]。在化学结构上,香豆素类化合物是一种具有苯丙α-吡喃酮核的顺式邻羟基肉桂酸内酯。最近大量的科学研究显示,香豆素及其衍生物在农业、工业、医药业发挥着重要作用[3-5]。在真菌或者微生物侵染的植物中香豆素会大量积累,这表明香豆素可能与植物抗逆的防御性反应存在着联系[4];许多传统中草药,如前胡、蛇床子、祖师麻、花椒、秦皮、枳实等,其活性成分就是香豆素及其衍生物[6-8],它们在消炎、抗菌、抑制血栓形成、抗凝血剂、抗肿瘤、抑制中枢神经系统和降低血压等方面临床疗效显著[9-10];在工业方面,香豆素因其特殊味道被用于制造香水、香皂和调味剂[11]。
香豆素在工业、农业和医药业的重要性使得越来越多的研究聚焦于香豆素的合成和提取,但由于工业合成的复杂性和高成本,香豆素在植物中的合成开始受到人们的关注。香豆素结构种类繁多,植物体内许多酶参与了其合成,其生物合成途径是植物苯丙氨酸代谢途径的一个分支,其中阿魏酰辅酶A 6′位的羟基化至关重要。最近的研究发现,一些细胞色素单加氧酶P450是呋喃香豆素生物合成的关键酶,其作用机理是催化伞形花内酯6位或者8位异戊烯化后的羟基化[12-14]。在拟南芥香豆素生物合成途径中,对香豆酸-3′-羟化酶催化对-香豆酰-CoA 3′位羟基化,进而生成咖啡酰辅酶A;接着咖啡酰辅酶A 氧甲基转移酶通过修饰3′位置上氧甲基化产生阿魏酰辅酶A,然后一个依赖于Fe(Ⅱ)和2-酮戊二酸的双加氧酶催化阿魏酰辅酶A 6′位的羟基化,因此该酶被命名为F6′H;上述反应产物6-羟基阿魏酰辅酶A 最终通过顺式/反式异构化和内酯化生成香豆素[15]。
本研究从大豆中克隆了1 个拟南芥AtF6′H1基因的同源基因,通过酶学特性分析其催化活性,并分析在拟南芥Atf6′h1突变体中过量表达对植株中香豆素的含量的影响。探讨不同植物中F6′H同源基因可能存在的作用或调控机制。
1 材料和方法
1.1 植物材料和生长条件
大豆‘黑农35号’种子2012年5月初播种于盆中,置于光照培养箱(28±1)℃,16h光照(5:00~21:00),8h 暗培养,在结荚期分别取同一植株的根、茎、叶和荚果液氮速冻后存于-80℃待用。
拟南芥(Col 0、突变体和转基因)种子常规表面消毒后播种于MS固体培养基上,4℃处理2~3d后置于光照培养箱培养[(21±1)℃,湿度为75%,光照时间同上所述]。幼苗约高为1~2cm 时,在无菌条件下分别移植于终浓度为100μmol/L 2,4-D、水杨酸和激动素的MS固体培养基中,然后依次在处理0h、12h、24h、48h时分别取地上部分和根部材料,液氮速冻。
1.2 方 法
1.2.1 大豆GmF6′H1基因克隆及其EST 序列分析 在大豆基因组数据库(http://www.ncbi.nlm.nih.gov/)中找到一个拟南芥AtF6′H1(At3g13610)和AtF6′H2(At1g55290)[15]的同源序列,根据该序列信息,在开放阅读框两端分别设计GmF6′H1正向引物GmF6′H1-F(atgtcttccactcccaccaatctc)和反向引物GmF6′H1-R(tcatatcatggcaaattcaatag)。
取大豆新鲜叶片约1g,提取总RNA。大豆总RNA 提取采用Qiagen公司的RNeasy Plant Mini Kit试剂盒(Qiagen,Cat.No.74903),具体操作步骤参照说明书进行。cDNA 第一链合成采用宝生物公司PrimeScript RT reagent Kit with gDNA Eraser(宝生物,DRR047S)试剂盒并参考其使用说明进行操作,以合成的第一链cDNA 为模板,以GmF6′H1-F和GmF6′H1-R 为引物,利用普洛麦格公司的GoTaq? DNA 聚合酶(普洛麦格,M3005)进行PCR扩增。扩增所得PCR 产物与pGM-T 载体(天根公司,VT302)连接后导入大肠杆菌DH5α,鉴定正确后送公司测序(华大公司)。序列的比对和同源比较利用Vector NTI软件(Invitrogen)进行分析。
1.2.2 实时荧光定量PCR 分析 分别提取液氮速冻收集的大豆各种材料总RNA,DNase I处理以消除基因组DNA 污染。第一链cDNA 合成见1.2.1。实时荧光定量PCR 分析采用天根公司SYBRGreen using RealMasterMix(SYBR Green)试剂盒(TIANGEN,China,FP202)。反应条件为94℃预变性2min;94℃变性15s,58℃退火15s,68℃延伸40s;35个循环。通过比较循环阈值法进行初始转录物浓度估算[16],大豆Ubiquitin基因(D28123)作为内标。实时荧光定量PCR 所用的引物如下:大豆Ubiquitin(D28123)利用Ubiquitin-F(tctgacaccattgacaatgtg)和 Ubiquitin-R(cttctggatgttgtagtcagc);大豆GmF6′H1利用GmF6′H1-F 和GmF6′H1-R。
1.2.3 原核表达载体的构建和重组蛋白的诱导表达 利用带有特殊限制性酶切位点的引物GmF6′H1-BamHⅠF(aaggatccatgtcttccactcccaccaatc)和GmF6′H1-XhoⅠR(aactcgagtcatatcatggcaaattcaatag)扩增GmF6′H1基因编码区。用BamHⅠ、XhoⅠ对GmF6′H1基因PCR 产物和表达载体pET32a分别进行双酶切,琼脂糖凝胶电泳回收酶切片段。利用T4DNA 连接酶连接后转化大肠杆菌DH5α感受态细胞,挑取阳性克隆进行菌落PCR 和酶切鉴定,鉴定正确的质粒送华大基因公司测序,确保重组表达载体的正确性,最终获得正确的重组表达载体pET32a-GmF6′H1。
利用CaCl2化学转化法,将pET32a-GmF6′H1质粒转入大肠杆菌TransBL21(DE3)感受态细胞。利用菌落PCR 对阳性克隆进行鉴定,鉴定正确的单菌落进一步诱导蛋白表达。带有pET32a-GmF6′H1质粒的大肠杆菌BL21单菌落接种于含有100ng/mL氨苄青霉素LB液体培养基中,37℃过夜培养。然后将过夜培养的菌液以1∶100的比例接种于50 mL含有100ng/mL氨苄青霉素的LB 液体培养基中,培养至OD600达0.3 左右。此时将培养液转入20℃摇床中培养1h后加入终浓度为0.5mmol/L IPTG,继续培养16h。将培养完成的菌液4 000g、4℃离心10min收集菌体细胞,然后用冰冷的裂解缓冲液[50mmol/L Tris-Cl,pH 8.0,0.25mmol/L NaCl,1 mmol/L DTT,1 mmol/L EDTA,0.25 mmol/L PMSF(使用前加入)]重悬,超声波破碎后,4℃离心10 min,上清上样于Ni-Agarose His标签蛋白纯化试剂盒(康为世纪,CW0894)层析柱,冲洗3遍后,用溶解缓冲液洗脱目标蛋白。纯化的蛋白质的浓度利用生工生物公司的Modified Bradford Protein Assay Kit(生工生物,SK3041)试剂盒进行测定,取少量蛋白质用于聚丙酰胺凝胶电泳检测,纯化的目的蛋白立即用于酶活性鉴定。
1.2.4 GmF6′H1的酶活性分析 GmF6′H1的酶活性分析参照Kai等[15]的文献。100μL 酶反应体系中包含1.2μg蛋白,100mmol/L Tris/HCl,pH 6.5,1.0 mg/mL BSA,0.5 mmol/L FeSO4,5 mmol/L 2-酮 戊二酸钠,5 mmol/L 抗坏血酸钠,1 mmol/L阿魏酰辅酶A,30℃反应1 min。反应完成后,加入20μL 3mol/L NaOH 放置于37℃10 min以终止反应,然后加入20μL 醋酸。反应混合物15 000g 离心10 min,上清进行高效液相色谱(HPLC)分析。HPLC分析的条件为C18柱,流动相为25%(体积比)的甲醇(含有0.1%的甲酸),流速为每分钟1.0 mL,温度为40℃,检测波长为348 nm。酶的活性鉴定所用的试剂均购自上海生工生物工程股份有限公司,阿魏酰辅酶A 来自于余晓丹博士的馈赠。
1.2.5 植物转化载体的构建 拟南芥Atf6′h1的突变体(SALK_129938)购置于美国Salk研究所基因组分析实验室(Ohio State University,Columbus,OH,USA)。依据T-DNA 插入鉴定的原理(http://signal.salk.edu/tdnaprimers.2.html),在线设计3条引物LBb1.3(ATTTTGCCGATTTCGGAAC)、LP(GGTCGGGATTCTAATCTCAGC)和RP(AGAAGATGGTGAGGAGGCTTC)以筛选鉴定突变体纯合系。
载体p1300-35S-GmF6′H1用于在拟南芥突变体Atf6′h1中过量表达GmF6′H1。利用PCR 从已测序正确的T-GmF6′H1 扩增GmF6′H1 编码区,扩增引物带有特异的限制性酶切位点BamHⅠ和SalⅠ,PCR 片段分别用BamHⅠ和SalⅠ双酶切后,与经过同样双酶切的质粒pCambia1300进行连接,连接产物转化大肠杆菌DH5α,阳性克隆进行菌落PCR 和酶切鉴定。鉴定正确的质粒利用电转化的方法转入农杆菌GV3101以备植物转化侵染。
1.2.6 植物转化 拟南芥转化方法参照Bent[17]的方法。拟南芥Atf6′h1突变体种子4℃春化2~3d后播种于用B5 营养液浸泡过的含有蛭石的种植盆,随后于23℃培养。待植物开花后,剪去其主枝顶端,促侧枝发展。在剪枝后的4~6d内,进行农杆菌转化。将植株倒置于含p1300-35S-GmF6′H1质粒的农杆菌转化缓冲液的玻璃瓶中,维持30s,取出种植盆,在暗处保湿侧放24h,然后将种植盆直立,按正常的方法培育植株至结实,收获成熟种子。
转基因植株的纯合系筛选参照文献[18]进行,转 基因植 株DNA提取采用CTAB法[18]。PCR 鉴定时分别利用潮霉素和GmF6′H1 的特异引物检测,反应体系为DNA 模板1μL,10×PCR 缓冲液2 μL,2.5mmol/L dNTP 0.4μL,10μmol/L 的正反向引物各1μL,rTaq1U,ddH2O 补齐到20μL。反应条件为94℃预变性3min,94℃变性30s,55℃退火30s;72℃延伸1.5min;35个循环后,72℃总延伸10min。
1.2.7 香豆素的定量分析 拟南芥植株中香豆素含量的测定方法见文献[19],植物材料液氮研磨后悬浮在冰冷的甲醇中22h,甲醇溶液中含有4-羟甲香豆素作为内标。提取液15 000g离心10min,上清用于HPLC分析,分析条件见1.2.4。
2 结果与分析
2.1 大豆GmF 6′H 1的克隆
用拟南芥AtF6′H1(At3g13610)和AtF6′H2(At1g55290)[5,15]的基因序列BLAST搜索大豆的EST 据库(Gene Index),检测到一个EST 片段(TC440182)与拟南芥AtF6′H1和AtF6′H2一致性高达60%,没有发现其它一致性更高的EST 序列。序列分析显示TC440182具有完整的开放阅读框,把该基因命名为GmF6′H1。利用该序列BLAST 搜索大豆基因组文库(NCBI,http://www.ncbi.nlm.nih.gov/),在染色体18和8上均发现了GmF6′H1基因片段,这表明GmF6′H1基因具有2个基因拷贝,由于大豆是四倍体的双子叶植物,因此一个基因在基因组中很可能存在着多个拷贝。基因组序列和cDNA序列比对发现,GmF6′H1和AtF6′H1以及AtF6′H2 具有相同的内含子结构。氨基酸序列比对显示(图1),GmF6′H1和AtF6′H1以及AtF6′H2分别具有54%和53%一致性。根据得到的序列信息设计特异引物,利用RT-PCR 扩增GmF6′H1全长cDNA 序列,PCR 扩增片段,连接pGEM-T 载体后转化大肠杆菌,阳性克隆鉴定正确后送公司测序。该基因序列已经上传NCBI(KJ463390)。多次测序结果显示,该基因与NCBI基因组文库中的相应序列有一个氨基酸的差异,这有可能是基因来源的大豆品种不同造成的。
大豆GmF6′H1氨基酸序列分析显示,该蛋白具有一个2OG-Fe(Ⅱ)氧化酶超级家族的保守区域。在其N-末端有一个非血红素双脱氧酶区域,该区域也是依赖于2-酮戊二酸和Fe(Ⅱ)双氧化酶活性的蛋白保守区段。该蛋白还具有一个2OGD 超级家族保守的Fe(Ⅱ)结合区域H225-X-D227-Xn-H283,AtF6′H1也有该区域。另外,在GmF6′H1中还发现了一个结合C5 羧基基团的保守区域(R293-X-S295)。利用Swiss-Model工作站,根据推断的氨基酸序列,预测了GmF6′H1、AtF6′H1和AtF6′H2蛋白的三级结构,这3个蛋白具有非常相似的三级结构[20],这也暗示了GmF6′H1可能和AtF6′H1以及AtF6′H2具有相同的酶学特性,GmF6′H1可能是大豆香豆素合成途径中的关键酶。

图1 大豆与拟南芥F6′H 氨基酸序列同源性分析Fig.1 Amino acid alignment of GmF6′H1with AtF6′H1and AtF6′H2fromArabidopsis
2.2 GmF 6′H 1的转录表达模式分析
以大豆Ubiquitin基因为内参,利用实时定量PCR 研究了GmF6′H1 在各个组织器官中的表达模式,结果(图2)表明,GmF6′H1在大豆的根中表达量最高,这暗示着大豆根中的香豆素含量最高。对拟南芥的研究也发现,香豆素类物质东莨菪素及其吡喃葡萄糖苷东莨菪苷在野生型的根中含量最高,是地上部分的180倍,这间接印证了香豆素类物质东莨菪素及其衍生物主要在植物的根系中发挥重要作用,可能与植物的抗逆反应机制有一定的关系,相关的研究也发现,真菌和微生物侵染的植物根系会有香豆素类物质的大量积累[21-22]。在大豆的其它组织器官中,GmF6′H1基因的表达量也相对较高,而在拟南芥中AtF6′H1和AtF6′H2主要在根部表达,在地上部分的表达量极低,几乎检测不到,但是2,4-D 的处理能够诱导AtF6′H2 在地上部分的表达。这暗示着不同植物F6′H 的作用和调控机制存在差异,它们可能有不同的底物特异性,这需要进一步的研究进行印证。
同时,本实验研究了不同处理对大豆GmF6′H1转录表达水平的影响。分别用2,4-D、水杨酸和激动素处理了播种10d左右的大豆幼苗,取材时间为处理0、12、24 和48h。取材时分地上部分和根部,液氮速冻。然后分别提取各部分、各时间段材料的总RNA,反转录成cDNA 进行实时荧光定量PCR 反应。结果显示,2,4-D 的处理对大豆GmF6′H1的表达影响很小。但是水杨酸和激动素的处理均显著提高了该基因的表达水平,然而随着处理时间的延长,GmF6′H1的转录表达水平稳定下降,最后接近处理前的水平(图3)。这暗示了GmF6′H1基因在大豆生物抗逆中发挥着重要的作用,同时也说明了植物对逆境的适应性,当逆境胁迫达到一定时间后,植物会通过调控自身基因的表达来适应逆境,继续保持稳定的生长。

图2 大豆不同器官中GmF 6′H 1PCR 分析Fig.2 Expression pattern of GmF 6′H 1in different organs of soybean revealed by real-time PCR
2.3 GmF6′H1酶活性鉴定
带有组氨酸标签的GmF6′H1在大肠杆菌中表达后,利用Ni-NTA 琼脂糖层析柱纯化重组蛋白,GmF6′H1在大肠杆菌中诱导表达和纯化的蛋白见图4。然后通过测定该蛋白是否能够催化底物的邻位羟基化来验证其酶学特性。以不加蛋白的反应混合物为阴性对照,当以阿魏酰辅酶A 为底物时,一个邻位羟基化的产物通过经反式/顺式异构化和内酯化的自发过程生成了东莨菪素。HPLC检测到一个产物的吸收峰,该吸收峰的紫外吸收光谱与东莨菪素相似(图5)。这些结果表明,大豆GmF6′H1能够催化阿魏酰辅酶A邻位的羟基化,属于依赖于Fe(Ⅱ)和2-酮戊二酸依赖的双加氧酶。
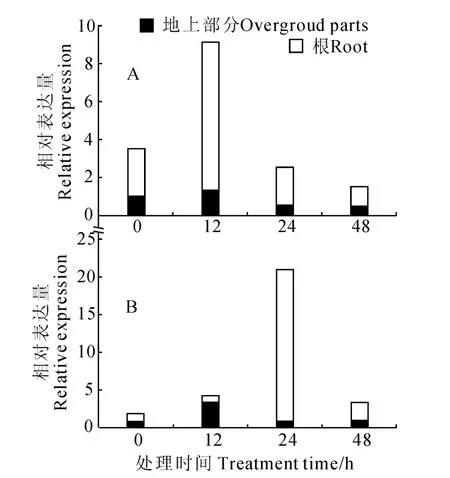
图3 水杨酸(A)和激动素(B)处理后地上部和根中GmF 6′H 1表达Fig.3 Expression pattern of GmF 6′H 1under the treatments of alicylic acid(A)and kinetin(B)
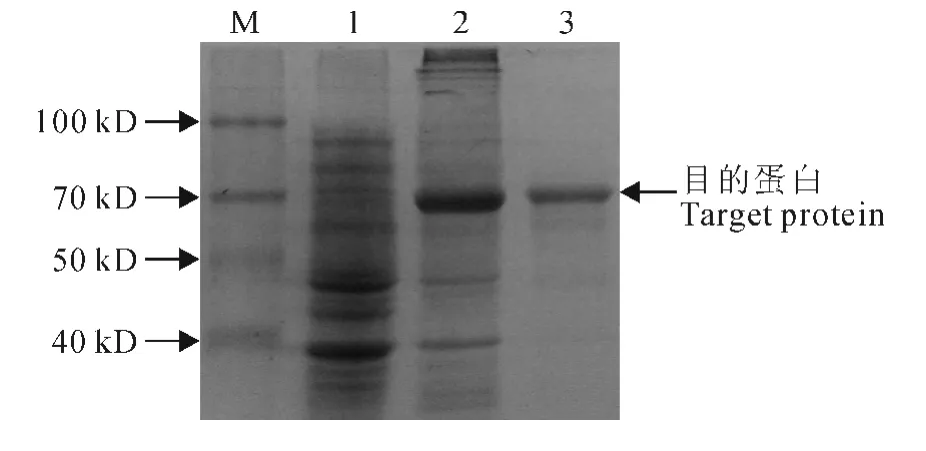
图4 GmF6′H1蛋白表达和纯化的SDS-PAGE检测Fig.4 SDS-PAGE analysis of the expression of GmF6′H1
2.4 GmF6′H1参与植物香豆素合成的功能分析
为了更好地理解GmF6′H1的功能,在拟南芥Atf6′h1突变体中过量表达了大豆的GmF6′H1,以便观察该蛋白是否能把拟南芥的突变体恢复成野生型。在35S启动子下的GmF6′H1通过农杆菌转化的方法转入拟南芥Atf6′h1突变体植株。共获得5个独立的RT-PCR验证正确的转基因系,转基因拟南芥与Atf6′h1突变体植株外在表型没有观察到明显的差异(图6)。依据文献[19]提供的方法测定转基因植株根系的香豆素含量,同时提取拟南芥野生型和拟南芥Atf6′h1 突变体根系香豆素作为对照。HPLC分析结果(图7)显示,GmF6′H1过量表达的转基因株系根中香豆素的含量相比较拟南芥突变体本身有所提高,与野生型拟南芥中香豆素含量接近。这表明GmF6′H1与AtF6′H1有相似功能,均在香豆素生物合成的过程中发挥着关键作用。拟南芥野生型和突变体含量比较与已发表的结论相似[15]。
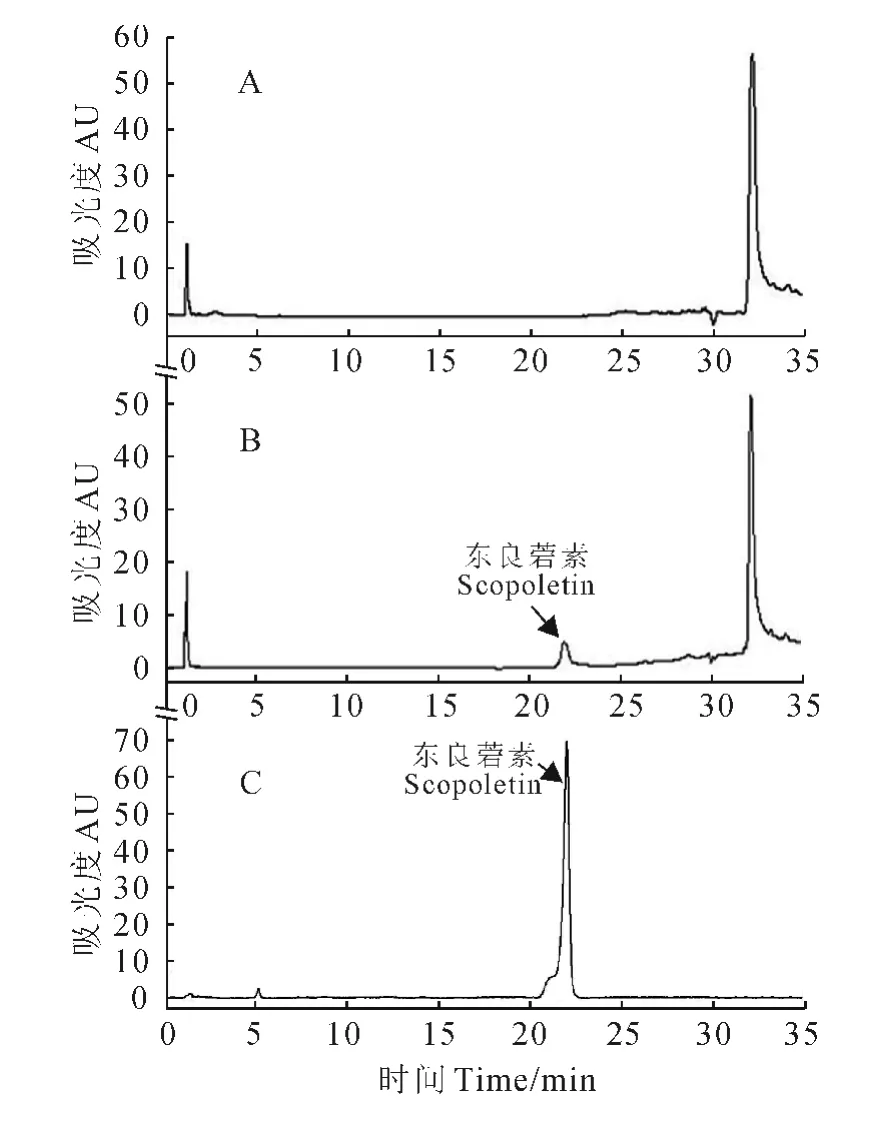
图5 大豆GmF6′H1酶活性鉴定的HPLC分析Fig.5 HPLC profiles of extracts from different reaction systems

图6 拟南芥突变体与转基因株系表型Fig.6 The phenotype comparison among Arabidopsis
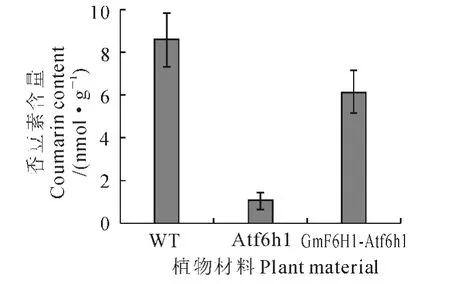
图7 各材料根系中香豆素的含量比较Fig.7 Coumarin content in roots from different plants
3 讨 论
尽管目前很多研究显示香豆素及其衍生物在植物对病原菌的抗逆过程中发挥着重要作用,但是其机制并不清楚,很多植物香豆素合成的关键酶尚未知晓,而香豆素本身的医疗作用已经使人们越来越关注它。为了更深入地理解香豆素在植物中的作用,本研究获得了1个大豆的香豆素合成关键基因GmF6′H1,并通过一系列的实验研究了其酶学生化特性,同时利用基因的表达模式分析和互补实验探索了其在植物中的生物学功能。
在过去的几十年里,大豆的营养价值越来越受到人们的关注,其次生代谢的研究已经非常深入,然而在大豆植物化学物质中,异黄酮是目前讨论最多的“健康促进因子”,而香豆素却并没有引起足够的重视。由于香豆素在植物抗逆反应中也发挥着一定的作用,因此探索植物香豆素合成的关键酶显得至关重要。同异黄酮相似,香豆素也是一组苯酚类次生代谢物,并且其生物合成途径也是苯丙氨酸代谢途径的一个分支。苯丙氨酸生物合成途径起始于L-苯丙氨酸,该氨基酸经苯丙氨酸解氨酶、肉桂酸-4-羟化酶、4-香豆酸:辅酶A 连接酶、香豆酸-3′-羟化酶、咖啡酰辅酶A 氧甲基转移酶被催化生成阿魏酰辅酶A。接着阿魏酰辅酶A 经过邻位的羟基化,以及反式/顺式异构化和内酯化的过程,最终生成香豆素类物质东良菪素,其中后两步的过程是自发的,不需要酶的催化,因此邻位羟基化是植物中香豆素合成的关键步骤[15]。目前仅在拟南芥中报道发现了一个催化邻位羟基化的香豆素生物合成关键酶AtF6′H1。该酶是一个依赖于Fe(Ⅱ)和2-酮戊二酸的双加氧酶,能够催化阿魏酰辅酶A 的6′位羟基化生成东良菪素[15]。在大豆中,利用同源克隆的方法获得了1个拟南芥的同源基因GmF6′H1。氨基酸序列比对的分析结果显示,该酶与拟南芥AtF6′H1、AtF6′H2 的一致性很高。分别利用GmF6′H1、AtF6′H1和AtF6′H2氨基酸序列进行了三维结构预测,结果表明,GmF6′H1 和拟南芥AtF6′H1、AtF6′H2 具有相似的空间结构和作用位点。而且GmF6′H1的酶学特性分析也显示,该蛋白能够以阿魏酰辅酶A 为底物催化其6′位羟基化生成东良菪素,这表明大豆GmF6′H1也是香豆素生物合成关键酶。与此同时,在拟南芥Atf6′h1突变体中过量表达GmF6′H1明显提高了转基因植株根系中的香豆素含量,与拟南芥野生型根中的香豆素含量接近,进一步印证了大豆GmF6′H1的功能。将来,利用过量表达和RNA 抑制的方法,在大豆中研究GmF6′H1的功能可能会更深入地揭示其更多的生物功能。
基因表达模式的分析结果显示,与拟南芥AtF6′H1相比,GmF6′H1存在着独特的转录表达模式。GmF6′H1 在大豆的根、茎、叶、荚果中均有表达,而拟南芥AtF6′H1主要在根中表达,在地上部分其表达量极低,这说明大豆中香豆素在根和地上部分都发挥着重要作用,或者是GmF6′H1在地上部分以其他物质为底物催化化合物生成。在根中,香豆素可能和异黄酮一样,作为一种植物根系分泌的一种信号物质,吸引相应的微生物与根系形成共生关系,促进植物的营养吸收,或者作为一种化学物质抑制微生物在根系的生长,相关研究也发现香豆素类化合物不仅能够触杀一些农业害虫[23],而且对一些植物病原真菌有显著的抑制作用[24]。在地上部分,香豆素可能以其特殊的味道增强了植物的抗菌、抗虫性,而且有研究也发现香豆素能够抵抗紫外线的照射,并且紫外线照射能够提高香豆素的抑菌性[4]。当用抗逆信号分子水杨酸和激动素处理大豆的幼苗时,GmF6′H1 在地上部分和根中都被强烈地诱导表达,而2,4-D 对该基因的表达没有明显的作用,这表明GmF6′H1在大豆正常生长和抗逆过程中可能都发挥着重要作用,由于大豆本身的香豆素种类就很繁杂,因此与拟南芥AtF6′H1相比,大豆GmF6′H1可能有更广的底物范围,也可能是不同植物中的香豆素合成酶存在不同的调控机制。由于目前报道的以辅酶A 为底物的双加氧酶并不多见,因此对大豆GmF6′H1的反应机制和底物特异性进行进一步的深入探讨将会为今后的研究提供更多的借鉴。
[1]孔令义.香豆素化学[M].北京:化学工业出版社,2008:1-10.
[2]周荣汉,段金廒.植物化学分类学[M].上海:上海科学技术出版社,2005:500-513.
[3]LIU R,SUN Q,SUN A,etal.Isolation and purification of coumarin compounds fromCortexfraxinusby high-speed counter-current chromatography[J].JournalofChromatographyA,2005,1 072(2):195-199.
[4]VALLE T,LOPEZ J L,HERNANDEZ J M,etal.Antifungal activity of scopoletin and its differential accumulation inUlmuspumilaandUlmuscampestriscell suspension cultures infected withOphiostomaulmispores[J].PlantScience,1997,125(1):97-101.
[5]GARCIA D,SANIER C,MACHEIX J J,etal.Accumulation of scopoletin inHeveabrasiliensisinfected byMicrocyclusulei(P.Henn.)V.ARX and evaluation of its fungitoxicity for three leaf pathogens of rubber tree[J].PhysiologicalandMolecularPlantPathology,1995,47(4):213-223.
[6]LIANG X L,LIAO Z G,ZHU J Y,etal.The absorption characterization effects and mechanism ofRadixangelicaedahuricae extracts on baicalin inRadixscutellariaeusinginvivoandinvitroabsorption models[J].JournalofEthnopharmacology,2012,139(1):52-57.
[7]WANG Y Y,HE S,CHENG X C,etal.UPLC-Q-TOF-MS/MS fingerprinting of Traditional Chinese Formula Sijunzitang[J].Journalof PharmaceuticalandBiomedicalAnalysis,2013,80:24-33.
[8]HE W Y(何文英),YAO X J(姚晓军),HU ZH D(胡之德),etal.Comparison between psoralen and isopsoralen binding to human serum albumin[J].ActaPhysico-ChimicaSinica(物理化学学报),2010,26(1):221-229(in Chinese).
[9]XU L N,NA W L,LIU X,etal.Identification of natural coumarin compounds that rescue defective Delta F508-CFTR chloride channel gating[J].ClinicalandExperimentalPharmacologyandPhysiology,2008,35(8):878-883.
[10]TAN R X,MENG J C,HOSTETTMANN K.Phytochemical investigation of some traditional Chinese medicines and endophyte cultures[J].PharmaceuticalBiology,2000,38(1):25-32.
[11]LAMNAOUER D.Anticoagulant activity of the coumarins fromFerulacommunisL.[J].Therapie,1999,54(6):747-751.
[12]LARBAT R,HEHN A,HANS J,etal.Isolation and functional characterization of CYP71AJ4encoding for the first P450monooxygenase of angular furanocoumarin biosynthesis[J].JournalofBiologicalChemistry,2009,284(8):4 776-4 785.
[13]LARBAT R,KELLNER S,SPECKER S,etal.Molecular cloning and functional characterization of psoralen synthase,the first committed monooxygenase of furanocoumarin biosynthesis[J].JournalofBiologicalChemistry,2007,282(1):542-554.
[14]STANJEK V,MIKSCH M,LUEER P,etal.Biosynthesis of psoralen:Mechanism of a cytochrome p450catalyzed oxidative bond cleavage[J].AngewandteChemie-InternationalEdition,1999,38(3):400-402.
[15]KAI K,MIZUTANI M,KAWAMURA N,etal.Scopoletin is biosynthesized via ortho-hydroxylation of feruloyl CoA by a 2-oxoglutaratedependent dioxygenase inArabidopsisthaliana[J].ThePlantJournal,2008,55(6):989-999.
[16]SUBRAMANIAN S,HU X,LU G H,etal.The promoters of two isoflavone synthase genes respond differentially to nodulation and defense signals in transgenic soybean roots[J].PlantMolecularBiology,2004,54(5):623-639.
[17]BENT A F,KUNKEL B N,DAHLBECK D,etal.RPS2ofArabidopsisthaliana:a leucine-rich repeat class of plant disease resistance genes[J].Science,1994,265(5 180):1 856-1 860.
[18]YUAN H Y(院海英),WU X H(吴祥辉),DONG Y(东 锐),etal.Expression analysis ofGFPgene inOlimarabidopsispumilaandArabidopsisthaliana[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(5):881-885(in Chinese).
[19]KAI K,SHIMIZU B,MIZUTANI M,etal.Accumulation of coumarins inArabidopsisthaliana[J].Phytochemistry,2006,67(4):379-386.
[20]ARNOLD K,BORDOLI L,KOPP J,etal.The SWISS-MODEL workspace:a web-based environment for protein structure homology modelling[J].Bioinformatics,2006,22(2):195-201.
[21]HUGHES J C,SWAIN T.Scopolin production in potato tubers infected with phytophthora infestans[J].Phytopathology,1960,50:398-400.
[22]HOULT J R S,PAYA M.Pharmacological and biochemical actions of simple coumarins:natural products with therapeutic potential[J].GeneralPharmacology,1996,27(4):713-722.
[23]ZHENG Y(郑 艳),XU L SH(徐珞珊),WANG ZH T(王峥涛),etal.Distribution and dynamicchange of coumarinsin leaf and root ofDendrobiumthyrsiflorum[J].ChinaJournalofChineseMateriaMedica(中国中药杂志),2009,34(9):1 071-1 074(in Chinese).
[24]SHI ZH Q(石志琦),SHEN SH G(沈寿国).Inhibition mechanism of osthol to plant fungus pathogens[J].ChineseJournalofPesticide Science(农药学学报),2004,6(4):28-32(in Chinese).
