分子印迹电化学发光分析
2015-07-02李素萍关怀民徐国宝4童跃进
李素萍关怀民徐国宝*,4童跃进*
(福建师范大学化学与化工学院1,材料科学与工程学院2,福建省高分子材料重点实验室3,福州 350007)4(中国科学院长春应用化学研究所电分析化学国家重点实验室,长春 130022)
评述与进展
分子印迹电化学发光分析
李素萍1关怀民2,3徐国宝*1,4童跃进*1
(福建师范大学化学与化工学院1,材料科学与工程学院2,福建省高分子材料重点实验室3,福州 350007)4(中国科学院长春应用化学研究所电分析化学国家重点实验室,长春 130022)
分子印迹电化学发光兼具分子印迹技术及电化学发光方法两者的优点,即高灵敏度、高选择性、可控性好、易于微型化和操作简单等特点。近几年来在生物仿生传感器、有害农药残留物质及食品安全监测等方面具有广泛的应用。本综述简要介绍分子印迹电化学发光传感器及分子印迹固相萃取电化学发光的概况,并对其今后的研究趋势进行展望。
分子印迹;电化学发光;综述
1 引 言
电化学发光(Electrochemiluminescence,ECL)是通过电化学激发反应产生发光的现象[1]。与其它分析技术相比,ECL具有灵敏度高、可控性好、线性范围宽、装置简单、成本低等优点。近年,电化学发光的研究得到了蓬勃发展。商品化的电化学发光免疫分析和DNA探针分析被广泛应用于医疗诊断、食品安全、生物战试剂检测以及环境监测等多种领域[2]。电化学发光还被用做高效液相色谱、毛细管电泳以及微流控芯片的检测器,用于检测众多的共反应物,特别是含有氨基的各种物质[3~5]。
分子印迹技术(Molecularly imprinted technology,MIT)是一种以目标分子(模板分子或印迹分子)为模板,合成对该分子具有特异性识别功能的聚合物的技术。MIT最早起源于免疫学,1931年,前苏联科学家Polyakov[6]首次提出“分子印迹”这一概念。该技术最初是从受体-抗体相互作用得到启发,融合了高分子化学、分子识别技术、仿生物学等形成的。而标志“分子印迹”萌芽的是1949年Dickey提出的“专一性吸附”概念。经过80多年的发展,分子印迹聚合物这一概念演变成包含了各式各样的有机高分子,极大地丰富了分子印迹的研究内容。MIT的研究核心内容则是分子印迹聚合物(Molecularly imprinted polymer,MIP)[7,8],通过MIP的特异性识别位点可以实现了从非生物活体获得“抗体”[9]。与其它传统的传感器相比,分子印迹传感器[10~12]具有对目标分子高度专一识别性,此外其在机械稳定性和热稳定性方面也不逊色于化学传感器,已经广泛应用于药物分析[13]、环境有害物质痕量分析[14,15]、固相萃取[16,17]和色谱分离[18]等各个研究领域。
随着生命科学技术、材料科学和现代分析检测手段的深入研究,分子印迹电化学传感器在各方面都得到了更加广泛的应用。尽管如此,分子印迹电化学传感器毕竟发展时间较短,还有诸如电流效率通常较低和检测信号较弱等很多问题等待研究者进一步解决。
ECL在灵敏度和可控性方面具有独特的优势,而MIP在特异性识别方面具有独特的优势,将二者有机结合起来,构建新型的MIP-ECL检测方法用于分析领域将是一个活跃的研究方向。因此本综述将简要介绍分子印迹电化学发光近几年的研究进展,并对其进行展望。
2 分子印迹-电化学发光传感器的发展与应用
目前,MIP-ECL传感器已在检测残留痕量农药[19~22]、毒品[23,24]、药物[25]、双酚 A[26]、氨基酸[27]和蛋白质[28,29]等方面显现出了特有的优点。以下将简要阐述该传感器的应用。
2.1 蛋白质的检测
蛋白质是一类重要的生物大分子,是生命的物质基础。如血红蛋白是血红细胞中运载氧气和二氧化碳分子保持身体血液酸碱平衡的一类重要含铁蛋白质。在临床上,血红蛋白的浓度与地中海贫血、白血病、心脏疾病等的诊断密切相关。因此,精确定量检测血红蛋白水平在临床上有着重要的应用。至今为止,已应用如光谱、电化学方法和化学发光以及ELISA多种检测分析方法来检测。应用分子印迹技术能够创建比天然受体更能承受极端环境条件如高温、高压及极端pH值等的合成受体。因此应用分子印迹技术检测蛋白质的方法在近十多年来也受到了研究者们的密切关注[30~34]。Wu等[30]基于分子印迹技术在血红蛋白模板存在下电化学聚合丙烯酰胺构建血红蛋白电化学传感器。以铁氰化钾作为表征印迹膜的探针,该MIP电极显现出了对模板分子特异的识别性能和高的灵敏度。Kan等[32]以共价法将血红蛋白嫁接于功能化后的磁性Fe3O4纳米颗粒表面,再通过溶胶凝胶表面印迹聚合制得核壳微纳米磁性分子印迹聚合物。该印迹聚合物对目标分子的吸附量在pH 6.5条件下达到10.5 mg/g,相较于非印迹聚合物高出了4.6倍。
相较于以上各种技术的发展,Zhou等[28]基于磁性分子印迹聚合物(MMIPs)作为捕获探针制备单抗体“三明治”型电化学发光免疫传感器用于检测血红蛋白。他们首先在磁性Fe3O4纳米颗粒表面以溶胶凝胶法及表面印迹技术合成MMIPs,并将抗体修饰于Ru@SiO2@Au纳米复合材料上,作为与目标分子结合的标记物。当目标分子富集于MMIPs上后,带有ECL信号标记的抗体与目标分子相结合。最后,通过磁场作用将制备好的“三明治”型免疫复合物修饰于丝网印刷碳电极上,在最优条件下进行ECL测试。该传感器线性范围为0.1~4×104μg/L,检出限(S/N=3)为0.023 μg/L。相比于传统的双抗体三明治型电化学发光免疫传感器,该传感器具有以下优点:(1)MMIP捕获探针成本相对比较低,易量产,且克服了普通抗体捕获探针易失活等不利因素;(2)该探针易固定在电极上,也容易通过施加和移除磁场来洗脱掉,所以,该传感器能够简单的生产和再生;(3)该探针比普通探针具有更多识别的结合位点,使得MMIPs能够富集溶液中超痕量的抗原,极大地增强了检测灵敏度。
Zhou等[29]在上述技术基础上,应用溶胶凝胶法和表面分子印迹及抗原决定基法印迹技术在磁性Fe3O4纳米颗粒表面合成以人类免疫球蛋白 G (Human IgG)为模板的磁性分子印迹聚合物(MMIPs),将该MMIPs作为捕获探针构建了检测人类免疫缺陷病毒1型抗体(anti-HIV-1)的“三明治”型电化学发光免疫传感器,如图1所示。其中,抗原决定基印迹法是应用假模板进行印迹,即用Human IgG代替anti-HIV-1作为印迹模板,Human IgG具有与anti-HIV-1相同的Fc区以及不同的Fb区,当anti-HIV-1在MMIPs上富集后,不同的Fb区可以用掩蔽剂进行掩蔽。作者应用MMIPs代替HIV-1抗原作为捕获探针,辣根过氧化物酶(HRP)修饰的 HIV-1 (HRP-HIV-1)作为传感器的标记物,当目标分子anti-HIV-1富集于MMIPs上后与溶液中的标记物相结合形成“三明治”型免疫复合物。最后,通过磁场作用将其修饰于丝网印刷碳电极上,结合HRP在鲁米诺-双氧水(luminol-H2O2)ECL系统中催化作用,检测鲁米诺的发光强度,从而实现目标分子的检测。首先,该传感器应用了假模板进行印迹,假模板易得,成本相对较低;其次,聚合得到的MMIPs易量产,且能够通过洗脱模板重复使用,大大降低了免疫传感器的成本;最后,ECL检测方法的应用,增强了传感器的灵敏度,得到了抗体稀释度为1∶20000~1∶50的检测范围和1∶60000(S/N=3)的检出限。在人血清样本的检测中结果表明,所研制的“三明治”型免疫传感器比单独的MMIPs的抗干扰能力更强,主要是因为抗原抗体的高度专一识别能力,使其选择性更好。该方法具备制备简单、成本较低、灵敏度和选择性高等优点,在生化分析领域具有潜在应用价值。
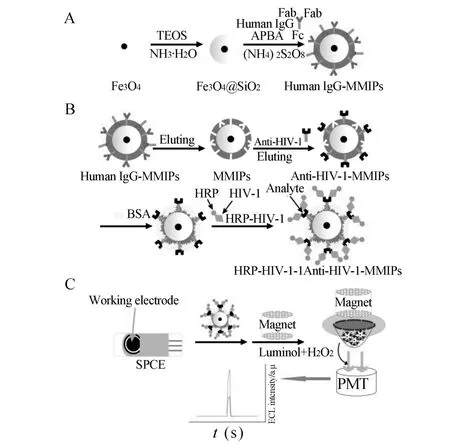
图1 检测anti-HIV-1的“三明治型”MIP-ECL免疫传感器构建过程[29]Fig.1 Procedure for constructing a MIP-ECL immunosensor and the determination of anti-human immunodeficiency virus-1(HIV-1)[29]
2.2 农药的检测
农药残留等问题一直是全球关注的食品安全问题。检测方法的简便快速和经济高效一直是分析领域研究的目标,MIP-ECL方法的出现为农药检测提供了一种新的有效方法。
Li等[19]构建MIP-ECL传感器用于超痕量异丙隆除草剂(IPU)的检测,该检测主要是基于目标分子IPU与葡萄糖氧化酶(GOD)标记的IPU(GOD-IPU)间的竞争反应。作者以IPU为模板在金电极上电聚合邻氨基酚单体合成分子印迹膜。用IPU将印迹孔穴屏蔽后,将其浸渍于GOD-IPU的溶液中,得到GOD-IPU替代IPU的分子印迹膜。再将其浸渍于样品溶液中,样品溶液中的IPU与MIP膜上GOD-IPU发生竞争反应。待反应后,分子印迹膜上残留的GOD-IPU催化葡萄糖产生双氧水,与鲁米诺反应,增强电化学发光信号。当GOD-IPU分子被样品中IPU分子取代后,电化学发光强度减少。因此,可以根据该电化学发光信号的减弱,定量分析模板分子IPU的浓度。基于葡萄糖氧化酶的催化作用,该传感器的电化学发光信号增强,具有灵敏度和选择性高、响应快、检出限低等优点。该法的检测范围为9×10-11~5.1×10-9mol/L,检出限为3.78×10-12mol/L。与检测IPU的其它方法相比,检出限更低。在应用该传感器检测水溶液样品时,回收率达到98.5%~102.1%。

图2 用于检测GA3的ECL-MIP传感器的构建过程[22]Fig.2 Procedure to construct a MIP-ECL sensor and determination of gibberellin A3(GA3)[22]
Li等[22]基于赤霉素A3(GA3)和罗丹明B(RhB)标记的GA3(RhB-GA3)在分子印迹膜上的竞争结合反应构建检测GA3的新型MIP-ECL传感器,如图2所示。作者在金电极上用电聚合法以邻苯二胺作为单体,GA3作为模板分子进行印迹得到印迹膜。用 GA3将印迹孔穴屏蔽后,将其浸渍于 RhB-GA3的溶液中,得到RhB-GA3替代GA3的分子印迹膜,将此电极应用于GA3的检测。样品中GA3与电极上的RhB-GA3竞争反应后,分子印迹膜上残余的RhB-GA3被电化学氧化产生RhB氧化产物。该氧化产物能够与溶液中的溶解氧反应生成过氧化物离子自由基(),过氧化物与鲁米诺反应,极大地提高金电极上鲁米诺电化学发光信号。当RhB-GA3被样品中GA3分子取代后,电化学发光强度减小。因此,可以根据该电化学发光信号的减弱,定量分析GA3的浓度。该传感器的检测浓度范围1×10-11~3×10-9mol/L,检出限为3.45×10-12mol/L。相对于GA3浓度1000倍的Na+、Ca2+、Mg2+、S、Cl-和C,500倍的葡萄糖、蔗糖、谷氨酸、Fe2+、Al3+和Zn2+,300倍的Cu2+和Hg2+都未能影响GA3产生的ECL信号。检测啤酒样品时,实验回收率达到96.0% ~103.2%。该传感器具有灵敏度高、选择性好和响应快等优点。
除以上方法外,Li等[21]应用纳米颗粒表面印迹结合电化学发光方法选择性识别磺酰脲类除草剂甲基噻吩磺隆(TFM)。作者在功能化后的SiO2纳米颗粒表面进行TFM分子印迹,后用沉积法在玻碳电极表面修饰上印迹的核壳SiO2纳米球。在印迹膜表面,作者用HF将SiO2球刻蚀得到多孔结构印迹膜。目标分子TFM在印迹膜上结合时能够观察到鲁米诺的电化学发光现象,且相比于空白,结合上目标分子的ECL强度增强了2.7倍。这是由于TFM在碱性条件下分解产生CO2,CO2能够与溶液中溶解氧还原生成的OOH-反应生成能够分解成不同的过氧化物自由基,如这些强氧化性的自由基加速了鲁米诺的氧化反应,从而增强了鲁米诺的发光强度。因此,可以应用该现象来构建对TFM有特异识别的传感器。多孔印迹膜的应用增加了膜上电子的传输,且目标分子TFM在反应中增强了鲁米诺的发光效应,因此该传感器不仅印迹效率得到了提高,灵敏度也相应增强。它的检测范围为5.0×10-10~1.0×10-7mol/L,检出限为0.32 nmol/L。其具有经济、高灵敏度、快速、特异性识别及稳定性良好等优点,在检测磺酰脲类除草剂的应用上具有潜在的应用价值。
2.3 毒品的检测
ECL曾被用于毒品检测,能检测到nmol浓度水平,但在原位气体检测领域该灵敏度仍是不够。为了提高检测的灵敏度和选择性,文献[23,24]应用ECL固态电极结合溶胶凝胶分子印迹法构建检测毒品的分子印迹电化学发光传感器。该类传感器制备过程可分为两步:一是先将电化学发光物质用Nafion和多壁碳纳米管复合材料固定在玻碳电极上,形成第一层膜;二是在已修饰上发光物质膜的表面再修饰一层分子印迹溶胶凝胶聚合物薄膜。如Han等[23]应用该法制备了用于检测甲基苯丙胺的MIP-ECL传感器,在1.0×10-10~1.0×10-14mol/L浓度范围内线性良好,检出限为4.0× 10-15mol/L。该传感器极高的灵敏度使其能在封闭的容器中通过气体来检测到毒品。为了验证该传感器的选择性,他们将TPA、L-色氨酸、L-络氨酸、甘氨酸、L-苏氨酸、海洛因以及吗啡等加入样品溶液中,进行干扰实验,发现即使这些干扰物的浓度比目标分子的浓度(0.10 nnol/L)高100倍,仍没有ECL信号干扰,该传感器具有良好的选择性。
3 分子印迹固相萃取-电化学发光分析
除了在电极上直接或者间接修饰MIP用于ECL检测,还可将MIP作为固相萃取吸附剂进行预处理样品,用于ECL检测双酚 A[26]、莱克多巴胺[35]、酚酞[36]、氯霉素[37]、食物残留有机物[38]和氨基酸[39]等。MIP作为萃取的吸附剂,不仅融合了MIP的专一识别性能,还填补了传统固相萃取剂对复杂样品难分离的缺点。
Wang等[35]基于莱克多巴胺(RAC)对Ru(bpy)2+3-DBAE体系ECL信号的猝灭作用,以RAC作为模板,聚乙二醇为致孔剂,环氧树脂为功能单体,在铁芯搅拌子表面印迹。当洗脱掉致孔剂与模板后得到识别RAC的MIP搅拌子。一定转速下该搅拌子在样品溶液中吸附萃取目标分子,后经解吸附处理得到纯化的目标分子溶液用于ECL检测。由于RAC对-二丁基乙醇胺(DBAE)体系ECL的猝灭作用,RAC浓度在1.0×10-10~5.0×10-8mol/L范围与ECL强度呈现良好的线性关系,检出限为3.5× 10-12mol/L。他们将搅拌子吸附萃取法与MIP及ECL相结合,能选择性快速识别分析物,富集能力强,灵敏度高,抗干扰能力好。该方法达到良好的检测目的,也拓宽了分子印迹技术与ECL方法在食品安全分析领域的应用。
Guo等[38]基于孔雀绿对luminol体系的ECL具有抑制效应,以孔雀绿为模板,选用甲基丙烯酸作为功能单体,二甲基丙烯酸二乙醇酯作为交联剂,偶氮二异丁腈作为引发剂制备分子印迹聚合物。经过研碎,过筛,得到粒径大小为32~96 μm的MIP颗粒,以其为萃取材料,自制固相萃取小柱。通过自制萃取小柱对样品纯化富集分析物,对MIP上吸附的目标分子进行解吸附处理后用于ECL检测。因孔雀绿对Luminol的ECL具有抑制作用,因此可以根据ECL强度对分析物进行定量分析。该分子印迹固相萃取小柱的干扰实验表明,该方法具有较强的抗干扰能力。ECL检测结果表明,该方法的灵敏度较高,检出限为6×10-12mol/L。作者应用经典整体柱法制备印迹聚合物,用于自制固相萃取小柱,成本相对较低,萃取效率高;结合ECL检测分析物,提高了检测的灵敏度,且相对于色谱分析技术,降低了仪器成本。
4 用于构建MIP-ECL传感器的电化学发光体系
4.1 鲁米诺-H2O2体系
鲁米诺(Luminol)电化学发光通常在碱性溶液中,在过氧化氢存在的情况下,以电化学氧化的方式发生。但现已有研究表明,鲁米诺可以在多种实验条件下产生电化学发光,如不同的溶剂、氧气或者过氧化氢存在或不存在的情况,不同的电极和有Br-和Cl-等其它物质共存的情况。在已构建的MIP-ECL传感器中,主要应用到的发光体系有:(1)在Luminol-H2O2系统中通过目标分子上修饰酶[19,22,28]催化底物产生H2O2,H2O2与Luminol反应增强ECL信号;(2)Luminol发光系统中,通过目标分子对Luminol的直接作用,增强[21]或者抑制[38]luminol发光;(3)在Luminol-H2O2系统中,目标分子在MIP孔洞上的结合与否,增加或减少电子传递,从而实现目标分子的定量检测[20]。
4.2体系
5 展 望
分子印迹电化学发光分析近年来得到较快发展,但是与其它分子印迹分析相比,分子印迹电化学发光是一个新兴的研究方向,研究报道还相对较少,还需要在以下方面开展深入研究:(1)目前电化学发光分析中,使用的电位相对较高,会影响分子印迹材料的稳定性,需要发展更加稳定的分子印迹材料或研发低电位下发光的体系;(2)发展透光性好的分子印迹材料和新型信号放大技术,以提高检测灵敏度;(3)发展在水溶液中具有良好识别能力的分子印迹材料;(4)针对有些常用电化学发光体系在碱性条件下发光强度好的特点,发展在碱性条件下具有良好识别能力和稳定性的分子印迹材料;(5)引进新的电化学发光体系和分子印迹方法,拓宽分子印迹电化学发光分析应用范围;(6)研制便携的电化学发光检测装置等。分子印迹和电化学发光具有广泛的应用范围[41,42]、良好的发展和应用前景。
1 XU Guo-Bao,DONG Shao-Jun.Chinese J.Anal.Chem.,2001,29(1):103-108
徐国宝,董绍俊.分析化学,2001,29(1):103-108
2 Hu L Z,Xu G B.Chem.Soc.Rev.,2010,39(8):3275-3304
3 Yin X B,Dong S J,Wang E.TrAC,Trends Anal.Chem.,2004,23(6):432-441
4 Wei H,Wang E.TrAC Trends Anal.Chem.,2008,27(5):447-450
5 Kong D X,Lin B,Han Y,Zheng X,Zhou X,Li Q,Chi Y,Chen G N.Electrochim.Acta,2014,123:111-116
6 Polyakov M V.Zh.Fiz.Khim.,1931,2:799-805
7 Li W,Li S J.Adv.Polym.Sci.,2007,206:191-210
8 Bossi A,Bonini F,Turner A P,Piletsky S A.Biosens.Bioelectron.,2007,22(6):1131-1137
9 Mosbach K,Ramstrom O.Nat.Biotechnol.,1996,14(2):163-170
10 Andersson L I.J.Chromatogr.B,2000,745(1):3-13
11 Guan G J,Liu B H,Wang Z Y,Zhang Z P.Sensors,2008,8(12):8291-8320
12 Suriyanarayanan S,Cywinski P J,Moro A J,Mohr G J,Kutner W.Top.Curr.Chem.,2012,325:165-265
13 Gurler B,Ozkorucuklu S P,Kir E.J.Pharm.Biomed.Anal.,2013,84:263-268
14 Sergeyeva T A,Piletsky S A,Brovko A A,Slinchenko E A,Sergeeva L M,El'skaya A V.Anal.Chim.Acta,1999,392 (2-3):105-111
15 Li H D,Guan H M,Dai H,Tong Y J,Zhao X N,Qi W J,Majeed Saadat,X G B.Talanta,2012,99:811-815
16 Chianella I,Piletsky S A,Tothill I E,Chen B,Turner A P F.Biosens.Bioelectron.,2003,18(2-3):119-127
17 Peng Y,Xie Y,Luo J,Nie L,Chen Y,Chen L,Du S,Zhang Z P.Anal.Chim.Acta,2010,674(2):190-200
18 Cheong W J,Yang S H,Ali F.J.Sep.Sci.,2013,36(3):609-628
19 Li S,Tao H,Li J P.Electroanalysis,2012,24(7):1664-1670
20 Li X,Li J,Yin W,Zhang L.J.Solid State Electrochem.,2014,18(7):1815-1822
21 Li H F,Xie C G,Fu X C.Sens.Actuators,B,2013,181:858-866
22 Li J P,Li S H,Wei X P,Tao H L,Pan H C.Anal.Chem.,2012,84(22):9951-9955
23 Han C F,Shang Z Y,Zhang H H,Song Q J.Anal.Methods,2013,5(21):6064-6070
24 SHANG Zhe-Yi,HAN Chao-Feng,SONG Qi-Jun.Chinese J.Anal.Chem.,2014,42(6):904-908
商哲一,韩超峰,宋启军.分析化学,2014,42(6):904-908
25 Wu B,Wang Z,Xue Z,Zhou X,Du J,Liu X,Lu X.Analyst,2012,137(16):3644-3652
26 Jiang X H,Ding W J,Luan C L.Can.J.Chem.,2013,91(8):656-661
27 DING Zhao-Yun,LI Chun-Yang,SONG Qi-Jun.Chinese J.Anal.Chem.,2013,41(10):1543-1548
丁照云,李春阳,宋启军.分析化学,2013,41(10):1543-1548
28 Zhou J,Gan N,Hu F,Li T,Zhou H,Li X,Zheng L.Sens.Actuators,B,2013,186:300-307
29 Zhou J,Gan N,Li T,Hu F,Li X,Wang L,Zheng L.Biosens.Bioelectron.,2014,54:199-206
30 Wu S,Tan W,Xu H.Analyst,2010,135(10):2523-2527
31 Whitcombe M J,Chianella I,Larcombe L,Piletsky S A,Noble J,Porter R,Horgan A.Chem.Soc.Rev.,2011,40(3): 1547-1571
32 Kan X,Zhao Q,Shao D,Geng Z,Wang Z,Zhu J J.J.Phys.Chem.B,2010,114(11):3999-4004
33 Kan X,Xing Z,Zhu A,Zhao Z,Xu G,Li C,Zhou H.Sens.Actuators,B,2012,168:395-401
34 Toshifumi T,Takayuki H.Org.Biomol.Chem.,2008,6(14):2459-2467
35 Wang S,Wei J,Hao T T,Guo Z Y.J.Electroanal.Chem.,2012,664:146-151
36 Guo Z,Hao T,Shi L,Gai P,Duan J,Wang S,Gan N.Food Chem.,2012,132(2):1092-1097
37 HAO Ting-Ting,XIE Wen-Ting,LI Qin-Fen,GUO Zhi-Yong.Chinese J.Anal.Lab.,2012,31(2):105-108
郝婷婷,谢文婷,李琴芬,郭志勇.分析试验室,2012,31(2):105-108
38 Guo Z,Gai P,Hao T,Wang S,Wei D,Gan N.J.Agric.Food.Chem.,2011,59(10):5257-5262
39 Lu J,Ge S,Wan F,Yu J.J.Sep.Sci.,2012,35,320-326
40 LI Hai-Juan,HAN Shuang,HU Lian-Zhe,XU Guo-Bao.Chinese J.Anal.Chem.,2009,37(11):1557-1565
李海娟,韩双,胡连哲,徐国宝.分析化学,2009,37(11):1557-1565
41 FU Cong,LI Jian-Ping.Chinese J.Anal.Chem.,2014,42(3):315-319
傅聪,李建平.分析化学,2014,42(3):315-319
42 SUN A-Long,ZHENG Xing-Wang.Chinese J.Anal.Chem.,2014,42(8):1220-1224
孙阿龙,郑行望.分析化学,2014,42(8):1220-1224
This work was supported by the National Natural Science Foundation of China(Nos.21274022,21175126)
Molecular Imprinting Electrochemiluminescence Analysis
LI Su-Ping1,GUAN Huai-Min2,3,XU Guo-Bao*1,4,TONG Yue-Jin*1
1(College of Chemistry and Chemical Engineering,Fujian Normal University,Fuzhou 350007,China)
2(College of Materials Science and Engineering,Fujian Normal University,Fuzhou 350007,China)
3(Fujian Key Laboratory of Polymer Materials,Fuzhou 350007,China)
4(State Key Laboratory of Electroanalytical Chemistry,Changchun Institute of Applied Chemistry, Chinese Academy of Sciences,Changchun 130022,China)
Molecularly imprinted electrochemiluminescence method combines the advantageous properties of molecularly imprinted polymer and electrochemiluminescence,such as high sensitivity,good selectivity,good controllability, easy miniaturization and simple operation. In recentyears, molecularly imprinted electrochemiluminescence has
much attention in the fields of biomimetic sensors,hazardous pesticide residue detection,and food safety monitoring,etc.In this review,the research progresses of molecularly imprinting electrochemiluminescence sensors and the applications of molecularly imprinted polymers as solid phase extraction matrices in electrochemiluminescence analysis have been summari
zed,and the future research trends have been proposed.
Molecular imprinting;Electrochemiluminescence;Review
14 August 2014;accepted 10 November 2014)
2014-08-14收稿;2014-11-10接受
本文系国家自然科学基金资助项目(Nos 21274022,21175126)
*E-mail:guobaoxu@ciac.ac.cn;tongyuejin@fjnu.edu.cn
10.11895/j.issn.0253-3820.140694
