一种重组融合抗菌肽ClavE-HD5的原核表达
2015-07-02许琪瑶陈金军张学文
许琪瑶,李 骞,宋 南,陈金军,张学文
(湖南农业大学生物科学技术学院,湖南长沙 410128)
一种重组融合抗菌肽ClavE-HD5的原核表达
许琪瑶,李 骞,宋 南,陈金军,张学文
(湖南农业大学生物科学技术学院,湖南长沙 410128)
根据海鞘Clavanins抗菌肽(ClavE)氨基酸序列和人HD5氨基酸序列,设计了一个融合的新抗菌肽ClavEHD5,通过PCR方法以大肠杆菌偏好密码子合成该融合重组肽的编码DNA,将该DNA克隆到大肠杆菌表达载体pET30α中,构建了ClavE-HD5的融合表达质粒。测序结果表明,克隆分子序列正确,可以表达1个12 kDa的带标签融合蛋白。经转化大肠杆菌表达菌株E.coli Rosetta(DE3)后,以IPTG诱导并经Tricine-SDS-PAGE检测发现,凝胶中出现预期大小的多肽带,表明成功表达出重组的ClavE-HD5的融合抗菌肽。
ClavE;HD5;原核表达
防御素是一类分子量约为4.0~5.0 kDa、由29~35个氨基酸组成的阳离子小肽,含有6个保守的半胱氨酸组成的3个分子内二硫键,可以使小分子防御素以紧密结构抵抗蛋白酶的分解,进而能在吞噬溶酶体中保持活性,是抗菌肽家族中最大的亚家族,是由生物体内产生的构成生物体先天免疫系统的一类防御性多肽,与干扰素、补体等组成了宿主的免疫防御系统[1-2]。防御素因具有高效杀菌、无毒、适用性广、性能稳定等优点,逐渐成为抗菌应用的重要物质[3-4]。
1997年,Lee等[5]在无脊椎动物姬氏海鞘中发现Clavanins家族抗菌肽,Clavanins抗菌肽均由23个氨基酸组成,由于其C末端酰胺化,富含组氨酸,无半胱氨酸,因此在不同pH值环境下表现出不同的抗菌机制。Clavanins-E(ClavE)具有的这种广谱pH值抗菌能力可能远优于人类一般抗菌肽。
HD5是由小肠潘氏细胞、泌尿生殖道粘膜等上皮细胞表达的一种生物活性肽[6],是抗菌活性最强的人α-防御素,能够抑/杀多种细菌,如大肠杆菌、金黄色葡萄球菌、白色念珠菌等,也被发现能作用于原生动物[7]。有研究表明HD5有抗病毒的特性[8],其抗菌谱广、不易产生耐药性、不影响肠道微生态平衡,可作为肠源性与生殖道的细菌感染和病毒性性病防治的候选新型药物分子,具有良好的开发前景[9]。
人防御素的医学价值和生理生化特性一直是研究者们所关注的焦点,它们参与机体防御活动并与许多疾病的发生、发展及治疗相关。由于抗生素的广泛使用,传统抗生素在治疗疾病的同时也产生了大量耐药微生物,给医治带来困难。人防御素由于其稳定的分子结构以及小分子量等优点,为研制新型药物制剂提供了优良的分子设计模板和骨架。由于人防御素独特的作用机理,能避免微生物对其产生耐药性[10-11]。
基因组学与生物信息学的发展为人防御素的研究注入了新的活力[10]。目前已实现了范式转换(paradigm shift)。而HD5所含的疏水残基是影响其活性的重要因素,主要是通过聚集病毒成团来阻止病毒脱壳,抑制其DNA进入宿主细胞,可阻断HIV对T细胞的感染[8,12-13]。HD5的特异性识别由可调控辅助受体的表达和特定的表面暴露的带电残基决定[8,14]。人α-防御素依赖于疏水性和电荷-电荷相互作用,疏水性残基在保持防御素的三级和四级结构以及形成用于病毒结合的界面发挥多重作用[14-15]。
大肠杆菌表达系统具有操作方便快捷、表达量大、成本低和适合工业化生产等优点。国内外已有大量关于防御素在大肠杆菌中成功表达的报道[16]。为了扩大HD5耐受pH值范围,利用海鞘抗菌肽和人抗菌肽进行重组,形成重组多肽,就有可能结合两者的优点,获得更有应用价值的新型抗菌肽。
作者根据海鞘抗菌肽ClavE和人HD5的氨基酸序列,以大肠杆菌偏好密码子,设计了2种融合蛋白的编码DNA序列,采用PCR方法合成了该DNA片段,并且构建了大肠杆菌蛋白表达的重组质粒,转化Rosetta(DE3)后诱导表达融合蛋白,以实现2个防御素分子在同一载体中的诱导表达,拟为防御素融合蛋白的研究奠定基础。
1 实验
1.1 载体、菌株与试剂
原核表达载体pET30α、宿主菌株E.coli DH5α、E.coli Rosetta(DE3),自行保存;Pfu DNA Polymerase,Thermo公司;Taq DNA Polymerase,北京鼎国昌盛生物技术有限公司;Trans2K Plus DNA Marker,北京全式金生物技术有限公司;BamHⅠ、HindⅢ、20 bp DNA Ladder,宝生物工程有限公司;琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒等,北京天根生物科技有限公司;其余试剂为国产分析纯。
1.2 目的基因合成与扩增引物设计
以NCBI上已发表的氨基酸序列为参照,拟编码氨基酸为 VFRYLGKIIHHVGNFVHGFSHVFCYCRTGRCATRESLSGVCEISGRLYRLCCR*,相对分子质量6.109 kDa。对照氨基酸密码子表,采用DNAMAN软件设计基因序列,并且根据引物设计原则设计搭桥PCR扩增引物。
1.3 引物设计与合成
根据GenBank上发表的ClavE氨基酸序列(序列号:O18492.1)和HD5氨基酸序列(序列号:1ZMP_A)设计如下引物:

以上引物均由上海生工生物有限公司合成。
1.4 ClavE和HD5基因的搭桥PCR扩增
1.4.1 ClavE基因的搭桥PCR扩增
以clavE-F、clavE-R互为引物进行PCR扩增。反应条件为:95℃预变性1min;94℃ 变性30 s,68℃退火30 s;68℃ 延伸30 s,循环25次;68℃终末延伸5 min。取PCR产物15μL进行3%琼脂糖凝胶电泳。
1.4.2 HD5基因的搭桥PCR扩增
第一轮以HD5-F1、HD5-R1互为引物进行PCR扩增。反应条件为:95℃预变性1 min;94℃ 变性30 s,68℃ 退火30 s;68℃ 延伸30 s,循环25次;68℃终末延伸5 min。以第一轮PCR产物为模板进行第二轮PCR扩增,以HD5-F2和HD5-R2互为引物。反应条件为:95℃预变性1 min;94℃ 变性40 s,52℃ 退火40 s;72℃ 延伸40 s,循环35次;72℃终末延伸7 min。取PCR产物15μL进行3%琼脂糖凝胶电泳。
1.4.3 ClavE-HD5基因的搭桥PCR扩增
以clavE-F'、clavE-R'和HD5-F2、HD5-R2互为引物,分别扩增ClavE和 HD5基因。然后以clavE-F'与clavE-HD5-F1互为引物扩增ClavE基因;以clavE-R'与clavE-HD5-R1互为引物扩增HD5基因,使ClavE和HD5扩增至带有双方的碱基互补区域,分别记为clavE-HD5-1、clavE-HD5-2。反应条件为:95℃预变性1 min;94℃ 变性30 s,68℃ 退火30 s;68℃ 延伸30 s,循环25次;68℃终末延伸5min。再以clavE-HD5-1和 clavE-HD5-2同时作为模板,以 clavE-HD5-F2、clavE-HD5-R2为引物使用降落PCR扩增串联基因ClavE-HD5。反应条件为:95℃预变性1 min;94℃ 变性30 s,68℃ 退火30 s;68℃ 延伸30 s,循环10次;再95℃预变性1 min;94℃ 变性40 s,52℃ 退火40 s;72℃ 延伸40 s,循环35次;72℃终末延伸7 min。取PCR产物15μL进行3%琼脂糖凝胶电泳。
1.5 目的基因的纯化与克隆
PCR产物用琼脂糖凝胶DNA回收试剂盒回收。用限制性内切酶BamHⅠ和HindⅢ分别酶切PCR产物和表达载体pET30α,回收目的基因片段及载体片段。以T4连接酶16℃过夜连接,转化E.coli DH5α感受态细胞,取100μL菌液,涂布于含卡那霉素的LB平板上,37℃培养16 h,小量提取质粒。对重组质粒进行PCR鉴定。
1.6 目的基因的测序
将经过鉴定正确的重组克隆质粒pET30α-ClavEHD5送至铂尚生物技术有限公司进行序列测定。应用Jellyfish软件对测序结果进行分析,和原设计序列及氨基酸序列进行比较。
1.7 重组菌制备和诱导表达
使用测序结果正确的阳性质粒 pET30α-ClavEHD5转化E.coli Rosetta(DE3)感受态细胞,涂抹于含50μg·mL-1卡那霉素抗性的LB平板上,得到含阳性质粒pET30α-ClavE-HD5的重组单菌落。挑取单个阳性菌落于含抗性的LB培养基中,37℃培养12 h。以1∶50的比例转接于含卡那霉素抗性的LB培养基中,37℃、150 r·min-1摇瓶培养至OD600≈0.6时,加入终浓度为1mmol·L-1的IPTG,28℃诱导1 h后每小时取样一次制备蛋白电泳样品。同时设置空载体未诱导和诱导对照。对制备样品进行Tricine-SDS-PAGE检测,分析表达结果。
2 结果与讨论
2.1 目的基因的克隆及鉴定
将ClavE、HD5、ClavE-HD5搭桥PCR扩增产物进行3%琼脂糖凝胶电泳,对重组质粒进行PCR检测,经1%琼脂糖凝胶电泳,结果见图1。
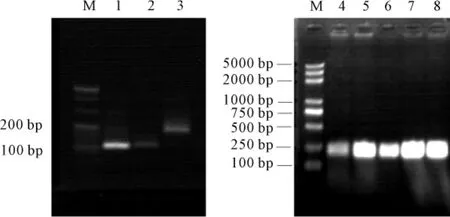
图1 PCR产物的电泳图谱Fig.1 Electrophoretic profile of PCR product
由图1可知:ClavE基因为69 bp,HD5基因为90 bp,ClavE-HD5为159 bp,基因扩增片段大小和预期相符;筛选的5个pET3α-ClavE-HD5重组质粒的电泳条带与预期相符。
重组质粒的测序结果表明,扩增出的ClavE-HD5片段全长159 bp,编码53个氨基酸,且含有终止密码子,氨基酸序列与拟编码氨基酸完全一致,表明已成功构建克隆载体。ClavE-HD5基因序列及推测的蛋白质序列如图2所示。

图2 ClavE-HD5的基因序列及推测的蛋白质序列Fig.2 The gene sequence and its putative protein sequence of C lavE-HD5
2.2 ClavE-HD5原核诱导表达及分析
将重组表达菌Rosetta-pET30α-ClavE-HD5诱导表达所取样品进行Tricine-SDS-PAGE电泳检测,结果见图3。
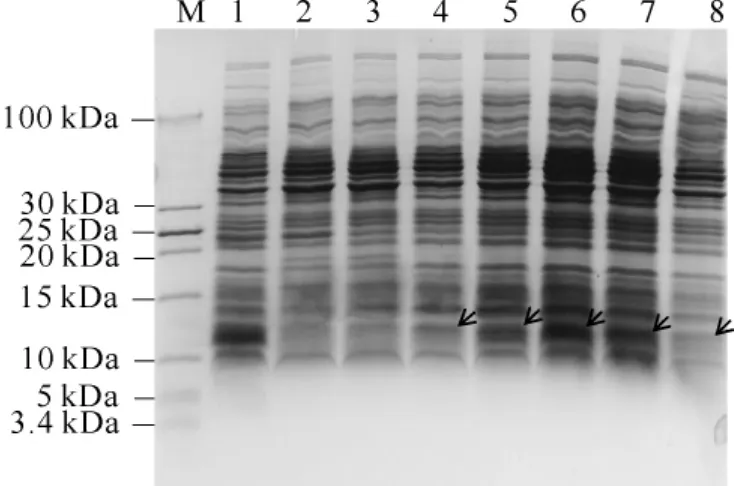
图3 pET30α-C lavE-HD5原核诱导表达的Tricine-SDS-PAGE分析Fig.3 Tricine-SDS-PAGE Analysis of the p rokaryotic inducible expression of pET30α-ClavE-HD5
由图3可知,空载体对照重组菌样品在约10 kDa处出现一条特异性蛋白条带。重组表达菌样品在约12 kDa处出现一条特异性蛋白条带,和预测相对分子质量一致。说明空载体质粒可表达8.2 kDa的标签,重组质粒pET30α-ClavE-HD5可特异表达12 kDa的带标签融合蛋白,目的蛋白分子质量为6.1 kDa。
3 结论
根据海鞘Clavanins抗菌肽(ClavE)氨基酸序列和人HD5氨基酸序列,设计了一个融合的新抗菌肽ClavE-HD5,通过PCR方法以大肠杆菌偏好密码子合成该融合重组肽的编码DNA,将该DNA克隆到大肠杆菌表达载体pET30α中,构建了ClavE-HD5的融合表达质粒。测序结果表明,克隆分子序列正确,可以表达1个12 kDa的带标签融合蛋白。经转化大肠杆菌表达菌株 Rosetta(DE3)后,以 IPTG诱导并经 SDSPAGE检测发现,凝胶中出现预期大小的多肽带,表明成功表达出重组的ClavE-HD5的融合抗菌肽。
[1] 魏艳彬,王洪法.抗菌肽的研究进展[J].中国现代医生,2009,47 (15):76-78.
[2] 汪芳.重组人防御素的构建与制备及其应用研究[D].广州:华南理工大学,2011.
[3] YOUNT N Y,WANG M S,YUAN J,et al.Rat neutrophil defensins. Precursor structures and expression during neutrophilic myelopoiesis[J].The Journal of Immunology,1995,155(9):4476-4484.
[4] TRAN D,TRAN P A,TANG Y Q,et al.Homodimeric theta-defensins from rhesusmacaque leukocytes:Isolation,synthesis,antimicrobial activities,and bacterial binding properties of the cyclic peptides[J].J Biol Chem,2002,277(5):3079-3084.
[5] LEE IH,ZHAO C Q,CHO Y,et al.Clavanins,alpha-helical antimicrobial peptides from tunicate hemocytes[J].FEBSLetters,1997,400 (2):158-162.
[6] CHAPNIK N,LEVIT A,NIV M Y,et al.Expression and structure/ function relationships of human defensin 5[J].Appl Biochem Biotechnol,2012,166(7):1703-1710.
[7] QUAYLE A J,PORTER E M,NUSSBAUM A A,et al.Gene expression,immunolocalization,and secretion of human defensin-5 in human female reproductive tract[J].American Journal of Pathology,1998,152(5):1247-1258.
[8] FURCIL,TOLAZZIM,SIRONIF,et al.Inhibition of HIV-1 infection by humanα-defensin-5,a natural antimicrobial peptide expressed in the genital and intestinal mucosae[J].PLoS One,2012,7(9): e45208.
[9] PORTER EM,van DAM E,VALORE E V,et al.Broad-spectrum antimicrobial activity of human intestinal defensin 5[J].Infection and Immunity,1997,65(6):2396-2401.
[10] 黄磊.重组大肠杆菌高效生产具生物活性的人β防御素和牛肠激酶的研究[D].杭州:浙江大学,2006.
[11] BUCK C B,DAY PM,THOMPSON C D,et al.Human alpha-defensins block papillomavirus infection[J].PNAS,2006,103(5): 1516-1521.
[12] ZINSSR,NELSON CD S,MAGINNISM S,et al.The human alpha defensin HD5 neutralizes JC polyomavirus infection by reducing endoplasmic reticulum traffic and stabilizing the viral capsid[J].Journal of Virology,2013,88(2):948-960.
[13] GOUNDER A P,WIENSM E,WILSON SS,et al.Critical determinants of humanα-defensin 5 activity against non-enveloped viruses[J].The Journal of Biological Chemistry,2012,287(29):24554-24562.
[14] TENGE V R,GOUNDER A P,WIENSM E,et al.Delineation of interfaces on human alpha-defensins critical for human adenovirus and human papillomavirus inhibition[J].PLoSPathogens,2014,10(9): e1004360.
[15] WOMMACK A J,ROBSON SA,WANNIARCHCHIY A,etal.NMR Solution structure and condition-dependent oligomerization of the antimicrobial peptide human defensin 5[J].Biochemistry,2012,51 (48):9624-9637.
[16] 唐勇.抗菌肽基因表达系统研究进展[J].饲料工业,2009,30 (7):13-16.
Prokaryotic Expression of A Recombinant Fusion Antim icrobial Peptide ClavE-HD5
XU Qi-yao,LIQian,SONG Nan,CHEN Jin-jun,ZHANG Xue-wen
(College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,China)
A novel recombinant fusion antimicrobial peptide ClavE-HD5 was designed according to ascidian clavanins antimicrobial peptide(ClavE)sequence and human HD5 amino acid sequence.The encoding DNA of the recombinant fusion peptide was synthesized via PCR with E.coli preference codons.The ClavE-HD5 fusion expression plasmid was constructed after the DNA sequence was cloned into expression vector pET30α.The sequencing results verified that the cloned moleculewas correctand capable of expressing a 12 kDa tag fusion protein.The peptide band of expectedmolecular weightwas observed by IPTG induction and Tricine-SDS-PAGE after the vector transformed into E.coli Rosetta (DE3),which indicated that the recombinant fusion antimicrobial peptide ClavE-HD5 was successfully expressed.
ClavE;HD5;prokaryotic expression
Q 786
A
1672-5425(2015)02-0048-05
10.3969/j.issn.1672-5425.2015.02.012
2014-10-24
许琪瑶(1990-),女,广东揭阳人,硕士研究生,研究方向:细胞分子生物学,E-mail:xqyfly@163.com;通讯作者:张学文,教授,E-mail:xuewen_zhang@126.com。
