中药艾总DNA的提取及ISSR-PCR反应体系的优化
2015-07-01王惠君王文泉王海燕
王惠君,王文泉,卢 诚,王海燕,陈 新
(1.琼州学院,海南 三亚572022;2.中国热带农业科学院 热带生物技术研究所,海南 海口571101)
中药艾叶[1]为菊科植物艾(ArtemisiaargyiLevl et Vant)的干燥叶片。艾叶又称作蕲艾、艾蒿、医草、灸草等。其功效早在战国的医书《黄帝内经》中有记载。2000多年前,艾叶作为正式药物记载在陶弘景的《名医别录》中,从此艾叶在中医临床上得到广泛应用。艾叶的入药成分主要是春、夏的叶片,叶片最好在花未开放、叶片较茂盛时采摘并阴干或晒干较好。中医在长期临床实践中总结艾叶性温、辛、味苦,具有固脱回阳、温补益、散结消瘀、行气活血、驱逐寒湿、温经通络、安胎和止血等功效。艾资源在全球分布较广泛,采收方便,因而艾具有较高的开发和利用价值。但艾在各地的质量性状参差不齐,目前仍未满足大规模的开发和利用,因此对于发掘优良艾的种质资源用于大规模人工种植栽培品种尤为迫切。从艾的研究进展看,虽在艾叶的有效成分提取分 离[2-5]、鉴定分析技术[6]和药理性研究[7-8]方面均取得一定成果,但对于艾资源的各地品种质量性状的多样性研究仍是空白。
运用现代分子标记技术分析种质材料的亲缘关系和遗传多样性可提高艾育种效率。常见的分子标记技术有SSR、RFLP、RAPD、ISSR、AFLP、SRAP、SNP等,通常用于品种鉴定、植物遗传多样性、遗传作图等方面的研究。其中,ISSR(inter-simple sequence repeat)又称为简单重复序列区间,是由加拿大Zietkiewicz 等[9]提出,通过利用锚定的SSRDNA 作为引物进行PCR 反应扩增,进而检测相邻SSR 之间基因组DNA 序列的差异。与其他分子标记技术相比,ISSR 分子标记不仅信息量大、精确度高,而且多态性高、稳定性好、操作简单、便于检测,尤其可在不同的物种间通用,该技术已广泛应用在农作物、花卉、树木、中药材等方面,迄今未见任何分子生物学技术用于艾种质资源研究的报道。由于ISSR 分子标记技术是在PCR 扩增反应基础上开发,因而其反应条件也易受众多因素的干扰,如引物、模板DNA、Mg2+、dNTPs、Taq酶等浓度均直接影响ISSR-PCR 扩增。因此,为确保ISSR-PCR 扩增结果的稳定和准确,需对此扩增反应体系进行优化。笔者在提取艾基因组DNA 以及单因素试验的基础上进行L16(45)正交试验,用以优化艾叶反应体系,旨在为艾叶药材分子鉴定、遗传多样性研究以及优良品种选育奠定基础。
1 材料与方法
1.1 中药艾、试剂与仪器
1.1.1 艾 采自湖北蕲春艾的叶片,采摘后迅速装入自封袋中置于冰盒,于实验室-70℃超低温冰箱中保存备用。
1.1.2 试剂 CTAB(十六烷基三甲基溴化胺)、EDTA(乙二胺四乙酸)、EB(溴化乙锭)、PVP(聚乙烯吡咯烷酮)、Tris(三羟甲基氨基甲烷)、Buffer缓冲液、MgCl2、DL2000(DNA 分 子 标 记)、dNTPs、Taq酶(大连宝生物公司)、ISSR 随机引物(参照哥伦比亚大学UBC公布的第9套ISSR 引物序列、其序列由上海生物工程有限公司合成)、DNA 提取试剂盒(天根生化科技有限公司)。
1.1.3 仪器 恒温水浴锅、GILSON 移液枪、超净工作台、电子天平、高速冷冻离心机、PCR 扩增仪(Bio-Rad,T1000)、梯 度PCR 仪(Eppendorf)、Gel Doc EQ 凝胶成像系统(Bio-Rad,Chemi Doc XRS)、电泳仪和电泳槽(北京六一厂DYY-10C)、紫外分光光度计(ES-2)。
1.2 艾基因组DNA的提取与检测
艾基因组DNA 的提取分别采用3种方法。即改良CTAB方法[10]、SDS法[11]和试剂盒法。
为保证基因组DNA 提取质量,用试剂盒提取的艾基因组DNA 作对比。将提取的基因组DNA用1%琼脂糖凝胶(加入EB 浓度为0.5μg/mL)电泳及核酸检测仪检测其纯度和浓度,并将提取得到的DNA 样品稀释至约50ng,-20℃保存备用。
1.3 PCR反应体系单因素最优设计
选用纯度高的DNA 模板同时参考Zietkiewicz E[9]和刘本英[12]的反应条件进行引物初筛,初设定ISSR-PCR 反 应 体 系 确 定 为 (20μL):模 板DNA 25ng,Mg2+2.5mmol/L,dNTPs 0.25mmol/L,引物0.6μmol/L,10×PCR Buffer缓冲液2.0μL,Taq DNA 聚合酶1.75U。
反应的程序预设定:94℃预变性5min,94℃变性45s,50℃退火45s,72℃延伸1.5min,35个循环,72℃最后延伸8 min,产物在4℃保存。首选重复性好、扩增谱带清晰的引物用于后续优化试验。依据表1中各个因素水平分别探究各因素对ISSR扩增反应体系的影响,最后获得单因素最优处理。
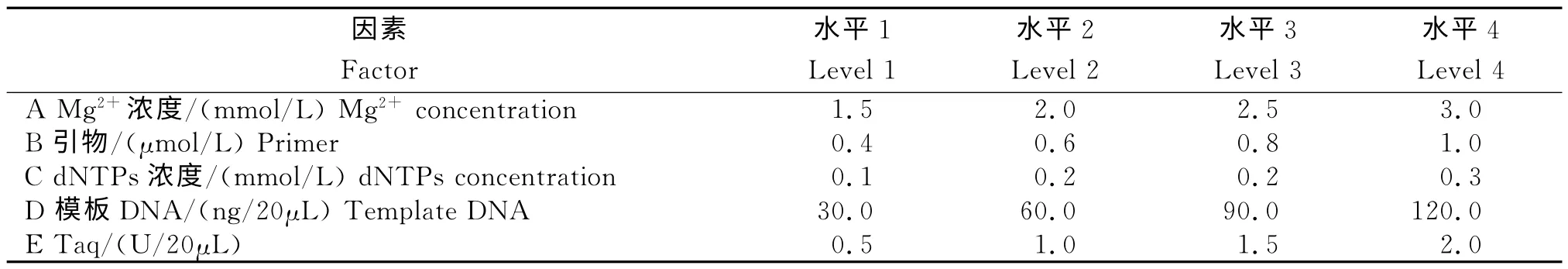
表1 PCR 反应体系各因素试验水平设计Table 1 Factors and levels of PCR reaction
1.4 PCR反应体系正交试验的最优设计
选用正交设计L16(45)分别在4个不同水平上试验(表2)。在PCR 仪上进行扩增反应,扩增产物选用1.6%琼脂糖凝胶电泳。电泳结束后将胶体放入凝胶成像系统中观察并拍照保存。试验结果参照何正文等[13]的方法分析,对ISSR-PCR 扩增结果依据谱带的强弱和多少进行直观分析评分,分值为1~16。即将16个处理中谱带数量最多且清晰度最高,同时背景最干净的记为最高分值16,与此相反,最差的记最低分值1,最后获得艾ISSR-PCR 扩增反应各因素的最优处理。参照穆立蔷等[14]方法,根据分值求出各因素在同一水平上的试验值之和Ki以及各因素水平上的数据平均值ki,并求出同一因素在不同水平之间平均值的方差SS和极差R。将单因素试验结果与正交试验结果进行综合分析,最后获得艾ISSR-PCR 扩增的优化反应体系。

表2 PCR 反应的因素水平L16(45)正交试验设计Table 2 L16(45)orthogonal design for the factors and levels of PCR reaction
1.5 退火温度的确定
依据试验结果,将优化的反应体系在梯度PCR模式下设定退火温度为48~54℃,依据产物结果数据确定最优的退火温度。
2 结果与分析
2.1 艾基因组DNA的提取

图1 3种方法提取基因组DNA的电泳图片Fig.1 Agarose gel electrophoresis of genomic DNA by three methods
由图1可见,试剂盒提取的艾基因组DNA,电泳谱带明亮清晰,上样孔干净,无拖尾现象,亦无蛋白质和RNA 杂质的谱带,经过紫外分光光度计测定OD260和OD280,其OD260/OD280值为1.82,浓度为50~70ng/μL,试剂盒提取的DNA 纯度和质量均较高;用改良CTAB 法所提取的DNA 样品清晰明亮,亦无杂质谱带,OD260/OD280值为1.85,浓度为20~50ng/μL,质量相对较高,可满足试验的质量要求;用SDS法提取的DNA 样品明亮,但存在明显拖尾,OD260/OD280值为1.92,表明样品有RNA 污染。从经济方面考虑,选用改良CTAB 法提取艾基因组DNA。
2.2 ISSR-PCR扩增的反应条件优选
从图2看出,不同因素影响下ISSR-PCR 扩增反应体系的变化情况。结果表明:
1)Mg2+浓度。当Mg2+浓度为1.5 mmol/L时,ISSR 扩增出的谱带比较弱;而浓度为2.0~2.5mmol/L时,均能扩增出比较清晰的谱带;当Mg2+浓度为3.0mmol/L时,扩增出的谱带特异性减弱。故宜选取2.0mmol/L 和2.5mmol/L 为Mg2+的最佳浓度。
2)引物浓度。随着体系中的引物浓度增加,扩增的谱带也逐渐增强。在浓度达1.0μmol/L 时,谱带的清晰度开始下降,故确定0.6~0.8μmol/L作为引物的最佳浓度。
3)dNTPs 浓度。泳道1、泳道2 可能由于dNTPs浓度比较低,扩增出的谱带条纹少。当浓度在0.20mmol/L以上时得到的谱带清晰稳定,故确定0.20mmol/L作为dNTPs的最佳浓度。
4)模板DNA。经电泳分离检测结果显示,各浓度存在差异,当模板DNA 的量小于30ng时,扩增的谱带较为模糊;当模板DNA 的量达到120ng时,扩增条带清晰明亮,开始出现拖尾现象;当模板DNA 的量为60~90ng 时,扩增谱带比较清晰明亮,谱带的数量和亮度的强弱基本一致。表明,艾ISSR 反应对模板DNA 的浓度要求为60~90ng。为节约模板DNA 故设定模板DNA 的浓度为60ng。
5)Taq酶的含量。4 个Taq酶用量处理均可得到谱带相同的扩增结果,当酶的用量为0.5U 和1.0 U 时扩增出的谱带稍弱;当Taq 酶用量为1.5~2.0U可获得良好的扩增结果。从降低试验成本且保证质量的角度考虑,试验选择Taq酶的用量为1.0U。

图2 不同因素条件下ISSR-PCR 反应体系的变化Fig.2 ISSR-PCR reaction system variation of different influencing factors
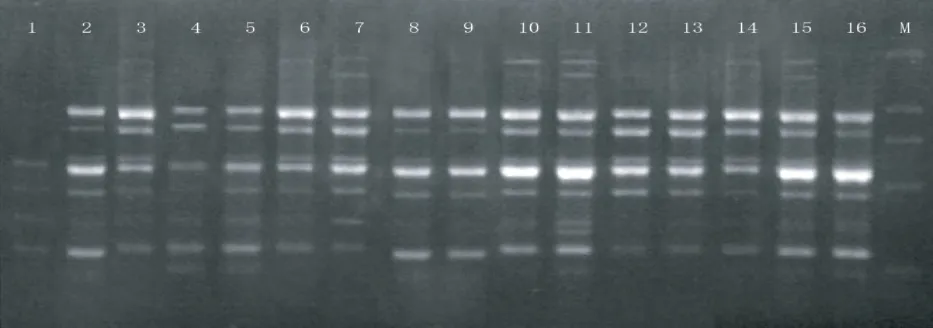
图3 ISSR-PCR的扩增图谱Fig.3 Result of orthogonal design PCR products
2.3 ISSR-PCR扩增的评分及最优选择
由图3可见,ISSR-PCR 的扩增条带的强弱,直观分析评分得到1~16条带的分值分别为1 分、7分、10分、5分、6分、11分、15分、5分、5分、14分、16分、10分、10分、11分、14分和6分。
由表3可知,对艾叶ISSR-PCR 反应影响最大的是Mg2+浓度,而Taq酶浓度的影响最小。此外,利用ki值还可估计各因素的最佳水平,当ki值越大,则该水平最佳。因此,其中各因素的最佳水平为Mg2+2.5mmol/L,引物0.8μmol/L,模板DNA 60 ng,Taq酶2.0 U。由于dNTPs的最大Ki值为2个,对 应 的 浓 度 分 别 为 0.15 mmol/L和0.25mmol/L,从成本考虑选择0.15 mmol/L,考虑Taq酶浓度对此反应的影响最小。这一组合在正交表中并未出现,但与分值最高的11号处理接近,仅是模板DNA 量不同。考虑到节约成本,Taq酶浓度应选1.0U。
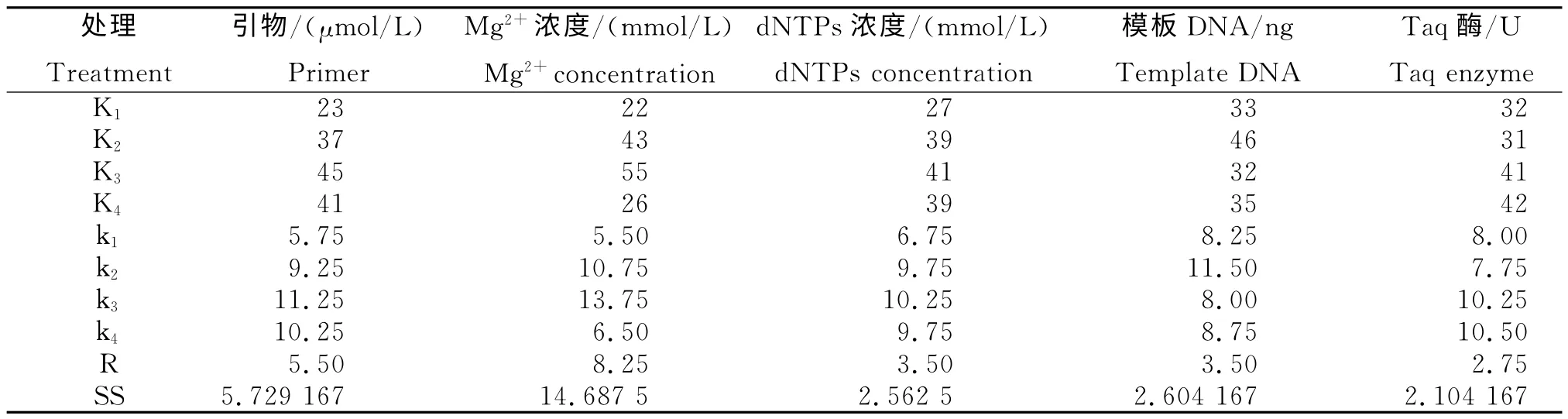
表3 ISSR-PCR 扩增的正交设计直观分析Table 3 Intuitive analysis of orthogonal design of ISSR-PCR amplification

图4 最佳体系的ISSR-PCR验证图谱Fig.4 The best system of ISSR-PCR
2.4 正交试验与单因素分析的比较及其验证
依据单因素分析最优体系(1)为模板DNA 60 ng,Mg2+2.0 mmol/L,引 物0.6 μmol/L,dNTP 0.2mmol/L,Taq酶1.0U。依据正交试验直观图得最优化体系及为处理11的体系(2)为模板DNA 30 ng,Mg2+2.5 mmol/L,引 物0.8 μmol/L,dNTPs 0.15mmol/L,Taq酶2.0U。依据正交分析结果 分 析 得 体 系 (3)为 模 板DNA 60 ng,Mg2+2.5mmol/L,引物0.8μmol/L,dNTPs 0.15mmol/L,Taq酶1.0U。
对以上3个体系验证结果(图4)表明,3个处理的谱带相差较小,1处理谱带清晰度相对弱,2处理与3处理几乎没有差别。从成本考虑,选择3处理为艾叶最佳的ISSR-PCR 反应体系。
2.5 PCR退火温度的选择

图5 引物UBC811退火温度不同的扩增图谱Fig.5 Results of annealing temperature on ISSR-PCR amplification of UBC811
由图5 显示,温度低时则特异性较差,泳道1~5,谱带相对较多同时缺失小片段;退火温度较高时引物与模板的结合性差,又造成大片段的缺失,泳道9~12,导致PCR 扩增产物谱带数减少2 条,同时亮度减弱。因此,UBC811的最佳退火温度范围介于第6与第8的温度之间,因而选定为54℃。
3 结论与讨论
影响艾ISSR-PCR 扩增反应效果的主要因素包括模板DNA、Mg2+、引物浓度、dNTPs、Taq酶及退火温度设定等。Mg2+浓度对ISSR-PCR 扩增反应起关键作用。其作为Taq 酶的辅助因子之一,Mg2+浓度不但对Taq酶的活性有影响,而且还可与反应液中的模板DNA、dNTPs及引物相结合,影响模板DNA 与引物的结合效率,影响模板DNA 与PCR 产物的解链温度,影响扩增产物的特异性,影响引物二聚体的形成。引物浓度对PCR 扩增产物的带型产生较为明显的影响,如浓度较高产生非特异条带,浓度较低将不能扩增。dNTPs 作为ISSR-PCR扩增反应的原料,其浓度较低将影响合成的效率,甚至因过早的被消耗而使产物单链化,直接影响扩增效果;其浓度较高又将导致PCR 错配率增加,从而使扩增反应出现较多的非特异性扩增。ISSR扩增反应体系中模板DNA 的纯度和含量对扩增产物的特异性及获得率有直接影响。若模板含量较低,分子之间碰撞的机率也较低,PCR 扩增产物也不稳定,甚者不能扩增出产物;若模板含量较高,相应增加非特异性产物的扩增。若模板DNA 的纯度不高,多糖或RNA 等其他杂质阻碍扩增反应,使扩增反应不稳定,增加非特异性产物的扩增。在ISSR-PCR 扩增反应中,Taq酶是PCR 扩增的重要影响因素之一。Taq酶用量过少将使酶过早地被消耗而降低产物合成反应效率;过多会产生较多的非特异性扩增谱带使试验结果失真,同时还增加试验成本。ISSR-PCR 扩增反应中,退火温度的高低也直接影响到模板DNA 与引物的特异性结合。一般情况下,较低的退火温度可保证模板与引物结合的稳定性,同时尽可能选择较高的退火温度,这样可减少模板DNA 与引物之间的非特异性结合;对于不同的引物和不同基因组DNA 退火最适温度也不同。用以上最优体系分别对不同引物进行梯度退火试验,在梯度PCR 仪上设置温度范围,将PCR 扩增产物分别进行电泳分离检测。综合以上2种方法结果,最终获得适合艾的ISSR-PCR 最优反应体系。
试验结果表明,在正交试验中发现Mg2+浓度对此反应体系的影响较大,这与王彦华[15]、刘晓静[16]和吴生[17]等研究结果相符。在单因素试验中除Taq酶和模板DNA 外,其余3 个因素对ISSRPCR 反应体系均有影响。2种方法得各因素的最佳优化体系也不尽相同。总之,5种主要因素对反应体系的影响既独立又互补。单因素试验可直观地显现出各主要因素对反应体系的相对影响,但不能显现各因素间的交互作用,利用正交设计可较快地获得最优体系,但对于结果的主观性较强,因而缺乏可靠性。在不同的试验条件下,如不同的试验仪器、试验试剂、试验材料以及操作人员与实验室环境条件等,均对扩增结果产生影响[18],当建立和优化PCR反应体系时建议综合采用上述2种方法。试验结果还显示,对艾ISSR-PCR 的影响依次为Mg2+浓度>引物>模板DNA>dNTPs浓度>Taq酶,即艾的ISSR-PCR 分析的最佳扩增体系条件为模板DNA 60ng,Mg2+2.5mmol/L,引物0.8μmol/L,dNTPs 0.15mmol/L,Taq酶1.0U。经反复试验,在此优化条件下扩增反应结果稳定性强且重复性好。该反应体系为ISSR 标记技术开展艾的遗传图谱构建及其遗传多样性分析奠定基础。
[1]梅全喜.艾叶的研究与应用[M].北京:中国医药科技出版社,2013.10.
[2]川吉双,张予川,刁云鹏,等.艾叶的化学成分[J].沈阳药科大学学报,2009,26(8):617-619.
[3]唐生安,孙 亮,翟慧媛,等.艾叶化学成分的研究[J].天津医科大学学报,2011,17(4):461-463.
[4]孙 锋,张宽朝.野生艾草黄酮的含量及抗氧化性研究[J].中国野生植物资源,2009,28(3):58-61.
[5]江 丹,易 筠,杨 梅,等.不同产地艾叶总黄酮含量比较[J].中南民族大学学报,2009,28(1):55-56.
[6]徐新建,宋 海,韩玉琦,等.艾叶挥发油化学成分的气相色谱-质谱联用分析[J].时珍国医国药,2007,18(11):2657-2658.
[7]胡林峰,崔乘幸,吴玉博,等.艾蒿化学成分及其生物活性研究进展[J].河南科技学院学报,2010,38(4):75-78.
[8]陈小露,梅全喜.艾叶化学成分研究进展[J].药学进展,2013,23(12):848-851.
[9]Zietkiewicz E,Rafalski A,Labuda D.Genmoe fingerinting by simple se-quence repeats(SSR)-anhored polymerease chain reaction amplification[J].Gen-moics,1994,20:176-183.
[10]刘晓静,王海燕,张根良,等.改良CTAB法提取益智基因组DNA[J].江西农业学报,2007,19(8):111-112.
[11]王景雪,孙 毅,高武军.一种简便实用的植物总DNA 提取方法[J].山西大学学报:自然科学版,2000,23(3):271-272.
[12]刘本英,李友勇,唐一春,等.云南茶树资源遗传多样性与亲缘关系的ISSR 分析[J].作物学报,2010,36(3):391-400.
[13]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR 条件[J].湖南医科 大学学报,1998,23(4):403-404.
[14]穆立蔷,刘赢男,冯富娟,等.紫椴ISSR-PCR 反应体系的建立与优化[J].林业科学,2006,42(6):25-31.
[15]王彦华,侯喜林,徐明宇.正交设计优化不结球白菜ISSR 反应体系研究[J].西北植物学报,2004,24(5):899-902.
[16]Liu X J,Wang W Q.Establishment and Optimization of ISSR-PCR Reaction System For Alpinia oxyphylla[J].Miq.Biotechnology,2008,28(3):33-37.
[17]Wu S,Xiong Y T,Xie Y,et al.Optimization for ISSR-PCR reaction system on Schisandra henryi by orthogonal design[J].Chin Tradit Herb Drugs(中草药),2011,42(5):976-979.
[18]代红艳,张志宏,周传生,等.山楂ISSR 分析体系的建立和优化[J].果树学报,2007,24(3):313-318.
