接种量与通气比对印楝悬浮细胞生长及印楝素产量的影响
2015-07-01张云竹钟秋平
张云竹,钟秋平
(海南大学 食品学院,海南 海口570228)
印楝素是印楝植物组织细胞产生的一种次级代谢产物[1],具有高效杀虫、拒食、抑制生长发育、胃毒、忌避、抑制呼吸、抑制昆虫激素分泌、降低昆虫生育能力及杀灭微生物的作用[2-6],已在农业、医药、环保、化妆品及食品中广泛应用[7-8]。由于印楝素应用范围广,高效低毒,是新一代最具有开发价值的生物农药及食品防腐剂,具有广阔应用前景[9]。植物中印楝素含量低,种子中含量最高,也仅0.3%左右[10]。为了开发利用印楝素,需要通过植物纯化或者人工合成[11-12]得到印楝素。植物纯化存在植材耗量大、得率低等缺点,人工合成存在耗时长,得率仅0.000 15%[13],在实际生产中难以实现,因而不具备现实意义。
通过植物细胞悬浮培养生产次生代谢产物是目前活性物质生产中的一条重要途径,经此途径得到的目标产物与原植株相比具有产出速度快、产量高,生产环境条件易控制,可周年生产等[14]。印楝悬浮细胞扩大培养的目的是为了得到大量的印楝素,是其工业化生产的基础,而生物反应器是实现这一步的前提条件之一。生物反应器相对摇瓶而言,工作体积大,单位生产能力高,可以更好地控制反应系统;生物反应器可以放大,能应用于大规模生产。而国内相应的研究主要集中在印楝素的提取分离、作用效果、作用机制等方面,梁军等[15]对印楝细胞悬浮培养系的建立及悬浮培养条件进行了研究,但未见对其组织细胞扩大培养方面的研究报道。为此,笔者等探索接种量与通气比对印楝悬浮细胞生长及印楝素产量影响,以期为印楝悬浮细胞扩大培养提供依据。
1 材料与方法
1.1 材料
1.1.1 印楝悬浮细胞 印楝悬浮细胞,来自于印楝籽源经固体培养基多次继代诱导培养产生的生长旺盛、色泽嫩黄、疏松易碎的组织,接种于种子培养基。将续代稳定的印楝悬浮细胞按一定接种量转入500mL三角瓶,25℃培养8d后,得到足量的生长旺盛的印楝悬浮细胞作为种子细胞。
1.1.2 发酵设备和药品 发酵罐为5L 气升式发酵罐,上海宝兴生物设备工程有限公司;所有药品均为分析纯。
1.1.3 培养基
1) 种 子 培 养 基。 培 养 基 为 MS +BA2.0mg/L+蔗糖40g/L,pH 6.0。2)发酵培养基。培养基为MS+BA 2.0 mg/L+蔗糖40g/L,pH6.0,发酵至第8天加入已优化的组合诱导子(水杨酸92.00 mg/L、萘 乙 酸6.0 mg/L、壳 聚 糖54.0mg/L和吲哚丁酸3.0mg/L)。
1.2 培养方法
发酵罐反应器经空罐消毒后,装入3L 发酵培养基,调节pH 6.0,经消毒后接入一定量的印楝悬浮细胞种子液。培养期间通入一定量的无菌空气,保持温度(25±2)℃,黑暗培养。
1.3 细胞干重测定
将培养好的细胞悬浮液,摇匀后取100 mL,3 000r/min离心20 min,沉淀用蒸馏水清洗2次,50℃烘干至恒重后称量,即为细胞干质量,生长速率以g DW/(L·d)表示。
1.4 印楝素的提取与测定
参照文献[15]的方法用甲醇萃取干细胞中的印楝素。萃取液用0.45 μm 滤膜过滤,清液采用HPLC法检测样品中印楝素的含量。色谱条件:C-18柱,乙腈∶水(10∶90)为流动相,流速0.5mL/min,检测波长214nm,柱温30℃。以1g干愈伤组织中印楝素(mg)表示印楝素含量,产量以mg/L 表示,比产率以mg/(g·d)表示。
1.5 数据处理
数据统计分析采用SPSS 与Design Expert 8.0.6统计软件进行。
2 结果与分析
2.1 接种量与通气比对印楝悬浮细胞生长和印楝素产量的影响
从表中看出,当固定通气比为0.2vvm,不同接种量条件下印楝悬浮细胞生长和印楝素合成的变化情况。当接种量为20~60g FW/L时,印楝悬浮细胞的生长速率和印楝素的比产率随接种量的增大而增大,接种量为60g FW/L 时达最大,分别为0.75 g DW/(L·d)和0.55mg/(g·d);当接种量达80g FW/L时,印楝悬浮细胞的生长速率和印楝素的比产率又开始下降,细胞干重和印楝素含量降低。因此,综合考虑细胞生长和印楝素的累积,接种量为60g FW/L较适宜。
从表中还可知,当接种量为60g/L 时,不同通气比条件下,细胞生长和印楝素的累积随通气比的增大呈先升后降的趋势。当通气比为0.20vvm时,细胞生长量最大和印楝素积累量最多,分别为11.41g DW/L 和8.32 mg/g;当继续增大通气比时,细胞生长受到抑制,印楝素累积降低。因此,适宜的通气比为0.2vvm。
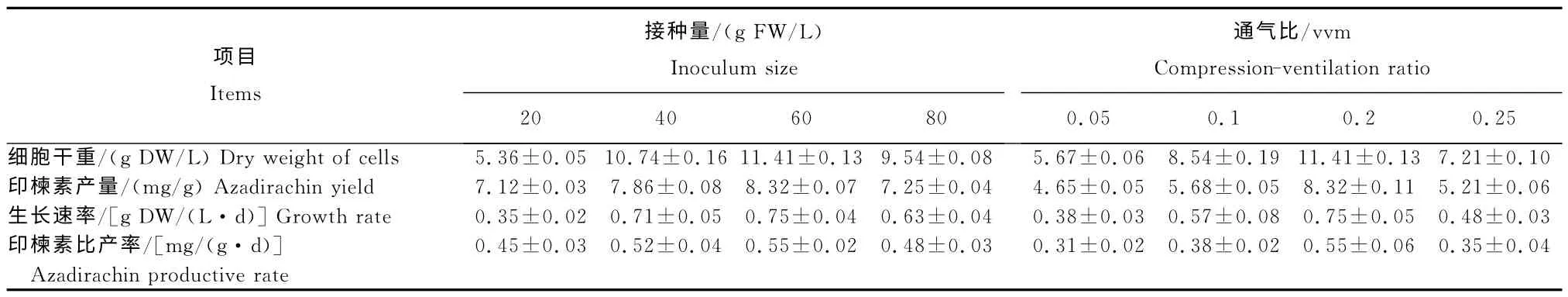
表 不同接种量与通气比条件下印楝悬浮细胞的生长状况与印楝素的产量Table Growth of A.indicasuspension cell and azadirachin yield under different inoculum size and compression-ventilation ratio
2.2 发酵过程中培养基pH 变化及加入诱导子后的印楝素产量
从图1看出,接种量60g/L、通气比为0.2vvm时,发酵过程中培养基的pH 呈先降后升的变化趋势。在发酵9d左右达最低值。可能是随着发酵时间的进行,培养基中的糖被利用,产生有机酸,使pH 值降低;随着发酵时间的进一步延长,pH 又逐渐回升,可能与后期产生的一些碱性物质有关。整个发酵期间,pH 变化范围在4.8~6.4。
从图1还可知,加入诱导子2d内,随着发酵时间的延长印楝素累积量逐渐增加,在诱导子加入后48h,印楝素累积量达最大,为8.32 mg/g,此后随着发酵时间的进一步延长,印楝素累积量略有下降,但降幅很小。
2.4 发酵过程中细胞的生长动态及印楝素的产量变化
从图2可知,在发酵过程中印楝悬浮细胞生长基本呈S型曲线。与摇瓶发酵相比,印楝悬浮细胞在发酵罐中的生长略差,在培养9d 时为摇瓶的90%左右,可能的原因是在发酵罐中的条件还没有达到最佳状态,特别是光照,与摇瓶培养存在差异。糖类物质消耗,发酵罐中印楝悬浮细胞对糖类物质的利用并不完全,在发酵结束时培养基中未被利用的蔗糖为0.8%~1.0%。可见,在发酵罐培养时可以适当降低糖类物质的浓度。添加复合诱导子的细胞生长与底物消耗与对照相比,在诱导子加入后略有差异(P>0.05)。从图2还可知,在细胞生长指数期的末期(第8天)添加复合诱导子,印楝素的积累效果极显著。添加诱导子的24h后印楝素产量最,达94.78mg/L,与对照相比差异达极显著水平(P<0.01)。
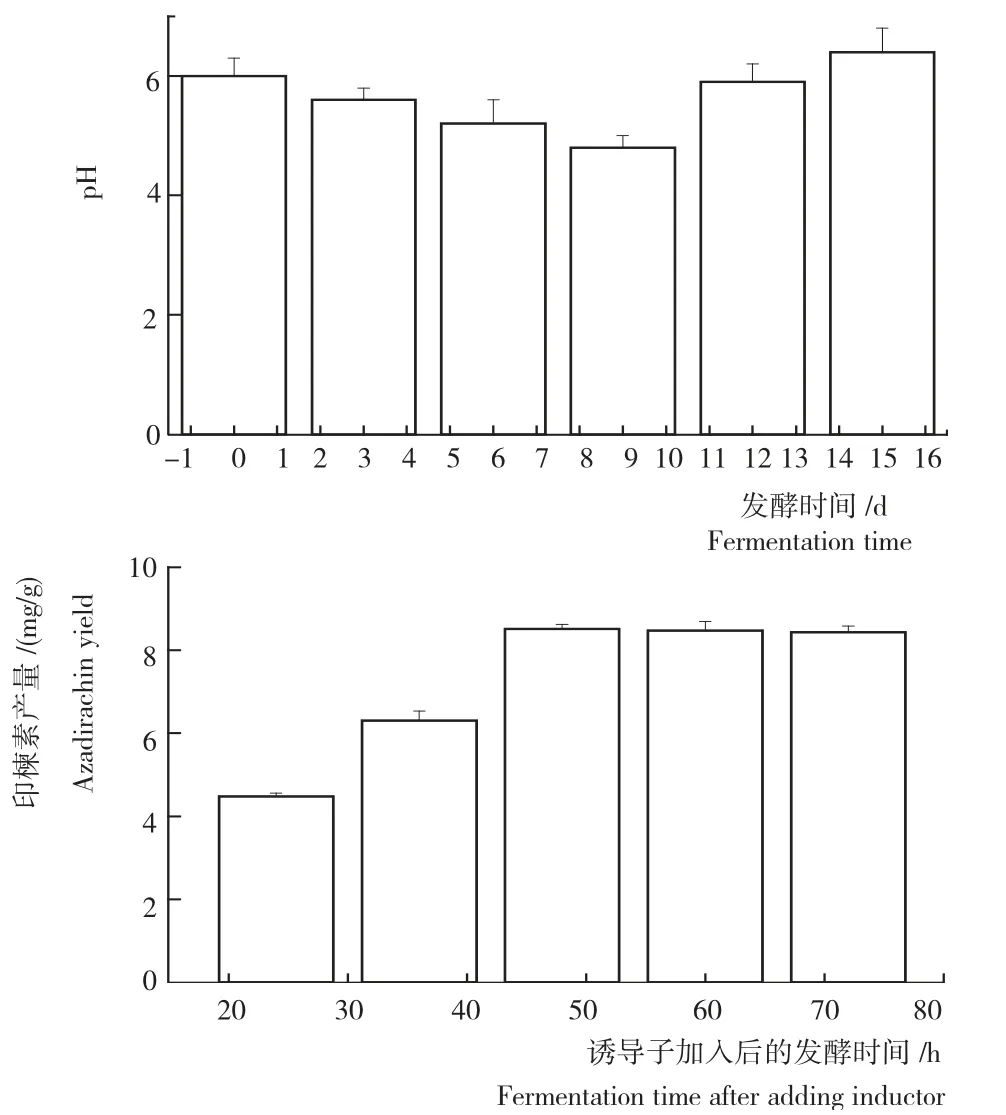
图1 发酵过程中培养基的pH 变化及加入诱导子后印楝素的产量Fig.1 Azadirachin yield of pH variation and inductor during the fermentation process
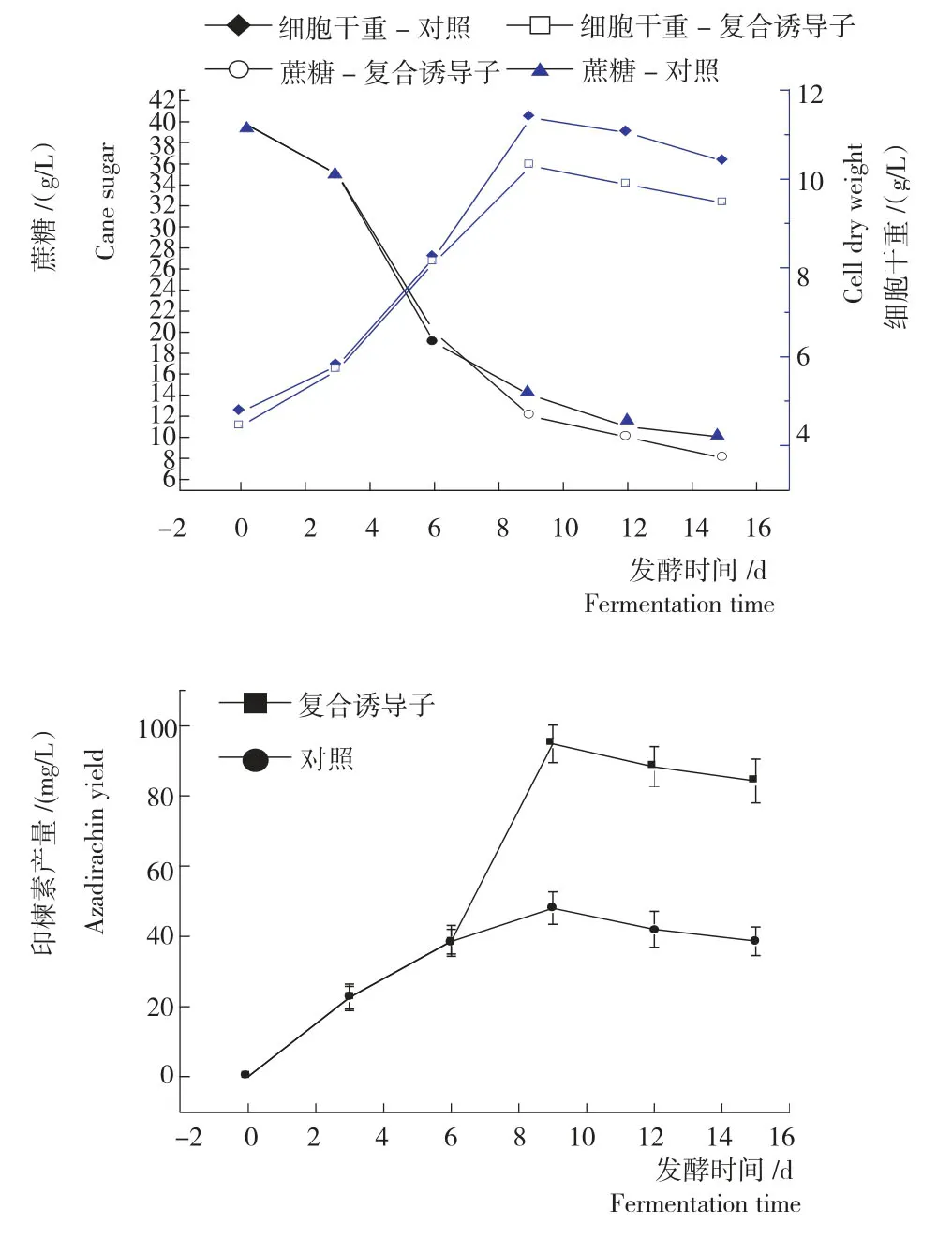
图2 发酵过程中细胞生长动态及印楝素的产量Fig.2 Growth dynamic and azadirachtin yield of A.indica suspension cells during the fermentation process
3 结论与讨论
1)接种量和通气比是影响发酵罐中悬浮细胞生长和产物积累最重要的2个因素。接种量过小,不能充分利用发酵液中的有效成分,在相同的发酵时间内,细胞增量小,要达到最大生长量,会延长发酵时间,降低设备的利用率。接种量过大,细胞竞争有限的营养成分,对悬浮细胞的生长不利;通气比大小影响发酵液的传质和传热。通气比低,发酵液的传热传质效果不好,影响悬浮细胞对营养物质的吸收和利用,从而影响悬浮细胞的生长和印楝素的合成;通气比过大,容易导致细胞损伤,进而影响细胞生长量和印楝素的合成。
2)在细胞生长的不同时期加入诱导子对产物的积累效果不同。细胞培养时期一般包括延迟期、指数期和稳定期3个时期,不同时期加入刺激剂诱导效果不同。Cu2+对红豆杉悬浮培养细胞中紫杉醇形成的影响最大的是生长指数期末期,在指数生长期末红豆杉培养细胞对Cu2+诱导处理具有最强的反应能力[16]。研究发现,水杨酸、萘乙酸、壳聚糖和吲哚丁酸组合的复合诱导子对印楝素的积累具有显著效果,且最适添加时期为细胞的指数生长期末期(另文发表)。诱导子刺激细胞合成最大目的产物所需要的时间各不相同,有的时间较长,有的时间较短[17]。本研究加入复合诱导子后获得最大印楝素含量所需的时间为48h,与Prakash等人[18]在3L的生化发酵罐中利用复合诱导子诱导印楝悬浮细胞积累最大量印楝素所需时间一致。
3)通过5L 气升式发酵罐研究印楝悬浮细胞初步扩大培养,探明了适宜的接种量和通气比分别为60g/L和0.2vvm,在此条件下,悬浮培养基质中的pH 变化呈先降后升趋势,细胞干重和印楝素产量分别为11.41g DW/L 和8.32 mg/g,添加复合诱导子后24h,印楝素产量最大值(94.78 mg/L)。在反应器中,印楝悬浮细胞生长和印楝素产量呈偶联型。
[1]Butterworth J H,Morgan E D.Isolation of a substance that suppresses feeding in locusts[J].Chem Commun,1968(1):23-24.
[2]贾建文,黄劲飞,王文祥,等.不同杀虫成分对Sf9细胞凋亡的影响[J].华南农业大学学报,2009,30(4):29-36.
[3]Mordue A J,Blackwell A.Azadirachtin:an update[J].Journal of Insect Physiology,1993,39:903-924.
[4]Sayah F,Idaomar M,Soranzo L.Endocrine and neuroendocrine effects of azadirachtin in adult females of the earwig Labidura riparia[J].Tissue and Cell,1998,30(1):86-94.
[5]徐汉虹.杀虫植物与植物性杀虫剂[M].北京:中国农业出版社,2001.
[6]Trand X,Tsuzuki E,Terao H,et al.Evaluation on phytotoxicity of neem(Azadirachta indica.A.Juss).to crops and weeds[J].Crop Protection,2004,23:335-345.
[7]林靖凌,蔡春茂,彭黎旭.印楝种仁粗提物对植物病原菌的抑制作用研究[J].安徽农业科学,2008,36(11):4566-4567.
[8]程少敏,邓忠贤.新型生物杀虫剂印楝素的应用[J].农药,2011(10):46-47.
[9]荣晓东,徐汉虹,赵善欢.植物性杀虫剂印楝的研究进展[J].农药学学报,2000,6(2):9-14.
[10]程金焕,徐永强,彭兴民,等.印楝种仁中印楝素含量的变异[J].江西农业学报,2009,21(5):30-33.
[11]Gill J S,Lewis C T.Systemic action of an insect feeding deterrent[J].Nature,1971,232:402-403.
[12]Rusoecn E.Growth disrup tion effects of an insect antifeedant[J].Nature New Biol,1972,236:159-160.
[13]Ley S V,Abad-Somovilla A,Erson J C,et al.The synthesis of azadirachtin:apotent insect antifeedant[J].Chemistry,2008,14(34):10683-10704.
[14]司徒琳莉,袁长友.次生代谢产物:代谢途径、分类、作用及生产[J].牡丹江师范学院学报:自然科学版,2001,23(3):3-5.
[15]梁 军,魏 刚,吕 全,等.印楝细胞悬浮培养系的建立及悬浮培养[J].林业科学研究,2003,16(5):568-574.
[16]李家儒,管志勇,刘曼西,等.Cu2+对红豆杉培养细胞中紫杉醇形成的影响[J].华中农业大学学报,1999,18(2):117-120.
[17]何雪娇.朱砂根细胞组织培养及其岩白菜素含量分析[D].福州:福建农林大学,2009.
[18]Prakash G,Srivastava A K.Statistical elicitor optimization studies for the enhancement of azadirachtin production in bioreactor Azadirachta indica cell cultivation[J].Biochemical Engineering Journal 2008,40:218-226.
