炎症微环境作用下非经典Wnt/Ca2+信号通路对牙周膜干细胞成骨分化的影响*
2015-06-28刘洪臣
刘 娜 李 华 张 洋 刘洪臣
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)是牙周组织再生修复的重要种子细胞[1]。但大量研究结果表明在慢性牙周炎的侵袭作用下牙周组织再生修复能力明显下降[2,3],如何促进牙槽骨再生是目前牙周炎导致的牙周组织损伤修复研究的热点。 干细胞参与组织再生受多种分子信号通路的调控,Wnt 通路在牙周膜干细胞成骨分化过程中发挥关键作用。Wnt 信号通路分为经典及非经典两种形式。目前在干细胞参与成骨分化的过程中研究较多的为Wnt / β-catenin 经典信号通路,非经典Wnt / 钙离子(Wnt / Ca2+)通路主要由Wnt5a 和Wnt11 激活,可能通过G 蛋白激活PLC(Phos pholi pase C)和PKC (Proteinkinase C),从而引起细胞内Ca2+浓度增加和Ca2+敏感信号成分的激活,以调节细胞运动和细胞粘着性。此外,Wnt/ Ca2+信号通路可以激活CaMKII 进而活化转录生长因子β 活化激酶1(TAK-1)-NLK;NLK可以使TCF/ LEF 磷酸化,可以阻止β-catenin-TCF/ LEF 复合体绑定DNA 进而抑制β-catenin-TCF/ LEF 复合体活化基因的转录[4]。
最新研究显示,不同类型Wnt 通路分子在干细胞的定向分化过程中具有不同作用。Wnt1,wnt3a 的表达导致wnt 经典信号通路的增强由此可以导致MSC 矿化能力受阻[5]。另有研究发现Wnt4 通过激活非β-catenin 通路(主要是Wnt/Ca2+与Wnt/ PCP 通路联合作用),促进MSCs 向成骨细胞分化,在颅面部和牙周缺损模型中表现出强劲的骨形成能力,促进缺损修复[6]。但炎症微环境影响牙周膜干细胞成骨分化的过程中是否有Wnt 非经典信号通路的参与,目前相关报道较少。本实验拟体外获取慢性牙周炎组织来源的PDLSC并探讨非经典Wnt/ Ca2+信号通路在其成骨分化过程中的作用机制。
1. 材料方法
1.1 材料 胎牛血清,α-MEM 培养基,Ⅰ型胶原(Gibco BRL);0.25%胰蛋白酶(Sigma, St Louis, MO, USA);青链霉素(Gibco BRL);链霉素(Gibco BRL);实时定量PCR 仪IQ 5(美国);RNA 抽提试剂盒及逆转录试剂盒Fermentas(美国);Taq DNA 聚合酶、dNTPs 和引物上海生物工程公司(中国); Syber Green 荧光定量PCR 检测试剂盒Takara(日本)。Western 及IP 裂解液,BCA 蛋白浓度测定试剂盒(碧云天公司);CaMKII抗体NLK 抗体(Millipore,美国);Runx 2 抗体ALP 抗体(Abcam,美国);β-Actin,羊抗兔IgG(北京中杉金桥)。
1.2 离体牙样本收集 收集因治疗需要拔除的健康以及慢性牙周炎病例样本。正常牙周膜组织来源于因正畸需要拔除的无龋前磨牙及第三磨牙;炎症牙周膜组织来源于慢性牙周炎患者,慢性牙周炎的诊断标准参照Armitage 的推荐标准[6]:X 线片显示牙槽骨吸收达到牙根2/ 3,一个以上的牙周袋探诊深度≥5mm。所有纳入个体均无系统性疾病及已知的可以影响牙周状况的疾病,无吸烟史,近6 个月无特殊服药史。所有组织样本均来自于解放军总医院口腔科,项目在患者知情同意的条件下进行。
1.3 牙周膜干细胞的体外培养 正常组织来源牙周膜干细胞H-PDLSCs 及炎症组织来源牙周膜干细胞P-PDLSCs 的体外培养遵循本实验室前期的实验步骤[7]。在超净工作台将拔除后的牙齿经0.01mol/ L PBS 冲洗5-7 次后,用冠根单向刮取根中/ 下三分之一的牙周膜,修剪组织块为1mm3大小,Ⅰ型胶原酶消化15min 后,离心管内的组织离心800r/ min。弃上清后重悬并放置在6 孔板中(含15%、胎牛血清)、100μm/ L 抗坏血酸、0.292mg/ ml 谷氨酰胺、100units/ ml 青霉素/ 链霉素的α-MEM 培养基)。在37℃、5%CO2和饱和湿度条件下培养5-8d,直至有细胞从组织块边缘爬出。细胞生长达80%汇合时用胰酶/ EDTA(0.25/ 0.1,pH=6.4)消化传代,标记为第一代。采用有限稀释法克隆化培养分离人正常及炎症组织来源的牙周膜干细胞,取3-4 代细胞进行实验。
1.4 成骨诱导试验 将多克隆来源的P-PDLSCs 和H-PDLSCs 制成细胞悬液,以5×104个/ ml 的密度接种于6 孔板中,用10%FBS 的α-MEM 培养24h,待细胞伸展至60%-70%汇合后换矿化诱导液(含5mmol/ L β-甘油磷酸钠,50μg/ ml 维生素C, 1×10-8mol/ L 地塞米松、10%FBS 的α-MEM 培养液)连续培养,每隔3d 换液一次,根据不同实验内容进行观察培养。
1.5 细胞免疫化学荧光染色 将生长状况良好的处于对数生长期的P3 代单克隆培养获得的H-PDLSCs 及P-PDLSCs 调整密度至5×103/ cm2密度接种至24 孔板,37℃、5%CO2、95%空气条件下常规培养过夜。待细胞贴壁后PBS 冲洗两遍,将H-PDLSCs 及P-PDLSCs 各设置两组,一组常规换液作为对照,而另一组则加入成骨诱导液,成骨诱导3d 后4%多聚甲醛常温固定40min,PBS冲洗3 遍,0.25%TritonX100, 37℃孵育20min,加入相应一抗,CaMKII(Millipore, USA)一抗浓度为1∶100,避光滴加FITC 标记的羊抗兔二抗(Pierce, USA;1 ∶800),孵 育 完 成 后,Hoechst 33342(50g/ ml, Sigma)衬染细胞核15min。荧光显微镜下观察,用DP controller(Olympus)和DP manager 软件处理图像。
1.6 实时定量PCR 检测 将H-PDLSCs 及P-PDLSCs 成骨诱导液7d 后用Trizol 裂解并提取总RNA,测定RNA 浓度,分别反转录为cDNA。逆转录所得cDNA 利用Syber Green 荧光定量PCR 检测试剂盒进行荧光定量PCR 检测,反应体系均为20μl 。引物序列:CaMKII(Ca2+/ 钙调素依赖型蛋白激酶Ⅱ):fo rward5' -CGCCCGGCACCCGGGGTGCGC-3' , reverse 5' -CAGAGGAGCACCGAGCCTTC-3' ; NLK (Nemo
样激酶):forward5' -AGGCTCCTGAGAATCAACCCAAC-3' , reverse5' -CCACGGTAATTGACCAACCTCTG-3' ;Runx2(Runt 相关因子2):forward: 5' -CCCGTGGCCTTCAAGGT-3' , reverse: 5' -CGTTACCCGCCATGACAGTA-3' ;β-Actin:orward5' -TGGCACCCAGCACAATGAA-3' ,reverse 5' -CTAAGTCATAGTCCGCCTAGAAGCA-3' 。反 应 条 件: 95℃变 性20min, 95℃30s, 60℃1min, 40 个 循 环。IQ5 型实时荧光定量PCR 仪监测记录数据,结果根据标准曲线由软件自动计算后得出。验证该方法的重复性和扩增效率。本实验进行三次重复。
1.7 Western blot 检测细胞中的蛋白表达 采用细胞裂解液试剂盒分别提取对照组及成骨诱导7d 组P-PDLSCs 与H-PDLSCs 的总蛋白,测定蛋白样本浓度,制备蛋白样品。配置10%的分离胶、6%的浓缩胶和1×SDS 电泳液,依据蛋白定量结果进行蛋白上样,电压为80V,电泳20min待溴酚蓝进入分离胶后调整电压至120V,电泳60min。随后将凝胶中的蛋白在转移电泳槽(200 mA, 2h) 中转至聚偏氟乙烯(polyvinylidene fluorid,PVDF) 膜。用TBST 配制的含有5%脱脂奶粉的封闭缓冲液对PVDF 膜封闭2h,PVDF膜封闭一抗Runx2、ALP、CaMKII、NLK(1∶1000)稀释,以β-Actin 为内参,4℃过夜。次日取出封有一抗的PVDF 膜,复温1h TBST 洗膜,每次5min,共计3 次。按说明书加入相应浓度的二抗,室温条件下封闭2h。TBST 洗脱二抗,每次10min,共计3 次。漂洗膜后加入电化学发光底物发光显色试剂盒显色,蛋白凝胶成像系统照相观察。采用ImageJ 对WB 检测正常及炎症微环境中PDLSCs 成骨分化过程中关键成骨蛋白及Wnt 非经典信号通路蛋白水平灰度分析。
1.8 统计学分析 SPSS16.0 统计软件进行相关数据分析。两组间比较采用独立样本t检验;P<0.05 差异有显著性。进行多组间比较时,P值进行Bonferroni 校正。
2. 结果
2.1 H-PDLSCs 与P-PDLSCs 成骨诱导3d后免疫荧光检测胞浆内CaMKII 的表达 我们将H-PDLSCs 与P-PDLSCs 接种于24 孔板细胞密度达到70%左右时加入成骨诱导液诱导3d,显微镜下检测Wnt/ Ca2+信号通路细胞浆内中游途径关键蛋白CaMKII 的表达。免疫荧光结果显示未经诱导的H-PDLSCs 与P-PDLSCs 对照组细胞浆内表达CaMKII,结果图示中红色荧光表达即为CaMKII。在成骨诱导液的作用下无论H-PDLSCs还是P-PDLSCs 细胞浆内的CaMKII 的荧光表达强度较其各自对照组增强(图1)。

图1 免疫荧光染色检测细胞内CaMKII 的表达。细胞放大倍数×200
2.2 正常及炎症组织来源PDLSCs 成骨诱导7d 后Wnt 非经典通路关键基因及成骨转录因子的表达 实时定量PCR 结果显示常规培养条件下CaMKII 在H-PDLSCs 与P-PDLSCs 中的表达不存在显著性差异,当成骨诱导后H-PDLSCs 与P-PDLSCs 中CaMKII 的表达量显著增高,其中H-PDLSCs 增高比例为5.5876 倍,而P-PDLSCs的增高比例为3.78 倍(图2A)。NLK 是细胞核内的一种关键基因可影响基因的转录和翻译,常规培养条件下P-PDLSCs 中NLK 的表达水平显著高于H-PDLSCs,成骨诱导后两种组织来源细胞中NLKmRNA 的表达水平均有显著性升高但H-PDLSCs 组显著高于P-PDLSCs 组(图2B)。Runx2 的检测结果与我们前期试验结果一致成骨诱导后H-PDLSCs 组显著高于P-PDLSCs 组(图2C)。
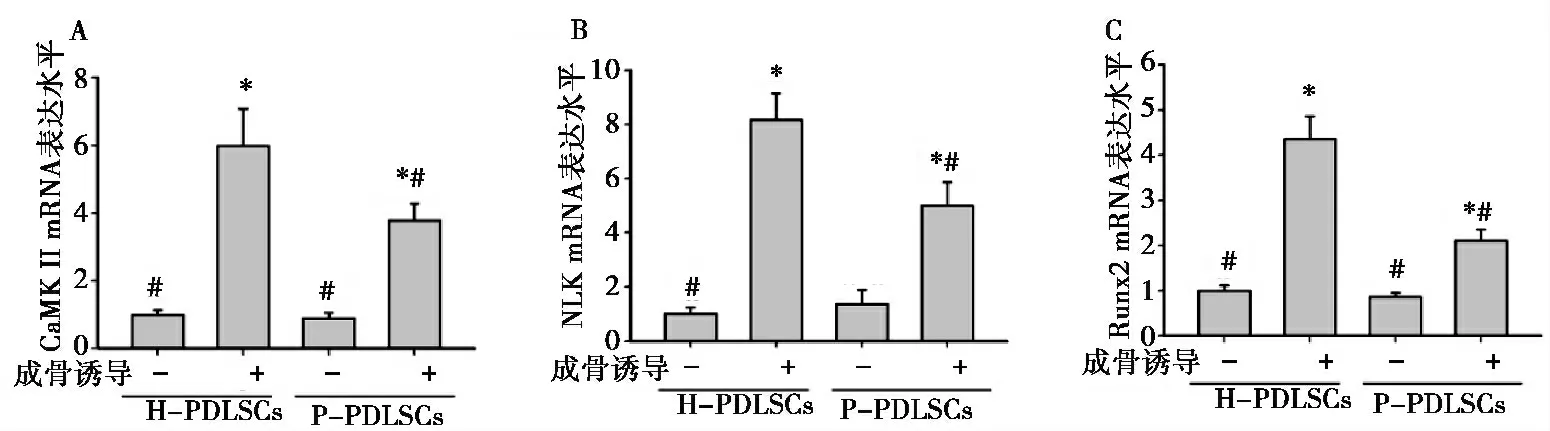
图2 成骨诱导7 天后Real Time PCR 检测检测CaMKII(A)、NLK(B)和Runx2(C)表达。与未经成骨诱导的H-PDLSCs 相比,*P<0.05;与成骨诱导的H-PDLSCs 相比,# P<0.05。
2.3 Wnt / Ca2+信号通路的激活可以提高P-PDLSCs 的成骨分化能力 Wnt / Ca2+信号通路关键蛋白的检测WB 结果显示:在常规培养的条件下H-PDLSCs 与P-PDLSCs 细胞中CaMKII以及NLK 的表达水平无明显变化,但是成骨诱导7d 后二者的表达量均显著增高(图3)。同时发现,P-PDLSCs 细胞CaMKII、NLK 成骨诱导后的表达水平低于H-PDLSCs。Runx2、ALP 是成骨的关键蛋白,经过7d 的成骨诱导液进行定向诱导之后可见H-PDLSCs 与P-PDLSCs 两种蛋白的表达水平均显著增高,但P-PDLSCs 中二者的水平低于H-PDLSCs(图3)。
3. 讨论
牙周病治疗的理想结果是获得牙周支持组织包括牙槽骨、牙骨质和牙周膜的完全再生。组织工程技术为牙周治疗开辟了新的途径,牙周膜干细胞作为种子细胞在其中发挥重要作用。牙槽骨保持着稳定的生理性动态平衡,当这种平衡受到干扰后则表现出病理性过程,维持上述平衡的是间充质干细胞,同时干细胞的各项功能受到严密的分子调控。前期我们的研究结果表明,慢性牙周炎组织来源的牙周膜干细胞的成骨分化能力降低,这即是牙周组织再生能力下降的关键因素之一[7,8]。
干细胞向成骨细胞分化的过程中,受到多种细胞因子、生长因子信号通路的调控,比较经典的如BMP、Wnt、Notch、FGF、PI3K/ Akt 等,这些信号通路最终汇聚到成骨细胞的关键转录因子Runx2,影响Runx2 的转录和成骨细胞的分化。其中Wnt 信号通路是公认的在干细胞骨向分化过程中对细胞的增殖和分化起指导作用的一种重要的信号系统,在牙周膜干细胞成骨分化的过程中研究较多的为Wnt 经典信号通路[9]。但是,Wnt 经典和非经典信号通路在干细胞向软骨细胞分化以及细胞外基质代谢过程中发挥重要调控作用,对不同时期、不同部位软骨形成不仅有正调控作用,还有负调控作用。非经典的Wnt/Ca2+信号通路通过钙依赖性激酶、钙调蛋白和转录因子N-F-AT 起作用。越来越多的研究表明,细胞内Ca2+震荡和维持未分化人干细胞的稳定之间存在密切的联系。激活Wnt/Ca2+信号通路可以导致细胞内Ca2+的释放,从而激活CaMKⅡ,以及pkc(protein kinase C,PKC),虽然众多研究报道G 蛋白参与在Wnt/Ca2+信号通路,但是目前尚无G proteins 与Frizzleds 蛋白直接结合的证据,CAMKII 则为非经典信号通路中游的关键蛋白[10]。目前还有研究表明在非经典的Wnt/Ca2+信号通路中TAK-TAB作为支架蛋白在该信号通路中发挥重要作用,二者结合后可与NLK 结合启动下游分子信号,可使NLK 进入胞核,可以与一些特定的转录因子发挥作用。本实验通过免疫荧光检测手段检测到正常及炎症组织来源PDLSCs 细胞浆内均表达非经典Wnt 信号通路的中游关键蛋白CaMK Ⅱ,而在H-PDLSCs 与P-PDLSCs 成骨诱导后CaMKⅡ表达的荧光强度出现变化,这提示非经典的Wnt/Ca2+信号通路参与了正常及炎症组织来源牙周膜干细胞的成骨分化。
为了进一步准确的探寻Wnt / Ca2+信号通路在成骨诱导作用下是否参与了P-PDLSCs 成骨分化及调控,我们对CaMKII 与NLK 做出了相应检测。发现在成骨诱导后H-PDLSCs 与P-PDLSCs细胞中CaMKII、NLK 的表达水平显著增高,这说明成骨诱导的微环境可以激活非经典Wnt / Ca2+信号通路。但是我们发现,炎症微环境作用下CaMKII、NLK 的表达水平低于正常组织来源的干细胞。此外,我们从基因及蛋白水平分别检测了H-PDLSCs 与P-PDLSCs 成骨分化过程中的关键分子。结果表明,无论是成骨转录因子Runx2 还是成骨关键蛋白ALP 的表达水平在H-PDLSCs与P-PDLSCs 成骨诱导7d 后均有所升高,但是P-PDLSCs 中两种关键分子的水平低于H-PDLSCs。钙离子的沉积量是骨形成的关键,CaMKII 在细胞内可以调节钙离子的状态影响骨的形成。在非经典Wnt / Ca2+信号通路中CaMKII处于该信号的中游水平,可以间接的作用于其下游的NLK,NLK 蛋白与支架蛋白结合后可以进入细胞核与其相应的转录因子结合而改变干细胞的功能[11,12]。
在激活Wnt/ Ca2+信号通路后NLK 与其支架蛋白TAK-TAB 结合后可进入细胞核,在细胞核内NLK 可以抑制TCF/ LEF 复合体结合DNA,以此抑制细胞增殖。我们的研究结果表明,无论正常组织来源的还是炎症组织来源的PDLSCs 成骨诱导7d 后都可以发现CaMKII 和NLK 水平的升高。结合目前的研究前沿我们认为干细胞分化过程中Wnt 经典与非经典信号通路共同发挥作用,二者之间的变化趋势也证实了二者存在相互作用,在调控干细胞介导的骨再生过程发挥关键作用。但Wnt 非经典信号通路在细胞浆内活化钙离子及在胞核内启动相应的下游靶基因的复杂作用机制仍需深入探讨。
[1] Seo BM,Miura M,Gronthos S,et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet,2004,364:149-155
[2] Yang N,Wang G,Hu C,et al.Tumor necrosis factor α suppresses the mesenchymal stem cell osteogenesis promoter miR-21 in estrogen deficiency-induced osteoporosis [J].J Bone Miner Res,2013,28(3):559-573
[3] Liu Y,Liu W,Hu C,et al.MiR-17 modulates osteogenic differentiation through a coherent feed-forward loop in mesenchymal stem cells isolated from periodontal ligaments of patients with periodontitis[J]. Stem Cells,2011,29(11):1804-1816
[4] Ishitani T,Kishida S,Hyodo-Miura J,et al. The TAK1-NLK mitogen-activated protein kinase cascade functions in the Wnt-5a/ Ca (2+) pathway to antagonize Wnt/ beta-catenin signaling[J]. Mol Cell Biol,2003,23:131-139
[5] Liu G,Vijayakumar S,Grumolato L,et al.Canonical Wnts function as potent regulators of osteogenesis by human mesenchymal stem cells[J]. J Cell Biol,2009,185:67-75
[6] Chang J,Sonoyama W,Wang Z,et al. Noncanonical Wnt-4 signaling enhances bone regeneration of mesenchymal stem cells in craniofacial defects through activation of p38 MAPK[J]. J Biol Chem,2007,282:30938-30948
[7] 刘 娜,蒋贵新,张 博,等.糖原合成酶激酶3 对炎症状态下牙周膜干细胞成骨分化能力的影响[J].中华老年口腔医学杂志,2014,12(3):129-133
[8] 聂 嘉,张 博,顾 斌,等.p38 丝裂原活化蛋白激酶在炎症微环境作用下对牙周膜干细胞成骨分化的影响[J].中国医学科学院学报,2015,37(1):1-7
[9] Liu W, Konermann A, Guo T, et al. Canonical Wnt signaling differently modulates osteogenic differentiation of mesenchymal stem cells derived from bone marrow and from periodontal ligament under inflammatory conditions [J].Biochim Biophys Acta,2014,1840(3):1125-1134
[10] Slusarski DC,Pelegri F. Calcium signaling in vertebrate embryonic patterning and morphogenesis [J]. Dev Biol,2007,307(1):1-13
[11] Suzawa M,Takada I,Yanagisawa J,et al. Cytokines suppress adipogenesis and PPAR-gamma function through the TAK1/ TAB1/ NIK cascade[J]. Nat Cell Biol,2003,5(3):224-230
[12] Katoh M. STAT3-induced WNT5A signaling loop in embryonic stem cells, adult normal tissues, chronic persistent inflammation,rheumatoid arthritis and cancer[J]. Int J Mol Med,2007,19:273-378
