组织残留法在水生生物基准中的应用概述
2015-06-27张瑞卿吴丰昌
张瑞卿,吴丰昌
1. 内蒙古大学环境与资源学院, 呼和浩特 010021 2. 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012
组织残留法在水生生物基准中的应用概述
张瑞卿1,吴丰昌2,*
1. 内蒙古大学环境与资源学院, 呼和浩特 010021 2. 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012
水生生物基准已成为生态风险评价和水环境管理的主要参考依据,在水污染治理、控制和管理以及水生生物保护方面发挥着重要作用。环境和生物学参数对基于水体或沉积物等外暴露浓度的毒性阈值和环境基准存在影响,使其具有变异性和不确定性。而基于组织残留的毒性剂量指标可以减少毒性值的变异性以及不确定性,特别是对于生物累积性物质而言,在毒性效应及环境基准研究中存在显著优势。针对组织残留法在水生生物基准研究中的应用,对组织残留法的概念、优势、应用,以及组织残留基准的推导方法等几个方面进行了综述,并提出了组织残留法在应用中存在的关键问题及建议,旨在推动环境基准、生态风险评价理论和方法的研究,以及为水环境管理和污染防治提供技术支持。
水生生物;环境基准;生态风险评估;组织残留法
随着环境中污染物种类不断增多以及环境污染的加剧,环境质量基准的研究越来越受到重视。环境质量基准是制/修订环境质量标准,评价环境风险,保护生物多样性及生态系统结构和功能完整性的主要参考依据[1-2]。世界各国学者和环保部门在基准理论与方法学、基准值推导及其应用条件等方面都已经开展了大量研究[3-8]。其中,水生生物基准是利用基于水体或沉积物中污染物浓度的急性或慢性毒性数据推导的基准值,以保护水生生物不受污染物的有害效应为目标;在水体污染物的管理和控制以及水生生物保护方面发挥着极为重要的作用[9-11]。
环境质量基准研究是对各学科最新研究进展的反映,环境科学、毒理学和生物学等学科的不断发展,对基准和风险评价提出了新的挑战和要求。研究结果与实际环境间的不确定性是环境质量基准研究以及生态风险评价中存在的主要问题之一。这种不确定性主要来源于环境生态系统的复杂性及人类认知能力的局限性。目前,由于检测技术以及环境管理需求等方面的因素,污染物的毒性研究、环境基准值的推导以及生态风险评价多数是基于环境介质(如水体、土壤和大气等)中污染物浓度。比如保护水生生物免受污染物有害效应的水质基准值均是以水体中污染物含量表示[9];评价水体中污染物对水生生物的风险时,暴露评价中需要监测或预测水体中污染物的含量,效应评价中分析基于水体中污染物含量的毒性阈值[12]。而污染物在水体中有多种存在形态,有些形态不具有生物有效性,因此水体中污染物含量并非是对水生生物产生毒性效应的真正剂量。直接使用环境介质中的污染物水平来评价生物的毒性效应,进而推导基准值以及评价生态风险存在一定的不确定性。特别是对于具有持久性、生物累积性的有毒物质(persistent, bioaccumulative and toxic chemical, PBT)而言,水体中含量与在生物体内累积的对生物产生生物学效应的含量不具有等效作用。如何能准确地反映PBT物质对生物的剂量-反应关系是环境基准和风险评价中需要进一步解决的关键问题。另外,食物链较高营养级生物在对PBT物质的生物累积过程中,摄食暴露是主要途径,水体和其他暴露途径贡献较小。因此直接使用基于水体等外暴露剂量表达的基准值可能并不是最佳选择。
基于以上考虑,污染物的组织残留在近年来逐渐引起了人们的普遍关注。应用污染物在受试生物组织中的残留含量描述毒性效应,推导基于组织残留的毒性效应阈值。事实上,应用组织残留分析毒性效应并不是一个新鲜的研究内容,在过去的数十年间科学家们就逐渐接受组织残留作为毒性作用的剂量指标[13]。而且生物组织中污染物含量的检测也在环境监测中广泛开展,已发布了大量基于生物组织中污染物含量的监测数据[14-16]。近年来许多研究发现,与应用环境介质中浓度相比,基于组织残留毒性剂量指标的应用可以减少毒性值的变异性[13]。目前,已经有研究开展了基于组织残留的基准推导和生态风险评价[17-19],为组织残留方法的发展和应用提供了依据。然而,对于组织残留方法的理论基础和应用只是初步研究,在环境质量基准和生态风险评价中的应用还存在很多问题需要解决。本研究针对组织残留效应数据在水生生物基准方面的应用,从组织残留方法的概念、优势、应用,以及组织残留基准的推导方法和理论框架等几个方面进行详细探讨,旨在为水生生物基准和生态风险评价的理论和方法以及污染物管理和控制提供理论参考。
1 组织残留法(Tissue residue approach)
1.1 概念及优势
组织残留法(tissue residue approach, TRA)是将暴露生物的毒理学反应与生物身体或组织内检测或预测的化学物质含量相关联的方法[20]。使用污染物的身体或组织残留含量可以更好地反映生物可利用性和有效的靶剂量,可以在一定程度上减少某些污染物毒性阈值的种间差异。不同毒性研究结果差异的大部分原因来自不同物种有不同的吸收和代谢动力学,以及不同化学物质的生物有效性存在差异。传统的水生态毒性研究依赖于将试验生物暴露于含有污染物质的各种环境介质中(水、沉积物或试验介质中的食物)。然而由于环境中有多种理化参数可影响化学物质的生物有效性,最终影响化学物质进入生物体内的剂量。对于有机物,盐度、有机碳、细菌活性以及脂质含量都会影响其生物有效性;而可能影响金属存在形态的环境条件包括氧化还原条件、盐度、pH、有机碳、硬度和碱度等。另外生物本身的生物学特征以及化学物质特性等都会影响化学物质的迁移转化。通过环境介质(水和沉积物等)中污染物含量表达的环境暴露具有很高的种间差异。比如,氯酚的毒性效应,通过水体中氯酚的暴露效应结果可以看出,不同氯酚化合物的反应相差3个数量级,而对一给定氯酚化合物其种间差异也很大[21]。生物体表现出的有害效应是化学物质在生物体内或特定组织内累积的效应。使用组织残留浓度可以提供化学物质确切吸收量证据,避开了一些环境和生物影响因素;并且直接将生物累积量与毒性反应联系了起来,降低了由于物种和环境因素差异导致的不确定性。化学物质在生物体内部的累积浓度(组织残留浓度)反映了化学物质的生物有效性、吸收、代谢效率以及多种途径暴露结果,所以被认为是外部浓度更好的替代方法。
1.2 组织残留毒性阈值
组织残留毒性值是应用生物特定组织或全身污染物残留量描述相应的有害生物学反应,比如致死残留剂量(lethal tissue residue, LR50)、有效残留剂量(effective tissue residue, ER50)、最低可见效应残留剂量(lowest observed effects tissue residue, LOER)或者无可见效应残留剂量(no observed effects tissue residue, NOER)。在对污染物的毒性数据研究中发现,与基于环境介质浓度的毒性值相比,环境条件对组织残留毒性值影响较小,组织残留毒性值变化范围小。氯酚类化学物的致死浓度(lethal concentration, LC50)变化范围为3个数量级,而LR50的变化范围仅1个数量级[22]。一些麻醉型有机物对鱼的环境暴露急性毒性值(96 h-LC50)变化范围是100 000倍多,而通过模型获得的基于组织残留的毒性值变化范围仅为10倍[23-24]。水体中三丁基锡对2种端足类动物(Rhepoxynius abronius和Eohaustorius washingtonianus)暴露的LC50值相差112倍,而基于全身组织残留的LR50值在2个物种间没有统计学差异[25]。镉在寡毛类蠕虫(Lumbriculus variegatus)体内的累积量似乎不受硬度和溶解性有机碳的影响,不同处理条件间的累积量无显著差异;LC50值变化的倍数是28,而LR50值的变化倍数仅为1.8[26]。相比基于水体浓度的毒性值,应用镉的累积量表示的甲壳类动物(Hyalella)的慢性毒性受试验溶液中螯合剂(腐殖酸、乙二胺四乙酸和沉积物)的影响较小[27]。不同pH值和硬度条件下的毒性测试结果显示铜对蠕虫(L. variegatus)的LR50值几乎保持稳定[28]。铜对双壳类动物的毒性研究也得到类似结果[29]。显然,污染物的内暴露毒性阈值的变异性比外暴露毒性阈值低。使用污染物的组织残留剂量表示毒性效应阈值比基于环境外暴露浓度更加准确。
因为应用组织残留浓度表示的毒性效应值具有相对较低的不确定性,数据间差异较小,所以仅需要较少物种的毒性值即可获得可靠的结果[13]。可能仅需要较少物种用于毒性试验以描述某一特定化学物质的毒性效应。
1.3 组织残留与剂量-效应关系
组织残留毒性数据应用的前提是毒性研究中的组织残留量与效应间存在一定的剂量-效应关系。目前,在毒理学方面已经有研究将污染物在生物体内的累积量与毒性效应相联系。持久性有机污染物(persistent organic pollutants, POPs)的亲脂性高,极易在生物体内累积,并沿着食物链逐级传递和放大,从而对生物体或生态系统造成影响[30-31]。大量的野外和实验室生物监测结果表明,组织内的POPs累积与鱼类的免疫效应、组织病变、生殖和发育损伤等效应有关[31-35]。有研究将重金属在无脊椎动物体内的累积量与生物的生殖和发育效应相联系,建立相应的残留剂量-效应关系[29,36-37]。
1.4 组织残留与暴露途径
通常化学物质对生物产生毒性效应的作用剂量来自多个暴露途径,比如饮食、沉积物和水体等,而随食物链累积或食物暴露是PBT物质主要的暴露途径[38]。对于PBT物质而言,仅使用水体暴露来研究其生物效应时显现出诸多困难。越来越多的研究认为摄食是水生生物吸收金属的主要暴露途径。研究显示水生动物几乎主要是通过食物摄取镉[39]、硒[19,40]和汞[41-42]等金属,高营养级肉食性动物更是如此。另外也有研究表明食物是肉食性昆虫和甲壳类等无脊椎动物吸收金属的主要来源,忽略金属的食物来源会低估生物的暴露量[43]。同样对于具有生物累积性的有机污染物而言,食物摄取也是水生动物的主要暴露途径[44]。污染物在生物组织中的残留剂量是多种途径暴露的结果,组织残留毒性数据集合了多个暴露途径,减少了仅考虑单一暴露途径的不确定性。
1.5 组织残留法的应用
关于生物效应与组织内污染物残留的关系在20世纪上半叶就有讨论[45],直到近年来化学和毒性实验提供了大量的高质量数据,以及一些有机物和有机金属等组织残留关系的成功应用,才使得组织残留法正式被应用于环境管理。前面已经提到将组织残留应用到毒性预测上存在诸多优势[22,45-46]。基于特定组织的残留含量来表示毒性效应可以避免物种间毒性代谢动力学差异;另外,也将影响化学物质生物有效性的因素考虑在内。TRA概念的提出可以解决环境条件和污染物代谢等对基于环境介质浓度毒性值影响的问题。特别是对于PBT物质的关注,TRA的应用更加促进了对现有环境基准的重新评估。将基于环境介质、外暴露剂量以及组织残留法结合使用,可以改进环境基准和生态风险评价方法。
TRA已经在一些物质的环境基准和风险评价研究中得到初步应用,且美国和加拿大环保部门也采用了该方法用于生物累积性物质的环境基准研究(表1)。应用组织残留方法推导环境基准,得到的结果为组织残留基准(tissue residue criteria, TRC)。所谓组织残留基准即是采用以目标生物体内或组织中残留污染物含量表示的毒性数据结合一定的分析方法得到的基准值,而不是由环境介质(水和沉积物)中浓度得到[38]。针对生物累积性物质的特性及其对水生生物的毒性效应,美国环保局简要介绍了组织残留基准概念、研究指南及基准推导框架[38,47]。由于硒具有较高的生物累积性并且可以通过食物暴露对鱼和高营养级生物产生危害,很多研究都对其组织残留基准进行了探讨[48-54],针对不同区域、不同生物类型及组织提出了硒的基准。美国环保局也在对硒的组织残留毒性研究的基础上提出了保护水生生物硒组织残留基准[19]。Di Toro等[55-56]结合TRA与物种敏感度分布法推导了多环芳烃的组织残留基准。另外有学者研究了其他几种具有生物累积性物质的组织残留基准,比如多氯联苯[57]、三丁基锡[18]、汞[17]、滴滴涕[17]、锌[58]以及四氯二苯并-p-二恶英(tetrachlorodibenzo-p-dioxin, TCDD)[59]等。
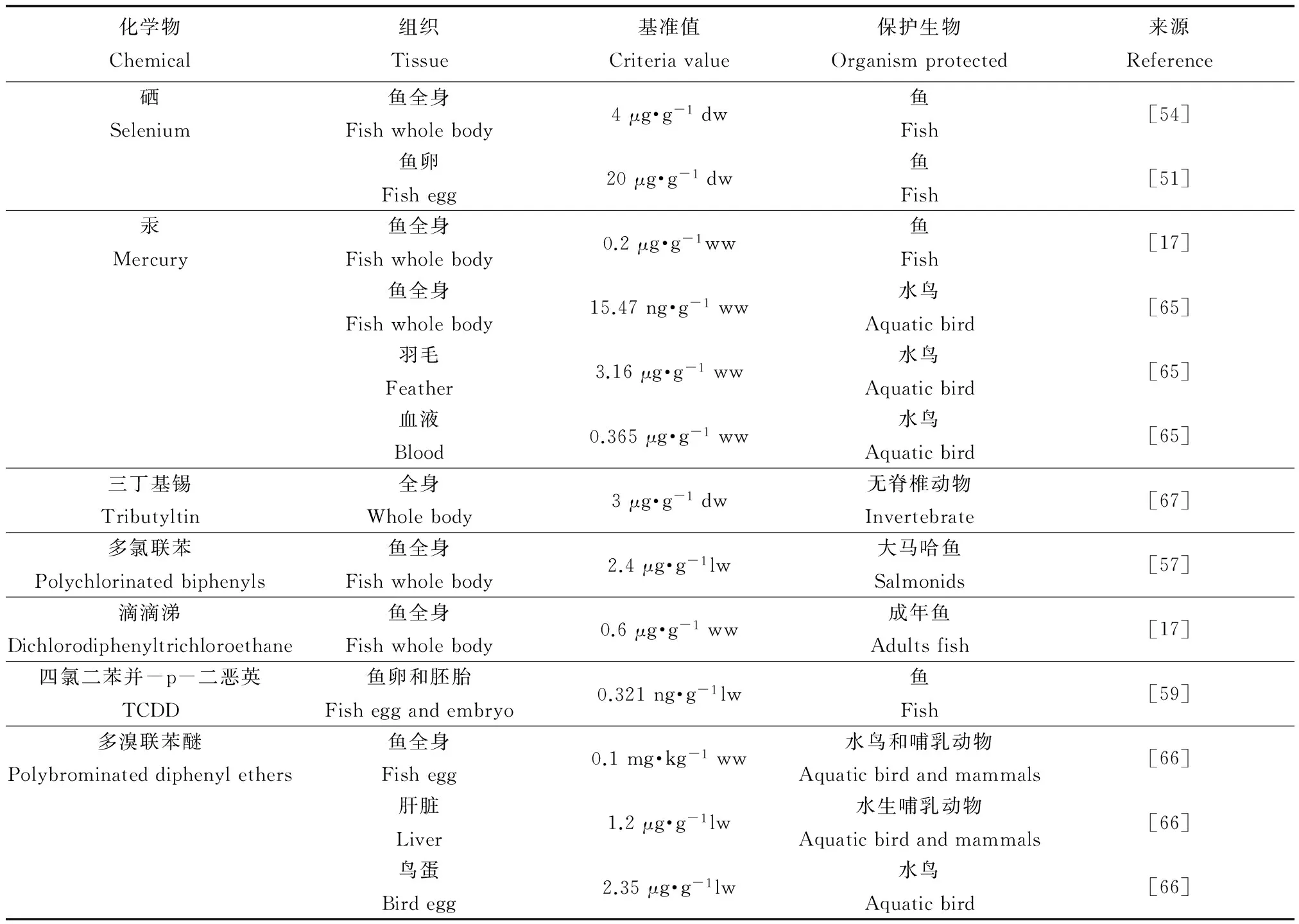
表1 一些化学物质的组织残留基准值
注:ww为湿重(wet weight),dw为干重(dry weight),lw为脂质重量(lipid weight)。
Note: ww = wet weight, dw = dry weight, lw = lipid weight.
TRA也用于研究高营养级野生生物基准。对于水生态系统中处于食物链较高营养级野生生物,包括大型肉食性鱼类、食鱼哺乳动物和鸟类主要通过摄食累积PBT物质,营养级越高可能存在的有害风险会越高。因此将组织残留方法用于研究高营养级野生生物的基准以及生态风险已成为研究趋势。加拿大环保部建立了基于TRA的保护野生生物组织残留基准推导框架,但是该基准主要是基于野生食鱼水鸟和哺乳动物食物(如,鱼组织)中的污染物含量[60]。应用该方法推导了甲基汞[61]、滴滴涕、TCDD、多氯联苯和毒杀芬的野生生物组织残留基准值[62]。相比针对食物中残留含量表示的基准,使用目标生物组织中污染物残留含量表示的毒性效应更加准确。因此,有研究提出了基于水鸟血液、肝脏和卵中全氟辛烷磺酸盐的毒性参考值[63],以及野生哺乳动物和鸟类血液铅的毒性阈值[64]。依据最新毒性实验结果,有研究分析了甲基汞野生生物毒性效应的物种敏感度分布,提出了分别基于食鱼水鸟饮食(鱼组织)和水鸟组织(羽毛和血液)中甲基汞含量的基准值[65],以及研究了基于野生食鱼哺乳动物肝脏和鸟蛋中多溴联苯醚的组织残留基准值[66]。
除了将组织残留法用于环境基准研究外,许多区域环境评价项目也使用该方法进行生态风险评价。美国环保局在超级基金项目中对多个污染场地进行修复评价,提出了三丁基锡组织残留毒性参考值,将其用于特定区域的生态风险评价[20]。另外,美国在农药注册过程中对新农药进行评价时也开始使用组织残留法,特别是对一些存在生物累积特性的农药[68]。直接测定目标生物组织中的污染物含量,结合组织残留毒性值或组织残留基准值评价生态风险[69]。组织残留方法已逐渐成为研究PBT物质环境基准和生态风险评价的有效方法,且已得到初步的应用。组织残留基准的提出弥补了水质基准一些应用上的不足。比如,汞是具有较高生物累积性的污染物,研究显示即使水体中汞处于背景值水平也可能在鱼或其他高营养级生物体内达到与汞污染区域相似的累积量[70]。南佛罗里达河口水体汞的含量仅为3~7.4 ng·L-1,远低于美国环境保护局汞的水生生物慢性水质基准值770 ng·L-1;但是鱼体内的汞累积量达到了0.31 μg·g-1,已对鱼和食鱼野生生物造成潜在有害风险[71]。因此,应将组织残留法应用到环境基准及风险的研究中,构建基于环境介质和生物组织中污染物含量的综合性环境基准体系。
2 组织残留基准的推导(Derivation of tissue residue criteria)
研究TRA最重要的目的之一就是应用其推导组织残留基准。正如前面论述,组织残留方法已经在环境基准及生态风险评价中得到了初步应用,如何应用组织残留方法研究环境基准,组织残留毒性数据的获取、分析、基准推导方法以及组织残留基准的应用等都需要系统研究。
在拟研究某化学物质的组织残留基准前,首先应当确定组织残留法应用的必要性。是否有必要推导组织残留基准最关键的是化学物质的主要暴露途径。当化学物质的主要暴露途径是食物暴露或者生物通过该暴露途径所摄取化学物质占总暴露量比例较高时,即可确定应用组织残留方法。组织残留基准推导过程主要包括数据的收集和分析、计算方法的选定和推导(图1)[38]。在环境管理需要并且有充足数据支持下也可以将组织残留基准转化为基于环境暴露浓度的基准值(水质基准或沉积物基准)或低营养级组织残留基准。
2.1 组织残留毒性数据的收集和分析
确定使用组织残留法研究化学物质的环境基准后,首先收集和整理化学物质所有相关的毒性数据和与毒性效应相关的组织残留数据。目前仅有一个较全面的关于组织残留-效应数据库可供使用,是由美国陆军工程兵团和美国环保局联合资助建立的网络数据库[72]。这个数据库包括了约12 000个数据记录,涉及了关于存活、生殖和生长等效应终点的组织残留效应信息,且每年都会更新。美国环保局之前也对组织残留效应相关文献进行了整理,主要是基于水生生物有害效应的全身组织残留数据,已经整合到该数据库[73]。美国环保局最近建立了多氯联苯残留数据库,整合了对鱼、哺乳动物和鸟类的二恶英类毒性的组织残留效应数据[74]。数据库所收集数据有限,为了保证数据的完整性和结果能够反映最新的研究成果,需要检索最新的毒理学研究文献,从中获取组织残留数据。此外,还可通过生物富集系数和相应的环境暴露毒性值(如,LC50)或者相关模型等计算得到组织残留毒性值,但是要特别关注这些值的准确性[21]。
在收集数据的同时需要考虑化学物质在环境和组织中的存在形态、作用组织、毒性效应终点、敏感生物和生命阶段、剂量-效应关系、以及组织残留毒性的影响因素[20]。通过对数据质量的分析,判断是否有足够的数据可以用于研究基准。目前关于组织残留的毒性数据较少,对于数据质量的分析主要考虑:(1)毒性试验应设置恰当的对照条件,对照组生物的反应在可接受范围;(2)毒性终点应为具有生态学相关性的生殖、发育、生长和行为异常等对种群水平有影响的效应终点;(3)研究中要有明确的组织残留剂量-效应关系;(4)研究中应给出包括试验化学物形态和试验剂量(或通过所给信息可以计算得到)的信息;(5)暴露实验是否涉及其他化学物质,或者是否使用了野外采集的水体或沉积物;(6)毒性实验的暴露途径,食物暴露是评估生物累积性物质毒性效应的最有效暴露途径;(7)毒性实验的暴露时间应足以使污染物分布于目标组织或在生物体内分布达到平衡。
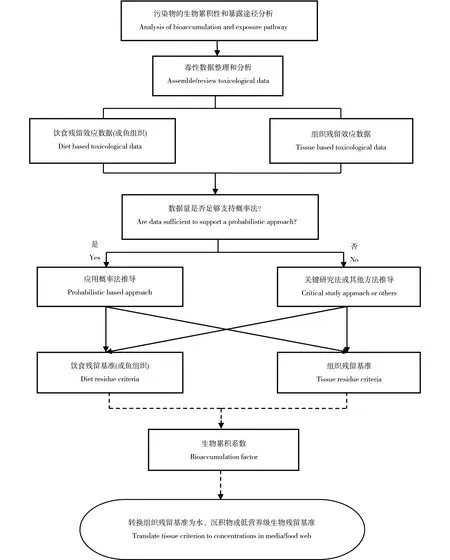
图1 组织残留基准的研究框架Fig. 1 Framework for deriving tissue residue criteria
对于暴露途径和效应终点的选择应根据具体污染物的毒性作用机制进行分析和确定。比如在TCDD的组织残留基准研究中选择了鱼卵和胚胎发育作为数据筛选的原则,而母体TCDD的吸收及向鱼卵的传递是最具生态学相关性的暴露途径[59]。但是有研究显示TCDD在鱼早期生命阶段的残留效应与暴露途径无关,因此基于母体传递、卵注射和水体暴露的毒性数据都应用到了TCDD的基准研究中。组织残留数据是基于特定组织中含量或全身残留含量,数据的选择主要依据毒性作用机制和基准在风险评价中的应用方式。在TCDD的基准研究中[59],主要应用的是早期生命阶段,且该阶段对芳香烃受体毒性最敏感,因此仅使用了基于鱼卵和胚胎中TCDD残留的毒性数据作为推导依据。
2.2 推导方法的选择
在数据满足要求的前提下,选择合适的方法推导组织残留基准。所有在水体或沉积物基准中应用的方法基本都可以用于推导组织残留基准,唯一的区别在于组织残留取代了水体或沉积物中的浓度。有几种方法可以用于推导组织残留基准,包括关键研究法(critical study approach, CSA)、平均值法(averaging method)、整合分析法(meta analysis)以及物种敏感度分布法(species sensitivity distribution, SSD)等。
2.2.1 关键研究法
关键研究法与推导水质基准时应用的评价因子法类似,即选择一个实验设计和研究方法合理明确且可以从一系列实验剂量中得出毒性阈值的关键研究作为推导组织残留基准的主要依据[75-76]。关键研究法是目前推导保护野生生物基准以及评价野生生物风险的主要方法[38,60,65,76-79]。将从关键研究中得到的毒性阈值,比如LOER或NOER除以不确定因子(uncertainty factor, UF)得到组织残留基准。推导公式为:
北美五大湖水质初始野生生物基准的技术支持文件[80]和基准文件[77]中论述了确定UF的主要依据。需要考虑3个方面的不确定性:(1)毒性敏感性的种间差异(UFA);(2)亚慢性到慢性暴露效应的外推(UFS);(3)LOER到NOER的外推(UFL)。每一个不确定系数的取值均在1到10之间,均依据对获得数据信息的专业判断得出[63,80]。
有研究应用了与关键研究法类似的简单排序法推导了甲基汞和滴滴涕的组织残留基准[17]。在该方法中,将所有毒性数据按照大小简单排序,选择低于最低有效应剂量的最高无效应剂量作为保护性的组织残留阈值。
2.2.2 平均值法
平均值法为假设采用的所有研究均具有相同的质量,且给最具代表性和最高质量研究分配相同权重计算它们的均值[75]。然而不同的研究所用物种和暴露时间等都会存在差异,将所有研究看作相同权重进行取均值存在很大的不确定性。因此,该方法在环境基准的研究中应用较少。
2.2.3 整合分析法
整合分析是一种统计方法,将几个独立的研究结果整合到一起进行统计分析[81]。Glass[82]首次提出Meta-analysis这一术语,目前该方法已在多个学科领域得到广泛应用。该方法主要包括以下几个步骤:(1)提出研究问题的假设;(2)收集和研究与问题相关的文献;(3)整理数据并分类;(4)选择合适的效应值和分析模型并进行计算;(5)将单个研究的效应值进行合并,并综合分析。在Moore等[83]的研究中,将不同研究中甲基汞对水貂慢性暴露的16个剂量-效应数据综合分析,构建了剂量-反应曲线。该方法的优势在于将同类研究结果进行定量综合分析,增大了样本量,改进和提高了统计学检验功效;减少偏差,定量估计研究效应的平均水平[84]。运行完善的整合分析可以提供比单独研究结果更加合理的效应剂量。然而,该方法对数据要求严格,要求考虑的研究均使用标准毒性测试方法,比如方法、暴露途径、暴露时间等。因为不同的研究具有不同的质量,限制了方法的使用。
2.2.4 物种敏感度分布法
物种敏感度分布法是一种概率分布函数法,可以反映生物对污染物毒性的种间差异[85],在水生态风险评价以及水生生物保护基准的推导中得到了广泛应用[11,86-88]。物种敏感度分布法的前提假设是物种敏感度符合特定统计学分布,比如正态分布[89-90]、逻辑斯蒂分布[91-92]、三角分布[11]、韦伯分布[86]或其他非参数模型[93-94]。依据分布函数计算可以保护水生生物或生态系统的基准值或毒性参考值,通常选择保护95%物种的HC5(hazard concentration for 5% of species)。该方法已经用于汞、滴滴涕和TCDD等组织残留基准的研究[17,21,59]。
2.3 组织残留基准转化为其他介质基准
通常考虑到环境管理上的需求,即环境监测和污染物排放限制等方面使用组织残留可能不适用于所有情况,因此有必要将组织残留基准转化为水质基准或食物链中低营养级生物组织残留基准。该转化过程主要是通过将组织残留基准除以特定的生物富集系数(BCF)而实现。其中,BCF可以使用所有物种的BCF值构建累积密度函数求得[21]。通常选择累积密度函数的95%分位值作为最终的BCF值。或者也可将组织残留基准与每个物种的BCF值相除得到一系列水质基准值,然后使用这些值构建累积密度函数,求其95%分位值作为最终的水质基准值[21,95]。在将组织残留基准转换为环境介质表示基准时,必须结合特定区域的生物累积信息,因为不同区域生物组成、食物结构及环境理化参数等都会对此产生影响。比如,基于性畸变效应终点三丁基锡的组织残留基准是0.32 μg·g-1,95%分位值的BCF是72 550,由此得到水质基准为4 ng·L-1,该值与美国环境保护局提出的海水慢性水质基准(7.4 ng·L-1)基本接近[21]。
对于PBT物质而言,生物的生理机能和饮食是控制生物累积量的主要因素。为了能够准确地反映生物累积信息以及保护目标生物,需要选择一些具有代表性的物种,根据这些物种的饮食结构和生理机能信息将组织残留基准转化为相应的环境基准。代表性物种的选择可以依据区域或地区的生态系统结构特征确定,以保护区域水生生物。在保护肉食性野生生物水质基准的相关研究中应用了代表物种[65,77]。确定代表性物种后分析生物对化学物的生物累积性,然后结合组织残留值推导相应的环境基准。比如,美国环境保护局在推导野生生物基准时,根据北美五大湖区野生动物的种类组成、摄食结构以及环境中的污染水平选择了3种鸟类和2种哺乳动物作为代表性物种,代表该区域通过水生食物网受到污染物暴露最大的生物[80]。
3 存在的问题和建议(Existing problems and recommendations)
组织残留剂量概念的提出以及在环境研究中的应用已经有较长时间,但是环境管理和污染物的控制还主要集中在各种环境介质(水体、土壤、沉积物大气和食物)中污染物的含量。TRA在环境基准和生态风险评价中广泛应用的一个首要限制因素是缺乏足够数量和高质量的组织残留-效应数据。传统毒性研究中较少分析组织残留是缺乏组织残留毒性效应数据的主要原因。尽管已经做了很多关于组织残留-效应数据的收集和整理工作,但是关于组织残留-效应关系的详细信息和分析还是相当缺乏,限制了对组织残留效应的深入理解和应用。对于一些严重缺乏数据的化学物质,可以将基于环境介质的毒性效应数据结合相应的生物累积系数预测组织残留-效应毒性阈值,但是这种转换关系存在很大的不确定性,需要在转化过程中考虑数据点的相关性、暴露时间、效应终点和环境条件等。因此,在今后的研究中有必要针对环境毒性数据向组织残留毒性数据转化开展相关预测模型和方法的研究,并且对传统的毒理学实验方法进行更新,加强组织残留毒性数据库。
解析环境中污染物对生物产生效应的有效暴露途径是进行毒理学实验及组织残留效应分析的关键。开展组织残留毒性效应研究,特别是针对生物累积性物质,通过食物暴露的毒性效应研究对于深入了解这类物质的组织残留效应显得尤为重要。通过组织残留效应的研究可以得到化学物质在生物体内的组织分布、作用模式、毒物代谢动力学和毒效学等数据,可以更加详细和深入地分析组织残留-效应关系,为TRA在毒理学、风险评价及环境管理中的应用提供充分的依据。
TRA在环境基准和风险评价中的应用仍处于起步阶段,如何将其结合到环境风险评价和环境管理中仍然有很多的技术问题需要深入研究。目前应用组织残留数据推导环境基准的方法主要是沿用了水质基准的研究方法,没有专门针对组织残留效应数据的推导方法,在方法的适用性方面还有不确定性。另外,需要构建更加详细和具有广泛适用性的能够将TRA结合的基准推导和风险评估框架。
在中国,对于组织残留法的研究还相对较少。中国的生态毒理学研究起始于20世纪七八十年代,在分子、细胞、组织、个体、种群、群落到生态系统等不同结构和层次上取得了丰富的经验和成果。然而,针对污染物在目标生物组织中的残留量与生物毒性效应间的相关性研究还很少[34]。环境基准的研究仍处于起步阶段,近年来针对大气、土壤、沉积物和水体等环境介质污染开展了相应的研究。组织残留法在生态毒理学和环境基准研究中的应用,将促进污染物毒性效应机理的研究,完善环境基准的管理体系。
为促进中国环境基准及组织残留基准的研究,未来应从以下几点开展工作:(1)发展和建立更加完善的生态毒理学研究方法,探索基于本地物种的毒理学试验方法,揭示化学物在生物体内的代谢、分布和残留与生物学效应的相关性。(2)开发预测模型和软件,利用现有数据预测生物的组织累积量以及组织残留效应等信息。(3)建立基于环境介质和生物组织残留的综合性毒性效应数据库,为水质基准和生态风险评价提供基础数据。(4)进一步探索组织残留法及其应用的基本理论和原理,构建可用于区域环境质量管理的环境基准理论体系和研究框架。
[1] 张瑞卿, 吴丰昌, 李会仙, 等. 中外水质基准发展趋势和存在的问题[J]. 生态学杂志, 2010, 29(10): 2049-2056
Zhang R, Wu F, Li H, et al. Water quality criteria at home and abroad: Development trend and existed problems [J]. Chinese Journal of Ecology, 2010, 29(10): 2049-2056 (in Chinese)
[2] 吴丰昌, 孟伟, 宋永会, 等. 中国湖泊水环境基准的研究进展[J]. 环境科学学报, 2008, 28(12): 2385-2393
Wu F, Meng W, Song Y, et al. Research progress in lake water quality criteria in China [J]. Acta Scientiae Circumstantiae, 2008, 28(12): 2385-2393 (in Chinese)
[3] Wu F, Meng W, Zhao X, et al. China embarking on development of its own national water quality criteria system [J]. Environmental Science & Technology, 2010, 44(21): 7992-7993
[4] 吴丰昌, 孟伟, 张瑞卿, 等. 保护淡水水生生物硝基苯水质基准研究[J]. 环境科学研究, 2011, 24(1): 1-10
Wu F, Meng W, Zhang R, et al. Aquatic life water quality criteria for nitrobenzene in freshwater [J]. Research of Environmental Sciences, 2011, 24(1): 1-10 (in Chinese)
[5] Wu F, Mu Y, Chang H, et al. Predicting water quality criteria for protecting aquatic life from physicochemical properties of metals or metalloids [J]. Environmental Science & Technology, 2012, 47(1): 446-453
[6] Jin X, Zha J, Xu Y, et al. Derivation of aquatic predicted no-effect concentration (PNEC) for 2, 4-dichlorophenol: Comparing native species data with non-native species data [J]. Chemosphere, 2011, 84(10): 1506-1511
[7] Xing L, Liu H, Zhang X, et al. A comparison of statistical methods for deriving freshwater quality criteria for the protection of aquatic organisms [J]. Environmental Science and Pollution Research, 2014, 21(1): 159-167
[8] 孟伟, 刘征涛, 张楠, 等. 流域水质目标管理技术研究(Ⅱ)——水环境基准、标准与总量控制[J]. 环境科学研究, 2008, 21(1): 1-8
Meng W, Liu Z, Zhang N, et al. The study on technique of basin water quality target management Ⅱ: Water environmental criteria, standard and total amount control [J]. Research of Environmental Sciences, 2008, 21(1): 1-8 (in Chinese)
[9] USEPA. National recommended water quality criteria [R]. Washington DC: Office of Water, Office of Science and Technology, 2009
[10] 张瑞卿, 吴丰昌, 李会仙, 等. 应用物种敏感度分布法研究中国无机汞的水生生物水质基准[J]. 环境科学学报, 2012, 32(2): 440-449
Zhang R, Wu F, Li H, et al. Deriving aquatic water quality criteria for inorganic mercury in China by species sensitivity distributions [J]. Acta Scientiae Circumstantiae, 2012, 32(2): 440-449 (in Chinese)
[11] Stephan C E, Mount D I, Hansen D J, et al. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses [R]. Washington D C: USEPA, 1985
[12] Schuler L J, Rand G M. Aquatic risk assessment of herbicides in freshwater ecosystems of South Florida [J]. Archives of Environmental Contamination and Toxicology, 2008, 54(4): 571-583
[13] Meador J P, McCarty L S, Escher B I, et al. 10th anniversary critical review: The tissue-residue approach for toxicity assessment: Concepts, issues, application, and recommendations [J]. Journal of Environmental Monitoring, 2008, 10(12): 1486-1498
[14] Guruge K S, Tanabe S, Iwata H, et al. Distribution, biomagnification, and elimination of butyltin compound residues in common cormorants (Phalacrocorax carbo) from Lake Biwa, Japan [J]. Archives of Environmental Contamination and Toxicology, 1996, 31(2): 210-217
[15] Wang S, Li B, Zhang M, et al. Bioaccumulation and trophic transfer of mercury in a food web from a large, shallow, hypereutrophic lake (Lake Taihu) in China [J]. Environmental Science and Pollution Research, 2012, 19(7): 2820-2831
[16] Hu G, Dai J, Xu Z, et al. Bioaccumulation behavior of polybrominated diphenyl ethers (PBDEs) in the freshwater food chain of Baiyangdian Lake, North China [J]. Environment International, 2010, 36(4): 309-315
[17] Beckvar N, Dillon T M, Read L B. Approaches for linking whole-body fish tissue residues of mercury or DDT to biological effects thresholds [J]. Environmental Toxicology and Chemistry, 2005, 24(8): 2094-2105
[18] Meador J P, Collier T K, Stein J E. Determination of a tissue and sediment threshold for tributyltin to protect prey species of juvenile salmonids listed under the US Endangered Species Act [J]. Aquatic Conservation: Marine and Freshwater Ecosystems, 2002, 12(5): 539-551
[19] USEPA. Draft aquatic life water quality criteria for selenium - 2004. EPA-822-D-04-001 [R]. Washington DC: USEPA, Ofice of Water, 2004
[20] Sappington K G, Bridges T S, Bradbury S P, et al. Application of the tissue residue approach in ecological risk assessment [J]. Integrated Environmental Assessment and Management, 2011, 7(1): 116-140
[21] Meador J. Rationale and procedures for using the tissue-residue approach for toxicity assessment and determination of tissue, water, and sediment quality guidelines for aquatic organisms [J]. Human and Ecological Risk Assessment: An International Journal, 2006, 12(6): 1018-1073
[22] McElroy A E, Barron M G, Beckvar N, et al. A review of the tissue residue approach for organic and organometallic compounds in aquatic organisms [J]. Integrated Environmental Assessment and Management, 2011, 7(1): 50-74
[23] McCarty L S. The relationship between aquatic toxicity QSARs and bioconcentration for some organic chemicals [J]. Environmental Toxicology and Chemistry, 1986, 5(12): 1071-1080
[24] McCarty L S, Dixon D G, MacKay D, et al. Residue-based interpretation of toxicity and bioconcentration QSARs from aquatic bioassays: Neutral narcotic organics [J]. Environmental Toxicology and Chemistry, 1992, 11(7): 917-930
[25] Meador J P, Krone C A, Dyer D W, et al. Toxicity of sediment-associated tributyltin to infaunal invertebrates: Species comparison and the role of organic carbon [J]. Marine Environmental Research, 1997, 43(3): 219-241
[26] Penttinen S, Malk V, Väisänen A, et al. Using the critical body residue approach to determine the acute toxicity of cadmium at varying levels of water hardness and dissolved organic carbon concentrations [J]. Ecotoxicology and Environmental Safety, 2011, 74(5): 1151-1155
[27] Borgmann U, Norwood W P, Babirad I M. Relationship between chronic toxicity and bioaccumulation of cadmium in Hyalella azteca[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1991, 48(6): 1055-1060
[28] Meyer J S, Boese C J, Collyard S A. Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 133(1 2): 99-109
[29] Rosen G, Rivera-Duarte I, Bart Chadwick D, et al. Critical tissue copper residues for marine bivalve (Mytilus galloprovincialis) and echinoderm (Strongylocentrotus purpuratus) embryonic development: Conceptual, regulatory and environmental implications [J]. Marine Environmental Research, 2008, 66(3): 327-336
[30] Schwarzenbach R P, Escher B I, Fenner K, et al. The challenge of micropollutants in aquatic systems [J]. Science, 2006, 313(5790): 1072-1077
[31] Ostrach D J, Low-Marchelli J M, Eder K J, et al. Maternal transfer of xenobiotics and effects on larval striped bass in the San Francisco estuary [J]. Proceedings of the National Academy of Sciences, 2008, 105(49): 19354-19359
[32] Miranda A L, Roche H, Randi M A F, et al. Bioaccumulation of chlorinated pesticides and PCBs in the tropical freshwater fish Hoplias malabaricus: Histopathological, physiological, and immunological findings [J]. Environment International, 2008, 34(7): 939-949
[33] Bussolaro D, Filipak Neto F, Glinski A, et al. Bioaccumulation and related effects of PCBs and organochlorinated pesticides in freshwater fish Hypostomus commersoni[J]. Journal of Environmental Monitoring, 2012, 14(8): 2154-2163
[34] Hu J, Zhang Z, Wei Q, et al. Malformations of the endangered Chinese sturgeon, Acipenser sinensis, and its causal agent [J]. Proceedings of the National Academy of Sciences, 2009, 106(23): 9339-9344
[35] Okoumassoun L E, Brochu C, Deblois C, et al. Vitellogenin in tilapia male fishes exposed to organochlorine pesticides in Ouémé River in Republic of Benin [J]. Science of the Total Environment, 2002, 299(1): 163-172
[36] Hook S E, Fisher N S. Relating the reproductive toxicity of five ingested metals in calanoid copepods with sulfur affinity [J]. Marine Environmental Research, 2002, 53(2): 161-174
[37] Evens R, De Schamphelaere K A C, De Samber B, et al. Waterborne versus dietary zinc accumulation and toxicity in Daphnia magna: A synchrotron radiation based X-ray fluorescence imaging approach [J]. Environmental Science & Technology, 2011, 46(2): 1178-1184
[38] USEPA. Science advisory board consultation document. Proposed revisions to aquatic life guidelines: Tissue-based criteria for "bioaccumulative” chemicals [R]. Washington DC: USEPA, Office of Water, 2005
[39] Munger C, Hare L. Relative importance of water and food as cadmium sources to an aquatic insect (Chaoborus punctipennis): Implications for predicting Cd bioaccumulation in nature [J]. Environmental Science & Technology, 1997, 31(3): 891-895
[40] Hamilton S J. Review of selenium toxicity in the aquatic food chain [J]. Science of the Total Environment, 2004, 326(1): 1-31
[41] Hall B D, Bodaly R A, Fudge R J P, et al. Food as the dominant pathway of methylmercury uptake by fish [J]. Water, Air, and Soil Pollution, 1997, 100(1-2): 13-24
[42] Tsui M T K, Wang W X. Uptake and elimination routes of inorganic mercury and methylmercury in Daphnia magna [J]. Environmental Science & Technology, 2003, 38(3): 808-816
[43] Hare L, Tessier A, Borgmann U. Metal sources for freshwater invertebrates: Pertinence for risk assessment [J]. Human and Ecological Risk Assessment: An International Journal, 2003, 9(4): 779-793
[44] Rubinstein N I, Gilliam W T, Gregory N R. Dietary accumulation of PCBs from a contaminated sediment source by a demersal fish (Leiostomus xanthurus) [J]. Aquatic Toxicology, 1984, 5(4): 331-342
[45] McCarty L S, Landrum P F, Luoma S N, et al. Advancing environmental toxicology through chemical dosimetry: External exposures versus tissue residues [J]. Integrated Environmental Assessment and Management, 2011, 7(1): 7-27
[46] Adams W J, Blust R, Borgmann U, et al. Utility of tissue residues for predicting effects of metals on aquatic organisms [J]. Integrated Environmental Assessment and Management, 2011, 7(1): 75-98
[47] USEPA. EPA Science Advisory Board (SAB) consultation on a proposed framework for revising the guidelines for deriving water quality criteria for protection of aquatic life. EPA-SAB-CON-06-004 [R]. Washington DC: USEPA, Office of the Administrator, Science Advisory Board, 2006
[48] Brix K, DeForest D, Fairbrother A, et al. Critical review of tissue-based selenium toxicity thresholds for fish and birds [C]//Planning for End Land Use in Mine Reclamation. Proceedings of the 24th Annual British Columbia Reclamation Symposium. Williams Lake BC: BC Technical and Research Committee on Reclamation, 2000: 220-230
[49] Chapman P M. Selenium thresholds for fish from cold freshwaters [J]. Human and Ecological Risk Assessment, 2007, 13(1): 20-24
[50] DeForest D K, Brix K V, Adams W J. Critical review of proposed residue-based selenium toxicity thresholds for freshwater fish [J]. Human and Ecological Risk Assessment: An International Journal, 1999, 5(6): 1187-1228
[51] DeForest D K, Gilron G, Armstrong S A, et al. Species sensitivity distribution evaluation for selenium in fish eggs: Considerations for development of a Canadian tissue‐based guideline [J]. Integrated Environmental Assessment and Management, 2012, 8(1): 6-12
[52] Hamilton S J. Rationale for a tissue-based selenium criterion for aquatic life [J]. Aquatic Toxicology, 2002, 57(1): 85-100
[53] Hamilton S J. Review of residue-based selenium toxicity thresholds for freshwater fish [J]. Ecotoxicology and Environmental Safety, 2003, 56(2): 201-210
[54] Lemly A D. Guidelines for evaluating selenium data from aquatic monitoring and assessment studies [J]. Environmental Monitoring and Assessment, 1993, 28(1): 83-100
[55] Di Toro D M, McGrath J A. Technical basis for narcotic chemicals and polycyclic aromatic hydrocarbon criteria. Ⅱ. Mixtures and sediments [J]. Environmental Toxicology and Chemistry, 2009, 19(8): 1971-1982
[56] Di Toro D M, McGrath J A, Hansen D J. Technical basis for narcotic chemicals and polycyclic aromatic hydrocarbon criteria. I. Water and tissue [J]. Environmental Toxicology and Chemistry, 2009, 19(8): 1951-1970
[57] Meador J P, Collier T K, Stein J E. Use of tissue and sediment‐based threshold concentrations of polychlorinated biphenyls (PCBs) to protect juvenile salmonids listed under the US Endangered Species Act [J]. Aquatic Conservation: Marine and Freshwater Ecosystems, 2002, 12(5): 493-516
[58] Schmidt T S, Clements W H, Zuellig R E, et al. Critical tissue residue approach linking accumulated metals in aquatic insects to population and community-level effects [J]. Environmental Science & Technology, 2011, 45(16): 7004-7010
[59] Steevens J A, Reiss M R, Pawlisz A V. A methodology for deriving tissue residue benchmarks for aquatic biota: A case study for fish exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin and equivalents [J]. Integrated Environmental Assessment and Management, 2005, 1(2): 142-151
[60] CCME. Protocol for derivation of Canadian tissue residue guidelines for the protection of wildlife that consume aquatic biota [R]. Winnipeg: Canadian Council of Ministers of the Environment, 1998
[61] CCME. Canadian tissue residue guidelines for the protection of wildlife that consumers of aquatic biota: Methylmercury [R]. Winnipeg: Canadian Council of Ministers of the Environment, 2000
[62] CCME. Canadian tissue residue guidelines for the protection of wildlife consumers of aquatic biota: Summary table [R]. Winnipeg: Canadian Council of Ministers of the Environment, 2001
[63] Newsted J L, Jones P D, Coady K, et al. Avian toxicity reference values for perfluorooctane sulfonate [J]. Environmental Science & Technology, 2005, 39(23): 9357-9362
[64] Buekers J, Steen Redeker E, Smolders E. Lead toxicity to wildlife: Derivation of a critical blood concentration for wildlife monitoring based on literature data [J]. Science of the Total Environment, 2009, 407(11): 3431-3438
[65] Zhang R, Wu F, Li H, et al. Toxicity reference values and tissue residue criteria for protecting avian wildlife exposed to methylmercury in China [J]. Reviews of Environmental Contamination and Toxicology, 2013, 223: 53-80
[66] Zhang R, Guo J, Wu F, et al. Toxicity reference values for polybrominated diphenyl ethers: Risk assessment for predatory birds and mammals from two Chinese lakes [J]. Reviews of Environmental Contamination and Toxicology, 2014, 229: 111-137
[67] USEPA. Record of decision: Harbor island superfund site [R]. Seattle, WA: USEPA, 2003
[68] USEPA. White paper on methods for assessing ecological risks of pesticides with persistent, bioaccumulative and toxic characteristics [R]. Washington DC: USEPA, Office of Prevention, Pesticides and Toxic Substances, Office of Pesticide Programs, 2008
[69] Leonards P E, van Hattum B, Leslie H. Assessing the risks of persistent organic pollutants to top predators: A review of approaches [J]. Integrated Environmental Assessment and Management, 2008, 4(4): 386-398
[70] Schaefer J K, Yagi J, Reinfelder J R, et al. Role of the bacterial organomercury lyase (MerB) in controlling methylmercury accumulation in mercury-contaminated natural waters [J]. Environmental Science & Technology, 2004, 38(16): 4304-4311
[71] Kannan K, Smith R G Jr, Lee R F, et al. Distribution of total mercury and methyl mercury in water, sediment, and fish from South Florida estuaries [J]. Archives of Environmental Contamination and Toxicology, 1998, 34(2): 109-118
[72] Bridges T S, Lutz C H. Interpreting bioaccumulation data with the environmental residue-effects database [R]. Vicksburg, Mississippi: Army Engineer Waterways Experiment Station, 1999
[73] Jarvinen A W, Ankley G T. Linkage of effects to tissue residues: Development of a comprehensive database for aquatic organisms exposed to inorganic and organic chemicals [M]. Pensacola, FL: SETAC Press, 1999: 1-358
[74] USEPA, PCBRes (PCB residue effects) database [DB]. (2009-2-10) [2014-5-20]. http://www.epa.gov/medProds_Pubs/pcbres.htm, 2008
[75] Blankenship A L, Kay D P, Zwiernik M J, et al. Toxicity reference values for mink exposed to 2,3,7,8-tetrachlodibenzo-p-dioxin (TCDD) equivalents (TEQs) [J]. Ecotoxicology and Environmental Safety, 2008, 69(3): 325-349
[76] USEPA. Attachment 4-5 guidance for developing ecological soil screening levels (ECO-SSLs), ECO-SSL standard operating procedure (SOP) # 6: Derivation of wildlife toxicity reference value (TRV). Owser Directive 9285.7-55 [R]. Washington DC: USEPA, 2003
[77] USEPA. Great lakes water quality initiative criteria documents for the protection of wildlife [R]. Washington DC: USEPA, Office of Water, 1995
[78] USEPA. Final water quality guidance for the great lakes [R]. Washington DC: USEPA, 1995
[79] Sample B, Opresko D, Suter D. Toxicological benchmarks for wildlife: 1996 revision [R]. Oak Ridge, Tennessee: ORNL Oak Ridge National Laboratory (US), 1993
[80] USEPA. Great lakes water quality initiative technical support document for wildlife criteria [R]. Washington DC: USEPA, Office of Water, 1995
[81] Egger M, Smith G D, Phillips A N. Meta-analysis: Principles and procedures [J]. BMJ, 1997, 315(7121): 1533-1537
[82] Glass G V. Primary, secondary, and meta-analysis of research [J]. Educational Researcher, 1976, 5(10): 3-8
[83] Moore D R, Teed R S, Richardson G M. Derivation of an ambient water quality criterion for mercury: Taking account of site‐specific conditions [J]. Environmental Toxicology and Chemistry, 2003, 22(12): 3069-3080
[84] 雷相东, 彭长辉, 田大伦, 等. 整合分析(meta-analysis)方法及其在全球变化中的应用研究 [J]. 科学通报, 2006, 51(22): 2587-2597
Lei X, Peng C, Tian D, et al. Meta-analysis and its application in global change research [J]. Chinese Science Bulletin, 2006, 51(22): 2587-2597 (in Chinese)
[85] Posthuma L, Suter G W, Traas T P. Species Sensitivity Distributions in Ecotoxicology [M]. Boca Raton, USA: CRC Press LLC, 2002: 624
[86] Caldwell D J, Mastrocco F, Hutchinson T H, et al. Derivation of an aquatic predicted no-effect concentration for the synthetic hormone, 17α-ethinyl estradiol [J]. Environmental Science & Technology, 2008, 42(19): 7046-7054
[87] Hall L W, Scott M C, Killen W D. Ecological risk assessment of copper and cadmium in surface waters of Chesapeake Bay watershed [J]. Environmental Toxicology and Chemistry, 1998, 17(6): 1172-1189
[88] Solomon K R, Baker D B, Richards R P, et al. Ecological risk assessment of atrazine in North American surface waters [J]. Environmental Toxicology and Chemistry, 1996, 15(1): 31-76
[89] Wagner C, Løkke H. Estimation of ecotoxicological protection levels from NOEC toxicity data [J]. Water Research, 1991, 25(10): 1237-1242
[90] Aldenberg T, Jaworska J S. Uncertainty of the hazardous concentration and fraction affected for normal species sensitivity distributions [J]. Ecotoxicology and Environmental Safety, 2000, 46(1): 1-18
[91] Kooijman S A L M. A safety factor for LC50values allowing for differences in sensitivity among species [J]. Water Research, 1987, 21(3): 269-276
[92] Aldenberg T, Slob W. Confidence limits for hazardous concentrations based on logistically distributed NOEC toxicity data [J]. Ecotoxicology and Environmental Safety, 1993, 25(1): 48-63
[93] Ling C. A conservative, nonparametric estimator for the 5th percentile of the species sensitivity distributions [J]. Journal of Statistical Planning and Inference, 2004, 123(2): 243-258
[94] Newman M C, Ownby D R, Mézin L C A, et al. Applying species-sensitivity distributions in ecological risk assessment: Assumptions of distribution type and sufficient numbers of species [J]. Environmental Toxicology and Chemistry, 2000, 19(2): 508-515
[95] Traas T P, van Wezel A P, Hermens J L M, et al. Environmental quality criteria for organic chemicals predicted from internal effect concentrations and a food web model [J]. Environmental Toxicology and Chemistry, 2004, 23(10): 2518-2527
◆
Application of Tissue Residue Approach in Aquatic Life Criteria
Zhang Ruiqing1, Wu Fengchang2,*
1.College of Environment and Resources, Inner Mongolia University, Huhhot 010021, China 2.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China
3 June 2014 accepted 21 August 2014
Aquatic life criteria have been significant basis for ecological risk assessment and water environmental management, playing an important role in treatment, control and management of water pollution. The toxicity thresholds and environmental criteria based on concentration of chemical in water or sediment are always influenced by environmental and biological parameters, resulting in uncertainty and variability. However, tissue-based toxicity dose metrics can reduce the uncertainty and variability, and have distinct advantages in toxicity effects and environmental criteria of chemicals, especially ofthe bioaccumulative chemicals. This article deals with the applications of tissue residue approach in derivation of aquatic life criteria, and gives a detailed review on the concept, advantage, application of tissue residue approach, and methodologies for deriving tissue residue criteria. The application issues of tissue residue approach and recommendations are suggested. This will promote the research of theories and methodologies of environmental criteria and ecological risk assessment, and provide technical support to control and management of water pollution.
aquatic life; environmental criteria; ecological risk assessment; tissue residue approach
国家自然科学基金(41130743; 41261140337; 41322025);内蒙古大学高层次人才引进科研启动项目(135139);内蒙古自治区自然科学基金(2014BS0402)
张瑞卿(1984-),男,博士,研究方向为环境地球化学及环境基准研究,E-mail: zruiqing2007@126.com;
*通讯作者(Corresponding author),E-mail: wufengchang@vip.skleg.cn
10.7524/AJE.1673-5897.20140603001
2014-06-03 录用日期:2014-08-21
1673-5897(2015)1-088-13
X171.5
A
吴丰昌(1965—),男,研究员,博士生导师,主要研究湖泊污染机理与过程、水质基准和风险评估。
张瑞卿, 吴丰昌. 组织残留法在水生生物基准中的应用概述[J]. 生态毒理学报, 2015, 10(1): 88-100
Zhang R Q, Wu F C. Application of tissue residue approach in aquatic life criteria [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 88-100(in Chinese)
