一种来源于Brachybacterium sp. DB5的α-半乳糖苷酶克隆及性质研究
2015-06-24刘小丹董继胜姬铁强杨培龙
刘小丹, 董继胜, 姬铁强, 杨培龙
1.黑龙江迪龙制药有限公司, 黑龙江 安达 151400;
2.中国农业科学院饲料研究所, 农业部饲料生物技术重点实验室, 北京 100081
一种来源于Brachybacteriumsp. DB5的α-半乳糖苷酶克隆及性质研究
刘小丹1,2, 董继胜1, 姬铁强1, 杨培龙2*
1.黑龙江迪龙制药有限公司, 黑龙江 安达 151400;
2.中国农业科学院饲料研究所, 农业部饲料生物技术重点实验室, 北京 100081
α-半乳糖苷酶是一种有着巨大商业价值的工业酶制剂,在医药、食品和化工等行业有着广泛的应用。以来源于雪莲根部土壤的短状杆菌Brachybacteriumsp. DB5为材料,从其基因组中扩增出一个α-半乳糖苷酶基因编码序列,经过测序及BLAST比对分析,证实该基因属于α-半乳糖苷酶。将其与pET-30a(+)载体相连后在大肠杆菌中进行异源表达,经过诱导获得了此酶的胞外高效表达,粗酶液的活性为5.07 U/mL,经纯化后酶的活性达72.78 U/mL,酶学特性分析表明其最适pH为6.0,最适温度为40℃。此酶可用作动物饲料豆粕的添加剂,以提高饲料的利用率。
α-半乳糖苷酶;短状杆菌;基因克隆;表达;性质
α-半乳糖苷酶(α-galactosidase,EC3.2.1.22)是一种外切糖苷酶,在动植物、人和微生物体内广泛存在。它可以专一性水解催化多种寡糖、糖脂等非还原性糖链末端的α-半乳糖残基,其中包括人B型血抗原[1]。
通常,在豆类饲料中(如大豆籽实和豆粕中)添加α-半乳糖苷酶,可以减少动物胃肠胀气,提高饲料的利用率[2]。另外,α-半乳糖苷酶在医药、食品和化工行业中也有广泛的应用[3]。在医药行业,α-半乳糖苷酶可用以治疗Fabry疾病[4]。微生物来源的α-半乳糖苷酶具有易控制、高产、价廉等优点,是近年来国内外研究的热点。目前,在多种微生物中都克隆到了α-半乳糖苷酶基因,并已经实现了重组基因的高效表达[5]。
本研究通过对α-半乳糖苷酶核苷酸序列的比较,设计了一对简并引物,利用PCR技术,建立了一种快速筛选α-半乳糖苷酶编码基因的方法。并在原核系统进行表达且对表达产物的酶学性质进行了初步研究,为进一步通过蛋白质定向改造该酶的最适pH、作用温度及酶活性,构建高产α-半乳糖苷酶的基因工程菌株打下坚实基础,以便其产业化推广应用。
1 材料与方法
1.1 材料
短状杆菌(Brachybacteriumsp. DB5)、大肠杆菌(Escherichia.coli)BL21(DE3)、大肠杆菌(E.coli)TOP10、pET-30a(+)载体均为中国农业科学院饲料研究所杨培龙课题组保存或构建[6]。pEASY-T3购自全式金公司。各种限制性内切酶、连接酶和Taq酶购自TaKaRa公司。蜜二糖、棉子糖、水苏糖购自Sigma公司。其余为国产分析纯。引物合成和测序由北京三博远志公司完成。
1.2 方法
1.2.1 α-半乳糖苷酶基因片段的克隆
提取短状杆菌菌株DB5的基因组DNA[7]。根据已分离的α-半乳糖苷酶基因保守区域特点,设计特异性引物:RP4:5′-GAYGAYGGNTGGTTYGGN-3′;RPr8:5′-GACCATYTCNGGYTCNA-MCC-3′。采用TD-PCR程序[8],扩增基因片段并测序。基因组DNA作为模板进行扩增,体系(50 μL)为:10×Buffer (Mg2+)5 μL,2.5 mmol/L dNTP mix 4 μL,5 U/μLTaqDNA聚合酶0.5 μL,100 μmol/L上、下游引物(上游特异性引物RP4和下游引物RPr8)各1.5 μL, 模板DNA(50 ng/μL)1 μL,ddH2O 36.5 μL。TD-PCR扩增条件:94℃预变性4 min;94℃ 25 min,58~48℃ 25 s,72℃ 1 min,10个循环;然后进入第二个循环程序:94℃ 25 min,48℃ 25 s,72℃ 1 min,20个循环;72℃ 5 min。
1.2.2 α-半乳糖苷酶TAIL-PCR扩增基因全长 根据DB5已获得的α-半乳糖苷酶基因片段,采用Tail-PCR方法获得基因全长[9],所设计的特异引物见表1。所获得的基因命名为aga-DB5。
1.2.3aga-DB5与表达载体pET-30a(+)连接 插入的基因位点采用EcoRⅠ和NotⅠ酶切位点,表达引物为:DB5gaU:5′-CAGGAATTCGTGACCGCGCCCCGGCC-3′(划线为EcoRⅠ位点);DB5gaD:5′-ATAGCGGCCGCTCAGGAGATCGCC-GCAGAGCTG-3′(划线为NotⅠ位点)。将aga-DB5基因克隆到表达载体中,经测序表明克隆正确,与读码框相符,预测蛋白被准确表达。把该重组酶命名为aga-DB5-H。PCR再扩增反应体系(50 μL)为:10×Buffer 5 μL, 2.5 mmol/L dNTP mix 4 μL, 2.5 U/μLTaqDNA聚合酶0.5 μL,20 μmol/L上、下游引物各1 μL,DB5基因组模板(10 ng/μL)1 μL,ddH2O 37.5 μL。反应条件为:95℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 3.5 min,35个循环;72℃延伸10 min。

表1 Tail-PCR引物
1.2.4 重组酶aga-DB5-H的诱导表达和纯化 挑取转化后的阳性菌按常规方法进行摇瓶培养, 当OD600为0.6时,加IPTG使其终浓度为1 mmol/L诱导表达。在12 h取样,粗测酶活为胞外表达,通过膜包和超滤浓缩菌液。利用重组酶融合的6his-tag标签,选择镍柱纯化为纯蛋白。
1.2.5 重组酶aga-DB5-H的SDS-PAGE分析 取1 mL酶液,加入等体积的2×SDS上样缓冲液100℃煮5 min, 取15 μL用于10%的聚丙烯酰胺凝胶电泳。
1.2.6 pH和温度对重组酶aga-DB5-H的影响 酶活性测定方法采用pNPG法[10]。在37℃,pH 2.0~11.0的条件下,经纯化的重组酶aga-DB5-H进行酶促反应以测定其最适pH,缓冲液为pH 2.0~8.0的0.1 mol/L McIlvaine缓冲液和pH 9.0~11.0的0.1 mol/L甘氨酸-NaOH缓冲液。再将酶液于37℃,pH 2.0~11.0的缓冲液中处理30 min,测定其酶活并研究酶的pH稳定性。最适温度的测定为在最适pH的条件下,温度为0~70℃下进行酶促反应。温度稳定性测定是在不同温度下处理30 min,再进行酶活测定。然后绘制最适曲线。
1.2.7 化学试剂或离子对重组酶aga-DB5-H的影响 在不同的金属离子或化学试剂的酶促反应体系中,使加入物质的终浓度为1 mmol/L或5 mmol/L,在37℃、pH 6.0下,保温30 min,以空白作为对照,研究不同物质对酶活性的影响[11]。
2 结果与分析
2.1 α-半乳糖苷酶基因序列分析
测序结果表明,来源于短状杆菌Brachybacteriumsp. DB5的α-半乳糖苷酶基因,全长2 271 bp,编码756个氨基酸和一个终止密码子。其与基因组测序的BrachybacteriumfaeciumDSM 4810来源的α-半乳糖苷酶基因最高序列相似性为81%。将重组酶命名为aga-DB5-H,其理论分子量为82 kDa。通过BLAST比对,酶蛋白与BrachybacteriumfaeciumDSM 4810的α-半乳糖苷酶 (Genbank accession No.: WP012804378 )存在最高的相似性为77.%。证实其为一种新的GH36家族α-半乳糖苷酶。
2.2 表达产物SDS-PAGE分析
基因转化到大肠杆菌后,诱导表达,其粗酶液的表达效价可达5.07 U/mL,经过镍柱纯化后,纯酶的比活为72.78 U/mL。重组酶经SDS-PAGE得到单一条带,由图1可知,分子量约为82 kDa,与预测分子量相近。蛋白条带经LC-ESI-MS/MS二级质谱分析,结果显示其中3段内肽,F1:RDDTTGLGDW,F2:VSVVLDVTDGR,F3:FRAASAVFG,与蛋白推测序列一致,表明a-半乳糖苷酶基因有效表达。
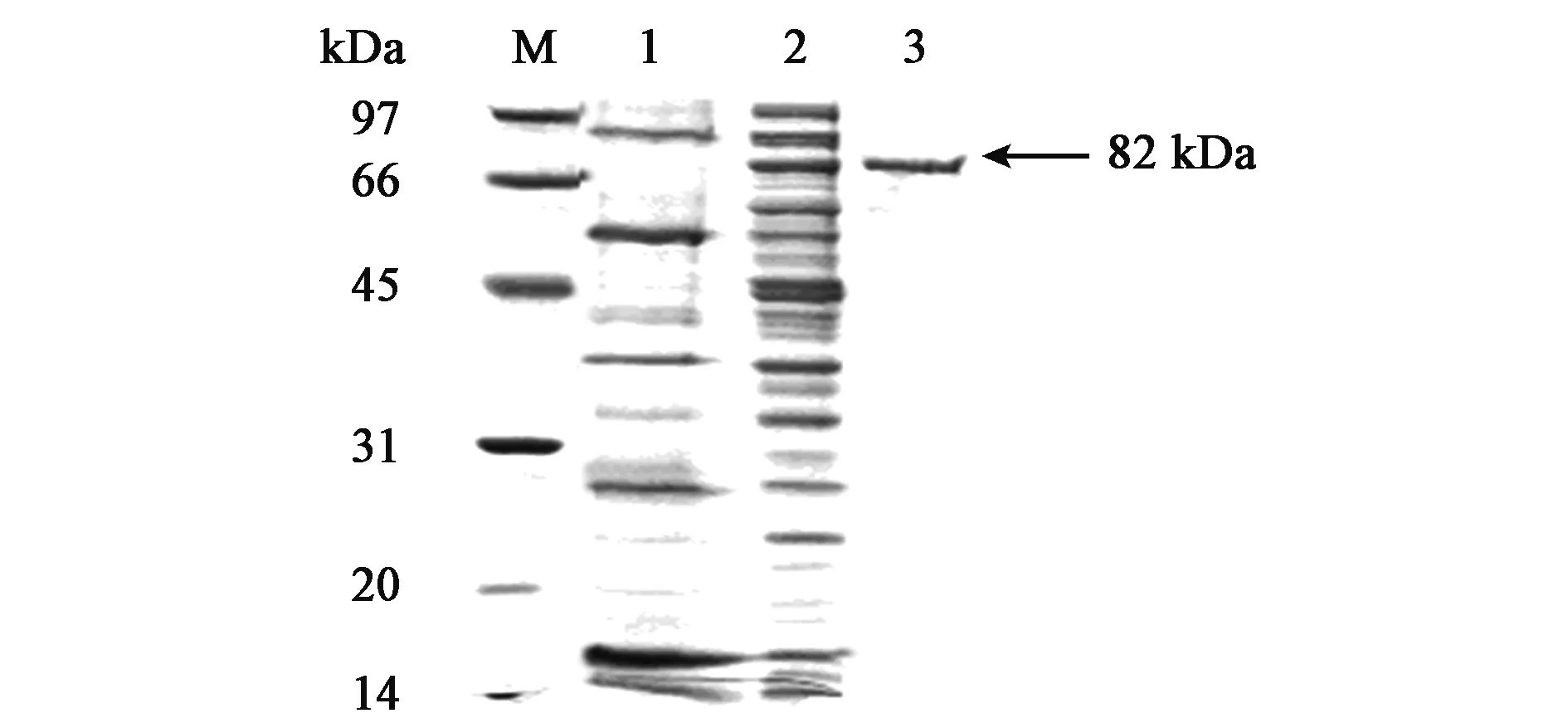
图1 重组酶aga-DB5-H的SDS-PAGE分析Fig.1 SDS-PAGE analysis of recombinant aga-DB5-H.
2.3 pH和温度对α-半乳糖苷酶的影响
最适pH、pH稳定性、最适作用温度及热稳定性结果见图2。由图2A可知,该酶的最适作用pH为6.0, pH 3以下和pH 9以上没有检测到酶活;在pH 5.0~10.0的范围内aga-DB5-H能有75%以上的酶活(图2B),证明其pH稳定性良好。由图2C可知,aga-DB5-H的最适作用温度为40℃,在40℃下处理5min酶活基本不变,处理30 min后还能保持75%以上的活性(图2D)。50℃处理酶活逐渐下降,但总的说来耐热性较好。
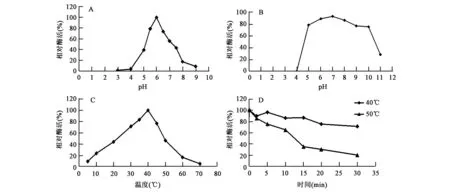
图2 pH和温度对重组酶aga-DB5-H活性的影响Fig.2 Effect of pH and temperature on activity of recombinant aga-DB5-H.
2.4 金属离子及化学试剂对重组酶aga-DB5-H的影响
不同浓度的金属离子及化学试剂对重组酶aga-DB5-H酶活的影响结果见表2。从表2中可以看出,金属离子或化学试剂浓度为1mmol/L时,除Ag+、Hg2+和阴性表面活性剂SDS完全抑制aga-DB5-H的酶活外,aga-DB5-H在大部分金属离子和化学试剂中都表现出较好的酶活性。随着溶液浓度的升高,只有EDTA和Pb2+对酶活有不同程度的促进作用,而其他离子和化学试剂在高浓度下则对酶活有不同程度的抑制作用。
2.5 底物降解能力
Aga-DB5-H酶对天然底物的降解能力结果如表3所示,研究发现随着单位酶的增加降解能力增强,蜜二糖在3个单位酶的作用下能够完全降解,其最适底物为蜜二糖。对棉子糖和水苏糖都有一定的水解能力。降解水苏糖的能力比棉籽糖强。因此,分解天然底物的能力为蜜二糖>水苏糖 >棉子糖。
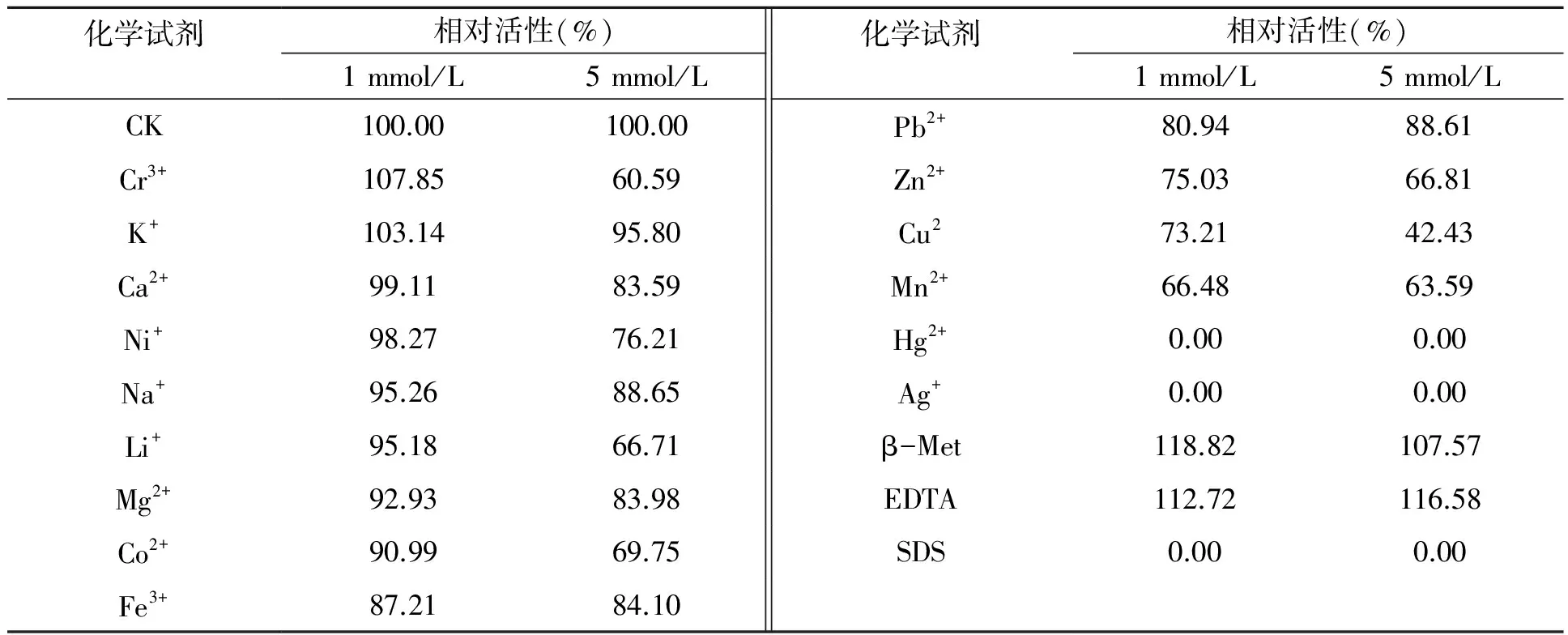
表2 金属离子及相关化学试剂对重组酶aga-DB5-H的影响

表3 Aga-DB5-H对不同底物的降解能力
3 讨论
本研究以PCR的方法成功获得了来源于短状杆菌属微生物的α-半乳糖苷酶基因aga-DB5,并成功地将aga-DB5克隆到pET-30a(+)质粒中,实现了异源高效表达。重组菌经IPTG诱导6 h后的菌液α-半乳糖苷酶活力达到5.07 U/mL,经纯化后酶的活性为72.78 U/mL,提高了13倍。动物饲料豆粕中含有棉籽糖和水苏糖,棉子糖和水苏糖是含 α-半乳糖苷的主要抗营养因子[12],该酶对天然底物蜜二糖、棉子糖和水苏糖均有降解能力。因此,该酶为一种全新的可以在豆粕中添加的α-半乳糖苷酶,可以提高饲料的利用率,节约养殖成本,增加养殖业的效益。据报道重组α-半乳糖苷酶可有效地将B型红细胞改造成O型红细胞,并且酶解过程是在pH 5~6的情况下进行的,酶解前后都需要改变pH[13],重组酶aga-DB5-H的最适作用pH为6.0,最稳定的pH范围为5.0~10.0,能保持75%以上的酶活,特别适合将B型红细胞改造成O型红细胞。此酶为B-O血型改造提供了更有效的工具酶。综上可以看出,该重组酶在饲料和医药行业上都有广泛的应用,值得商业开发和利用。
[1] Rowinsky E K, Cazenave L A, Donehower R C. Taxol: a novel investigational antimicrotubule agent [J]. J. Natl. Can. Inst., 1990, 82(15):1247-1259.
[2] Igbasan F A, Guenter W, Slominski B A. The effect of pectinase and a-galactosidase supplementation on the nutritive value of peas for broiler chickens[J]. Can. J. Anim. Sci., 1997,77: 537-539.
[3] Prashanth S J, Mulimani V H. Soymilk oligosaccharide hydrolysis byAspergillusoryzaeα-galactosidase immobilized in calcium alginate[J]. Proc. Biochem., 2005, 40:1199-1205.
[4] Buja L M. Evaluation of recombinant α-galactosidase a therapy for amelioration of the cardiovascular manifestations of Fabry disease: an important role for endomyocardial biopsy [J]. Circulation, 2009, 119: 2539-2541.
[5] Kayastha N S A M. A novel application of Cicer α-galactosidase in reduction of raffinose family oligosaccharides in soybean flour[J]. Plant Biochem. Biotechnol., 2012, doi:10:1007/s13562-012-0173-7.
[6] 刘小丹. 来源于Pedobactersp. MJ11的α-半乳糖苷酶基因克隆、表达及其性质研究[D]. 哈尔滨:东北农业大学,硕士学位论文,2009.
[7] Wang H, Shi P, Luo H,etal.. A thermophilic α-galactosidase fromNeosartoryafischeriP1 with high specific activity, broad substrate specificity and significant hydrolysis ability of soymilk[J]. Bioresour. Technol., 2014, 153: 361-364.
[8] 曹雅男. 微生物来源36家族α-半乳糖苷酶的基因克隆与性质研究[D]. 北京: 中国业科学院,博士学位论文,2008.
[9] Cao Y, Wang Y, Luo H,etal.. Molecular cloning and expression of a novel protease-resistant GH-36 α-galactosidase fromRhizopussp. F78 ACCC30795[J]. Microbiol. Biot., 2009, 19: 1295-1300.
[10] den Herder I F, Rosell A M M, van Zuilen C M,etal.. Cloning and expression of a member ofAspergillusnigergene family encoding α-galactosidase [J]. Mol. Gen. Genet.,1992, 233:404-410.
[11] 刘小丹,杨培龙,刘永超,等. 一种来源于Paenibacillussp. A1的中性β-甘露聚糖酶基因克隆及其酶学性质研究[J]. 中国农业科技导报, 2009,11(5):60-65.
[12] 张 波, 王继强, 张宝彤.α-半乳糖苷酶水解底物的特异性及其在保育猪日粮中的应用[J]. 中国饲料, 2013,1:18-20.
[13] 高红伟,李素波,鲍国强,等. 原核基因工程制备新型重组α-半乳糖苷酶应用于人B-O血型改造的研究[J]. 中国实验血液学杂志,2011,19(2):503-507.
Studies on the Gene Cloning and its Characterization of α-Galactosidases fromBrachybacteriumsp. DB5
LIU Xiao-dan1,2, DONG Ji-sheng1, JI Tie-qiang1, YANG Pei-long2*
1.HeilongjiangDilongPharmaceuticalCo.Ltd,HeilongjiangAnda151400,China;
2.FeedResearchInstitute,ChineseAcademyofAgriculturalSiences,Beijing100081,China
Alpha- galactosidase is a kind of industrial enzyme preparation with a huge commercial value, which has been widely used in medicine, food and chemical industries. A strain ofBrachybacteriumsp. DB5 was selected to isolate α- galactosidase gene by PCR. Sequencing and BLAST analysises showed that the sequence encoded a α-galactosidase. It was recombinant into the vector pET-30a(+) and transformed into the strainE.coli. α-Galactosidase gene was expressed efficiently after induction with IPTG. An expression activity 5.07 U/mL was obtained. After purification of pure, enzyme activity was 72.78 U/mL. The enzymatic analysis revealed that its optimal pH and temperature were 6.0 and 40℃, respectively. The enzyme could be used for additive of animal feed, soybean meal, in order to improve the feed utilization rate.
α-galactosidase;Brachybacteriumsp.; gene cloning; expression; characterization
2015-02-11; 接受日期:2015-05-01
国家转基因生物新品种培育重大专项(2014ZX08003-002)资助。
刘小丹,工程师,硕士,研究方向为微生物基因工程。E-mail:jinian100@126.com。*通信作者:杨培龙,研究员,博士,博士生导师,主要从事饲料资源与生物技术研究。Tel:010-82106065;E-mail:yangpeilong@caas.cn
10.3969/j.issn.2095-2341.2015.04.10
