植物丙酮酸磷酸双激酶研究进展
2015-06-24姜奇彦牛风娟
姜奇彦, 牛风娟, 胡 正, 张 辉
中国农业科学院作物科学研究所, 北京 100081
植物丙酮酸磷酸双激酶研究进展
姜奇彦, 牛风娟, 胡 正, 张 辉*
中国农业科学院作物科学研究所, 北京 100081
丙酮酸磷酸双激酶(pyruvate orthophosphate dikinase,PPDK)作为C4光合途径中一个非常重要的限速酶,其功能已经清楚,但在C3植物中以及逆境条件下的作用尚不明确。在阐述PPDK基本生物学特征的基础上,重点介绍了PPDK在C4植物和C3植物中的功能、活性调控、基因工程以及PPDK对逆境胁迫应答的研究进展,以期为植物抗逆基因挖掘及抗逆种质创制提供参考。
丙酮酸磷酸双激酶;C3植物;C4植物;逆境胁迫;活性调控
研究表明,逆境胁迫严重影响作物的生长发育,降低作物产量[1~3]。随着自然环境的恶化及不当人为因素影响的增加,逆境胁迫对我国农业生产和粮食安全构成了极大威胁。培育抗逆作物品种具有成本低、见效快、长远持久的特点,是提高逆境胁迫条件下作物产量水平和经济效益的有效方法。而抗逆新基因的挖掘及抗逆新种质的创制是作物抗逆育种的重要保障。
植物丙酮酸磷酸双激酶(pyruvate orthophosphate dikinase,PPDK, EC 2.7.9.1)可催化可逆反应:丙酮酸+ ATP+Pi ↔磷酸烯醇式丙酮酸+AMP+PPi+2H+。PPDK作为C4光合途径中一个非常重要的限速酶已为人们所熟知,但是其在C3植物中的功能以及逆境胁迫下的作用还不清楚。初步研究表明PPDK在逆境条件下具有重要作用[4,5],目前对PPDK基因的逆境分子生物学研究已成为新的焦点。本文重点介绍了PPDK在C4植物和C3植物中的作用、PPDK的活性调控、基因工程以及PPDK对逆境胁迫的应答的研究进展,以期为植物抗逆基因挖掘及抗逆种质创制提供参考。
1 PPDK的基本生物学特征
植物PPDK蛋白有大小不同的两种形式。一种是存在于叶绿体中的叶绿体型丙酮酸磷酸双激酶(chPPDK),其分子量较大,蛋白N末端含有叶绿体转运肽,可以进入叶绿体行使功能,chPPDK在叶绿体中大量积累,同时在茎、花等组织中也有表达[6,7];另一种是存在于细胞质中的胞质型丙酮酸磷酸双激酶(cyPPDK),其分子量较小,蛋白N末端不含叶绿体转运肽,在胞质中发挥作用[8],cyPPDK一般在植物的非光合组织如根、种子中表达[9,10]。在玉米、水稻和拟南芥中都发现,PPDK基因具有特殊的双启动子转录系统,即同一个PPDK基因位点通过2个启动子分别从2个不同的转录起始位点转录,从第一个外显子开始转录的产生chPPDK,从第二个外显子开始转录的产生cyPPDK,长转录物包含的第一外显子编码叶绿体转运肽[7]。
2 PPDK的功能、活性调控及基因工程的研究进展
2.1 PPDK在C4植物中的作用
目前,PPDK在C4植物中作为高光效基因的作用已经研究的相对清楚。PPDK是C4植物光合途径中一个非常重要的限速酶,催化ATP及丙酮酸生成磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP),PEP作为初始CO2受体在NADP-苹果酸脱氢酶(NADP-malate dehydrogenase, NADP-MDH) 的作用下进一步生成苹果酸。苹果酸进入维管束鞘细胞在NADP-苹果酸酶(NADP-malate enzyme, NADP-ME)作用下释放CO2,并生成丙酮酸再进入叶肉细胞被PPDK重新利用,而CO2被Rubisco固定进入三羧酸循环[11]。正是由于C4植物具有这个“CO2泵”、特殊的叶片解剖结构和包括PPDK在内的高效光合作用酶,使得C4植物的光合效率高于C3植物。因此很多研究者将C4高光效基因PPDK转入C3植物,希望提高C3植物的光合效率和产量。
2.2 PPDK在C3植物中的功能
PPDK在C3植物中具有多种非光合作用功能。C4途径高光效酶PPDK的非光合作用同型体在C3植物中分布非常广泛,目前已经检测到在C3植物的花、叶片、子叶、叶柄、根、胚芽鞘、种子中都有PPDK的表达[7,9,12]。但由于C3植物很多组织中PPDK的表达量很低[12],对PPDK在C3植物中的功能研究很少[12,13]。相对而言,C3植物的种子中PPDK的含量最高,所以关于PPDK在C3植物种子中的功能研究相对多一些,研究者认为在C3植物的种子中PPDK主要控制氨基酸的相互转化和淀粉的合成[4,10]。
在C3植物叶片中,PPDK可能和磷酸烯醇式丙酮酸羧化酶(PEPC)以及NADP-ME协同作用,为C3植物的氨基酸合成提供碳骨架[14],并参与CO2的再固定[15]。拟南芥叶片cyPPDK参与叶片自然衰老的氨基酸转运过程,该酶通过加速叶片中的氮代谢来增加种子的重量和氮含量。研究者推断其机理是:叶片在衰老过程中降解蛋白质,降解产生的氨基酸转化为丙酮酸,再由PPDK和PEPC催化形成PEP和草酰乙酸,通过柠檬酸循环产生谷氨酸和谷氨酰胺的前体α酮戊二酸,进而调控氮循环(图1)并提供给种子利用[16]。C3植物中PPDK参与的代谢过程在植物地上及地下不同组织之间还存在着相互关联,代谢物质通过木质部和韧皮部的长途运输过程,调控着地上绿色组织的光合作用和地下根尖的生长过程(图2)[17]。
2.3 PPDK的活性调控
PPDK酶活性严格受光调控,这种调控作用通过PPDK调控蛋白(regulatory protein, RP)实现。RP与一般的调控蛋白不同,它有3个显著特点(图3):①该蛋白具有双重功能,可以催化PPDK活化/去磷酸化和失活/磷酸化;②RP用ADP而不是ATP作为磷供体;③RP催化底物去磷酸化时,依赖无机磷酸,生成焦磷酸,这与大多数蛋白磷酸酶通过水解去磷酸化的机制不同[18,19]。
在对玉米PPDK的研究中发现,光照条件下, RP催化PPDK活性部位的苏氨酸(Thr-456)进行去磷酸化,使PPDK处于活性状态;黑暗条件下,RP催化PPDK磷酸化使其失去活性[20]。Chen等[21]最新研究发现了PPDK更为复杂的调控模式,是光强度而不简单是光/暗变换调控PPDK的活性,并发现了PPDK多个磷酸化位点:Thr-309、Thr-527、Ser-506和Ser-528(图4,彩图见封三图版)。
Casati等[22]发现在UV-B胁迫下,玉米PPDK的Thr-526残基发生了磷酸化。发生了磷酸化的PPDK蛋白在大田中阳光UV-B辐射及补充UV-B辐射的条件下表达量下调,但是在温室中补充UV-B辐射,其表达量上调。这种复杂的蛋白响应机制暗示光质和光量的复合差异对PPDK酶活性具有调控作用,进而调控植物在逆境条件下的光合效率。
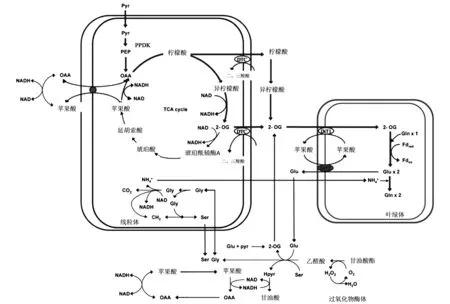
图1 PPDK参与氨基酸转运调控氮代谢[16]Fig.1 Scheme of the PPDK-dependent pathway that amino acid transportation regulate nitrogen metabolism[16].
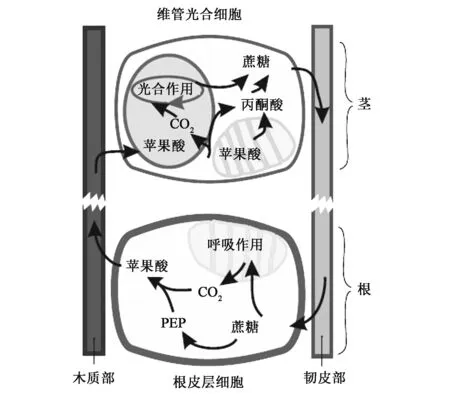
图2 PPDK参与的烟草根和茎中的物质代谢循环过程[17]Fig.2 The PPDK dependent-metabolic pathway in root and shoot of tobacco[17].
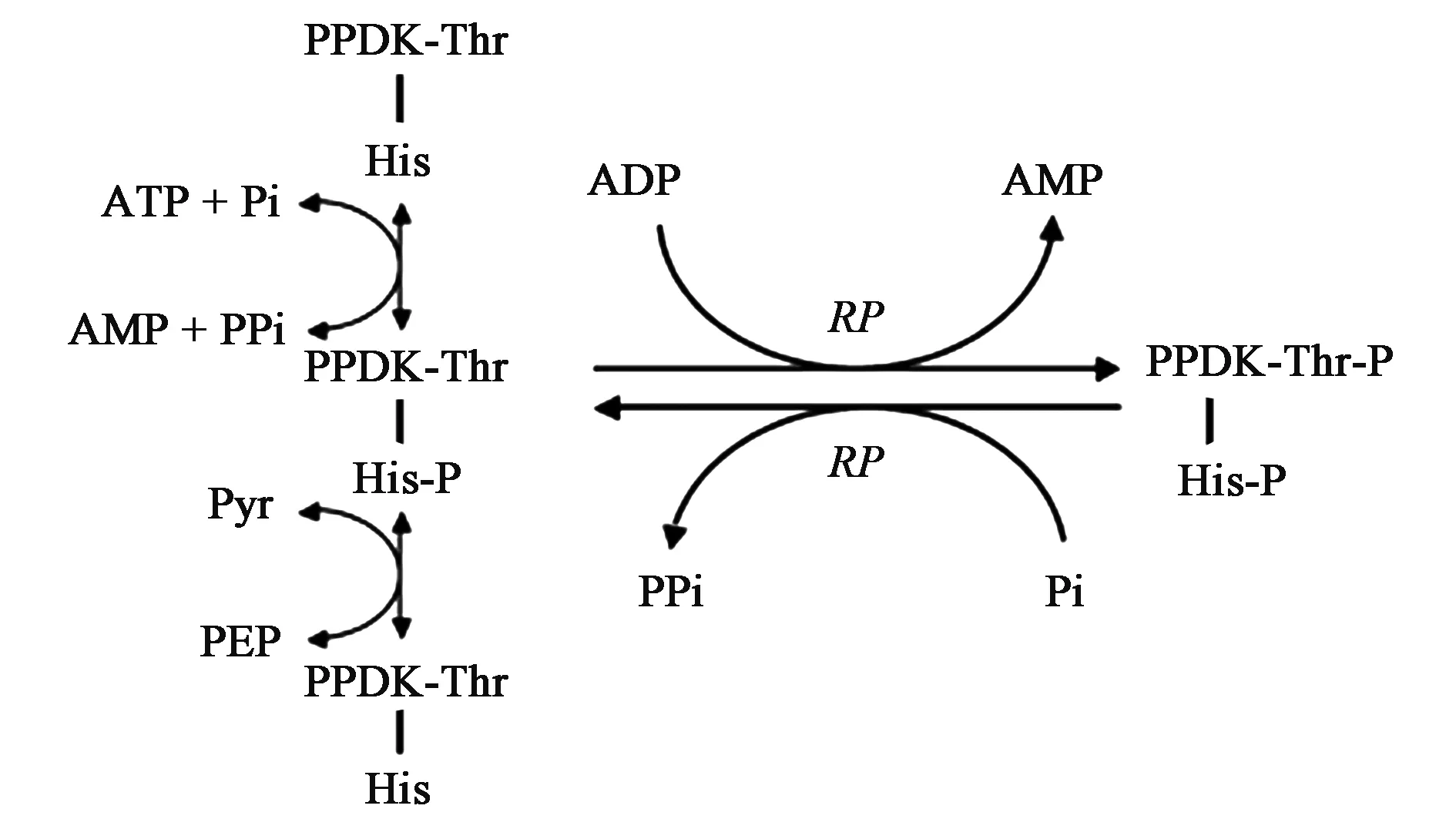
图3 PPDK的催化反应及RP对它的磷酸化调控作用[18]Fig.3 PPDK catalysis and its phospho-regulation by regulatory protein (RP)[18].
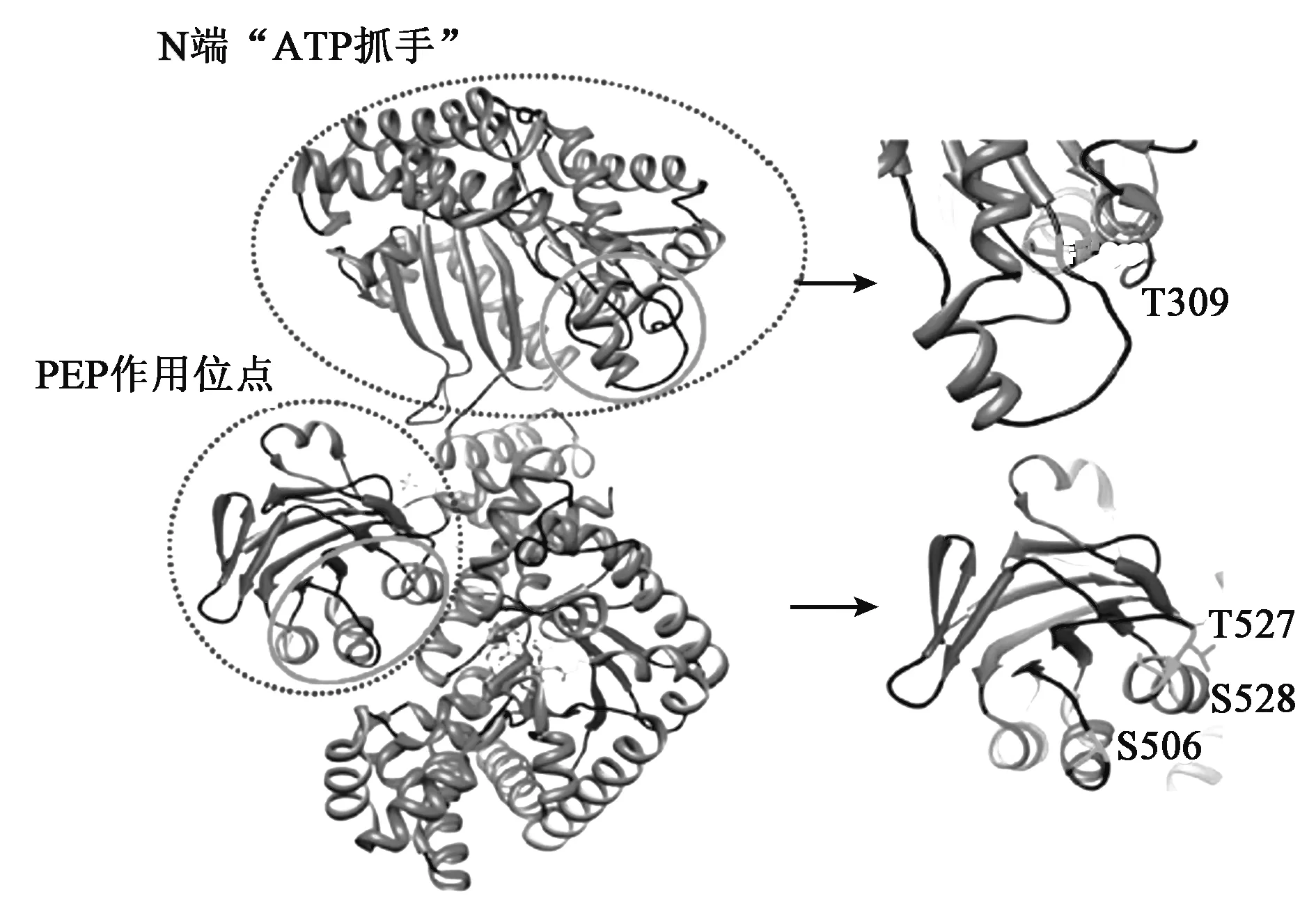
图4 4个磷酸化残基在PPDK三维结构图中的位置[21]Fig.4 Locations of the four phosphorylation residues in the PPDK three-dimensional structure[21].(彩图见封三图版)
2.4 PPDK基因工程研究进展
C4植物光合产量比C3植物高,而PPDK是C4植物光合途径CO2同化作用的关键酶之一,所以目前很多研究都集中在将C4植物的PPDK基因在C3植物中过表达,以期提高C3植物的光合效率和产量。目前已成功地将C4植物的PPDK基因转入烟草[23]、马铃薯[24]、拟南芥[25,26]和水稻[27,28]等C3植物中,转基因植物中的PPDK酶活性都显著提高,但这些转基因植株的光合生理性能大多都没有明显变化。Fukayama等[27]将玉米PPDK的cDNA转化水稻,转基因植株的PPDK活性仅提高了1~5倍,可是将完整玉米PPDK基因(包括其启动子,终止序列和内含子/外显子结构)转入水稻植株,转基因水稻的光合速率提高了35%,PPDK活性增加了40倍。所以PPDK基因的内含子、终止子或者它们的联合作用可能对PPDK基因转录稳定性的提高以及PPDK酶的高效表达有作用。
在C3植物中过表达PPDK,除了希望提高植物的光合效率,另一方面是希望提高植物的抗逆性。如杜西河等[26]将玉米的ZmPPDK基因转入拟南芥,转基因拟南芥的抗旱性增强。还有一些研究是将来自于C3植物的PPDK基因过表达,研究其逆境胁迫下的作用。在拟南芥中过表达cyPPDK可以加速叶片中氮的活化,从而加速植株生长以及增加种子的重量及氮含量,延缓植物衰老[16]。用B33启动子在烟草根中特异表达来自于冰叶日中花(Mesembryanthemumcrystallinum)的chPPDK和cyPPDK,二者都提高了转基因烟草对铝胁迫的耐受性,且转chPPDK的烟草耐铝胁迫的能力更强[29]。
逆境胁迫下PPDK的表现为其非光合功能的阐明提供了线索,同时也为提高植物抗逆性提供了候选基因。但其机理以及提高植物抗逆性的效率,都有待深入研究。
3 PPDK对植物逆境胁迫的应答
初步研究表明[4,5],PPDK在植物逆境胁迫反应中具有重要作用,尽管其作用机理尚不完全清楚。例如,来源于C4植物的chPPDK在植物抵抗低温[30,31]、高盐[32,33]等逆境胁迫的作用机理等尚有待进一步研究。在温度低于12 ℃时,玉米PPDK四聚体解聚,PPDK活性丧失,使得低温下玉米光合速率降低。但是不同植物的PPDK其温度敏感性不同,将黄菊属Flaveriabrownii植物的PPDKcDNA转入玉米后,PPDK表达量提高,转基因玉米的PPDK失活,临界温度与野生型相比降低了3℃[30]。对C4型生物能源作物高大苇子草(Miscanthusgiganteus)14℃低温处理后,PPDK转录水平表达量提高,PPDK酶活性增加,其耐冷型PPDK对维持高大苇子草在低温下的高光合效率起到很重要的作用[31]。盐胁迫(250 mmol/L NaCl)处理玉米杂交种Hybrid351和普通玉米品种Giza2的幼苗,发现杂交种的耐盐性高于普通品种;同时发现盐胁迫后,杂交种中的PPDK含量增加,而普通品种中PPDK含量却降低;且在盐胁迫处理2 d后,NaCl显著抑制了普通玉米品种PPDK的活性,但是在耐盐性相对高的杂交种中,这种抑制作用消失[33],这些结果说明PPDK在玉米抗盐胁迫中可能发挥重要作用。
来源于C3植物的PPDK与植物逆境胁迫的相关研究相对较少,但是目前一些研究发现C3植物的PPDK对一些逆境胁迫产生明显应答,过量表达提高了植物对逆境胁迫的耐受性,说明C3植物的PPDK在植物抵御逆境胁迫过程中可能发挥重要作用。在C3植物水稻根中,ABA、低氧胁迫(淹水处理)、水分缺乏胁迫(干旱、低温、高盐和甘露醇处理)都可以显著诱导cyPPKD的高表达[9]。PPDK在逆境胁迫中的作用机理尚不清楚。Moons等[9]分析认为由于种子中的cyPPKD与氨基酸转化有关,推测水稻根中可能有脯氨酸等氨基酸的积累,提高了水稻对干旱胁迫的耐受能力;低氧胁迫下PPDK活性增加的同时,乙醇脱氢酶I、磷酸羧化酶和苹果酸脱氢酶的活性也增加,说明cyPPDK可能参与了水稻应答低氧胁迫的物质代谢过程。还有研究认为缺氧条件诱导了水稻胚芽鞘中PPDK的大量合成,其功能可能是PPDK与丙酮酸激酶协同作用,催化ATP产生PPi,PPi参与蔗糖水解,并加速糖酵解过程,进而提高水稻胚芽鞘对缺氧胁迫的适应能力[34]。除了非生物胁迫,PPDK在植物抗生物胁迫中也可能发挥重要作用。C3植物烟草(NicotianatabacumL.)在分别感染PotatovirusY(PVY)和PotatovirusA(PVA)病毒后,其叶片PPDK活性增强[35,36]。研究者分析认为在生物逆境胁迫条件下,植物物质代谢过程受到逆境胁迫的影响,通过补偿代谢改变了基本代谢通路,保证了植物的生命活动,PPDK作为补偿代谢途径中的关键酶,在这一过程中起到了重要作用[23]。综合这些研究结果以及PPDK参与的代谢过程,PPDK在植物抗逆过程中可能发挥重要作用,其作用机理可能与渗透活性物质如氨基酸、糖类等的合成有关,还可能与抗氧化分子如NADPH表达量提高有关,也可能与脂肪酸合成、光合作用、TCA循环等过程有关(图5),但这些推测还需要更多的证据支持。
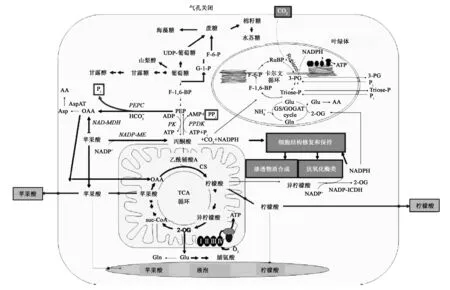
图5 逆境条件下C3植物中与PPDK相关的代谢过程[14]Fig.5 Scheme of PPDK dependent-metabolic pathways occurring in C3 plants exposed to stress factors[14].
4 展望
丙酮酸磷酸双激酶在C4植物中作为高光效基因的作用已经研究的相对清楚,很多研究者将C4植物中的高光效基因PPDK转入C3植物,希望提高C3植物的光合效率和产量,但并未像预想的那样能够显著提高C3植物的光合效率,其原因还不清楚,深入研究其机理有助于提高C3植物的光合作用,进而提高C3类作物的产量,为高产育种提供候选基因。PPDK在逆境条件下的作用了解的还很少,在近年才成为一个新的研究热点。研究初步发现PPDK对逆境胁迫产生应答反应,但其应答机理还不清楚,目前的研究多根据PPDK参与的代谢途径推测PPDK可能的抗逆机理,这些推测还需要更多的证据支持。PPDK抗逆机理的解析,有助于提高PPDK在逆境胁迫下的利用效率,为作物抗逆育种提供候选基因。最终期望创制出既高产又抗逆的新种质,使二者能够有效统一起来。
[1] Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annu. Rev. Plant Biol., 2008, 59: 651-681.
[2] Shavrukov Y. Salt stress or salt shock: which genes are we studying?[J]. J. Exp. Bot., 2013, 64 (1): 119-127.
[3] Bray E A. Plant responses to water deficit[J]. Trends Plant Sci., 1997, 2: 48-54.
[4] Manicacci D, Camus-Kulandaivelu L, Fourmann M,etal.. Epistatic interactions betweenOpaque2 transcriptional activator and its target geneCyPPDK1 control kernel trait variation in maize[J]. Plant Physiol., 2009, 150: 506-520.
[6] Matsuoka M. The gene for pyruvate, orthophosphate dikinase in C4plants: structure, regulation and evolution[J]. Plant Cell Physiol., 1995, 36 (6): 937-943.
[7] Parsley K, Hibberd J M. TheArabidopsisPPDKgene is transcribed from two promoters to produce differentially expressed transcripts responsible for cytosolic and plastidic proteins[J]. Plant Mol. Biol., 2006, 62: 339-349.
[8] Glackin C A, Grula J W. Organ-specific transcripts of different size and abundance derive from the same pyruvate, orthophosphate dikinase gene in maize[J]. Proc. Natl. Acad. Sci. USA, 1990, 87 (8): 3004-3008.
[9] Moons A, Valcke R, van Montagu M. Low-oxygen stress and water deficit induce cytosolic pyruvate orthophosphate dikinase (PPDK) expression in roots of rice, a C3plant[J]. Plant J., 1998, 15: 89-98.
[10] Kang H G, Park S, Matsuoka M,etal.. White-core endospermflouryendosperm-4 in rice is generated by knockout mutations in the C4-type pyruvate orthophosphate dikinase gene (OsPPDKB)[J]. Plant J., 2005, 42(6): 901-911.
[11] Leegood R C. Strategies for engineering C4photosynthesis[J]. J. Plant Physiol., 2013, 170: 378-388.
[12] Chastain C J, Heck J W, Colquhoun T A,etal.. Posttranslational regulation of pyruvate, orthophosphate dikinase in developing rice (Oryzasativa) seeds[J]. Planta, 2006, 224: 924-934.
[13] Burnell J N, Chastain C J. Cloning and expression of maize-leaf pyruvate, Pi dikinase regulatory protein gene[J]. Biochem. Biophys. Res. Commun., 2006, 345: 675-680.
[14] Doubnerová V, Ryšlavá H. What can enzymes of C4photosynthesis do for C3plants under stress [J]? Plant Sci., 2011,180: 575-583.
[15] Jansen M A K, Sessa G, Malkin S,etal.. PEPC-mediated carbon fixation in transmitting tract cells reflects style-pollen tube interactions[J]. Plant J., 1992, 2: 507-515.
[16] Taylor L, Nunes-Nesi A, Parsley K,etal.. Cytosolic pyruvate, orthophosphate dikinase functions in nitrogen remobilization during leaf senescence and limits individual seed growth and nitrogen content[J]. Plant J., 2010, 62: 641-652.
[17] Hibberd J M, Quick W P. Characteristics of C4photosynthesis in stems and petioles of C3flowering plants[J]. Nature, 2002, 415: 451-454.
[18] Chastain C J, Xu W, Parsley K,etal.. The pyruvate, orthophosphate dikinase regulatory proteins ofArabidopsispossess a novel, unprecedented Ser/Thr protein kinase primary structure[J]. Plant J., 2008, 53: 854-863.
[19] Astley H M, Parsley K, Aubry S,etal.. The pyruvate, orthophosphate dikinase regulatory proteins ofArabidopsisare both bifunctional and interact with the catalytic and nucleotide-binding domains of pyruvate, orthophosphate dikinase[J]. Plant J., 2011, 68: 1070-1080.
[20] Chastain C J, Failing C J, Manandhar L,etal.. Functional evolution of C4pyruvate, orthophosphate dikinase[J]. J. Exp. Bot., 2011, 62: 3083-3091.
[21] Chen Y B, Lu T C, Wang H X,etal.. Posttranslational modification of maize chloroplast pyruvate orthophosphate dikinase reveals the precise regulatory mechanism of its enzymatic activity[J]. Plant Physiol., 2014, 165: 534-549.
[22] Casati P, Zhang X, Burlingame A L,etal.. Analysis of leaf proteome after UV-B irradiation in maize lines differing in sensitivity[J]. Mol. Cell Proteom., 2005, 41: 673-1685.
[23] Shedff A, Meyer H, Riedel E,etal.. The influence of plant pyruvate, orthophosphate dikinase on a C3plant with respect to the intracellular location of the enzyme[J]. Plant Sci., 1998, 136: 43-57.
[24] Ishimaru K, Okawa Y, Ishige T,etal.. Elevated pyruvate, orthophosphate dikinase (PPDK) activity alters carbon metabolism in C3transgenic potatoes with a C4maizePPDKgene[J]. Physiol. Planta, 1998, 103: 340-346.
[25] Ishimaru K, Ichikawa H, Matsuoka M,etal.. Analysis of a C4maize pyruvate, orthophosphate dikinase expressed in C3transgenicArabidopsisplants[J]. Plant Sci., 1997, 129: 57-64.
[26] 杜西河,许为钢,胡琳,等. 转ZmPEPC与ZmPPDK基因拟南芥对干旱胁迫的反应[J].分子植物育种,2013, 11(4): 477-484.
[27] Fukayama H, Tsuchida H, Agarie S,etal.. Significant accumulation of C4-specific pyruvate, orthophosphate dikinase in a C3plant, rice[J]. Plant Physiol., 2001, 127: 1136-1146.
[28] 张建福,谢华安,王国英,等. 玉米PEPC基因和PPDK基因在舢稻明恢63中的整合及与光合作用相关的特性分析[J].分子植物育种, 2006, 4(5): 655-662.
[29] Trejo-Téllez L I, Stenzel R, Gómez-Merino F C,etal.. Transgenic tobacco plants overexpressing pyruvate phosphate dikinase increase exudation of organic acids and decrease accumulation of aluminum in the roots[J]. Plant Soil, 2010, 326:187-198.
[30] Ohta S, Ishida Y, Usami S. Expression of cold-tolerant pyruvate, orthophosphate dikinase cDNA, and heterotetramer formation in transgenic maize plants[J]. Transgenic Res., 2004, 13: 475-485.
[31] Wang D, Portis A R J, Moose S P,etal.. Cool C4photosynthesis: pyruvate Pi dikinase expression and activity corresponds to the exceptional cold tolerance of carbon assimilation inMiscanthusxgiganteus[J]. Plant Physiol., 2008, 148: 557-567.
[32] Netmat Alla M M, Hassan N M. A possible role for C4photosynthetic enzymes in tolerance ofZeamaysto NaCl[J]. Protoplasma, 2012, 249: 1109-1117.
[33] Omoto E, Taniguchi M, Miyake H. Adaptation responses in C4photosynthesis of maize under salinity[J]. J. Plant Physiol., 2012, 169: 469-477.
[34] Huang S, Greenway H, Colmer T D,etal.. Protein synthesis by rice coleoptiles during prolonged anoxia: implications for glycolysis, growth and energy utilization[J]. Ann. Bot., 2005, 96: 703-715.
[35] Ryslava H, Muller K, Semoradova S,etal.. Photosynthesis and activity of phosphoenolpyruvate carboxylase inNicotianatabacumL. leaves infected byPotatovirusA andPotatovirusY[J]. Photosynthetica, 2003, 41: 357-363.
[36] Doubnerova V, Janoskova M, Synkova H,etal.. Effect ofPotatovirusY on the activities of antioxidant and anaplerotic enzymes inNicotianatabacumL. transgenic plants transformed with the gene for P3 protein[J]. Gen. Appl. Plant Physiol., 2007, 33: 123-140.
Progress on Plant Pyruvate Orthophosphate Dikinase
JIANG Qi-yan, Niu Feng-juan, HU Zheng, ZHANG Hui*
InstituteofCropScience,ChineseAcademyofAgriculturalSciences,Beijing100081,China
It’s well known that pyruvate orthophosphate dikinase (PPDK) plays a controlling role in the PEP-regeneration phase of the C4photosynthetic pathway. However, PPDK has no established function in C3plants and its role in stress response has remained unclear. The advances in plant PPDK were reviewed in this paper, including PPDK function in C4and C3plant, the activity regulation of PPDK in plants,PPDKgene engineering and the role of PPDK in responding stress. The results and achievements were expected to provide the theoretically basis for deciphering the salt tolerance mechanism and breeding cultivars with high stress tolerance.
pyruvate orthophosphate dikinase (PPDK); C3plant; C4plant; stress; activity regulation
2015-03-13; 接受日期:2015-04-09
国家转基因新品种培育重大专项(2014ZX08002-002)资助。
姜奇彦,助理研究员,主要从事抗逆种质资源鉴定评价及抗逆机理研究。E-mail:jiangqiyan@caas.cn。*通信作者:张辉,研究员,主要从事抗逆种质资源鉴定评价及抗逆机理研究。E-mail:zhanghui06@caas.cn
10.3969/j.issn.2095-2341.2015.04.04
