紫花针茅生殖器官形态的变异及其与环境因子的关系
2015-06-24刘文胜齐丹卉
刘文胜,齐丹卉
(1.中南林业科技大学生命科学与技术学院,湖南 长沙 410004; 2.西南林业大学环境科学与工程学院,云南 昆明 650224)
紫花针茅生殖器官形态的变异及其与环境因子的关系
刘文胜1, 2,齐丹卉2
(1.中南林业科技大学生命科学与技术学院,湖南 长沙 410004; 2.西南林业大学环境科学与工程学院,云南 昆明 650224)
紫花针茅(Stipapurpurea)是青藏高原分布面积最广的植物之一,对高原环境具有广泛的适应性。该植物具有的锥形繁殖体(包括种子和附属结构),是其适应环境的主要特征之一。为揭示该植物对高原环境的适应性表现,本研究对不同纬度的20个紫花针茅种群繁殖体的形态特征及其与环境的关系进行比较研究。结果表明,1)种长的变化幅度为0.692~1.255 cm,种宽的变化幅度为0.392~0.713 mm,芒长的变化幅度为2.394~8.736 cm,种子重的变化幅度为0.678~1.560 mg。芒长和种子重具有较高的种群间变异系数。种子重与种长呈极显著正相关关系(P<0.01),和芒长呈显著正相关关系(P<0.05);种长、种宽、芒长相互之间均呈极显著正相关关系。2)种长、种子重与等效纬度均呈显著正相关关系,与年均降水量均呈显著负相关关系;种长与年均温呈现出凸型变异的关系。3)20个种群依据繁殖体特征进行聚类分析可分为3组,聚类结果与地理分布基本一致。
紫花针茅;锥形繁殖体;形态变异;聚类分析
青藏高原被称为“地球第三极”,是世界上海拔最高、气候变化最敏感的地区之一。喜马拉雅山的隆起导致青藏高原从东南向西北呈现出温度逐渐降低、降水逐渐减少的趋势[1]。紫花针茅(Stipapurpurea)为禾本科针茅属植物,是青藏高原、帕米尔高原和亚洲中部高山地区的特有种,其分布中心在青藏高原。该植物在我国主要分布于西藏、青海、甘肃、四川、新疆等省(区),对高原环境具有广泛的适应性,以该植物为建群种组成的草原是青藏高原高寒植被最典型的代表[1]。作为青藏高原分布最广泛的植物之一,紫花针茅是研究植物对环境适应以及对全球气候变化响应的合适植物。
繁殖体 (包括种子和附属结构) 是植物种群延续和拓展空间的重要载体。其中,既可以通过附有的芒进行运动,又可以通过基部尖端钻入土壤的一类繁殖体即锥形繁殖体(Trypanophorousdiaspore)进行运动。例如,禾本科针茅属植物的外稃附有能够进行吸湿运动的芒,是一类典型的具有锥形繁殖体的植物。借助于芒的吸湿运动,该类植物的种子 (颖果) 可以完成在土壤中的自我埋藏、充分接触土壤,从而有利于种子对水分的吸收、避免被动物取食,提高实生苗的成活率。目前,锥形繁殖体策略已被认为是植物适应旱生环境的主要方式之一,受到人们广泛关注[2-3]。
种子是繁殖体的主要组成部分,其大小反映了种子传播、休眠、生态位及竞争等综合进化过程[4],影响植物的传播、定居及幼苗的存活[5-6],是植物适应进化的核心内容之一。在自然界,种子大小无论在物种间、种群间、个体间,甚至是个体内都存在变异。大的种子储存有较多的营养物质,可为种子萌发及幼苗生长的初期提供更多营养,从而有效提高幼苗成活率,较好地适应胁迫的环境;小的种子则有利于植物的传播和寻找适宜的生境,从而有助于种群的生存[4]。因而,种子大小的变化是植物适应环境的重要策略。
目前,植物繁殖体的研究主要集中于不同繁殖体之间的相互比较,而对同一繁殖体在不同环境条件下变异的研究则较少,这限制了人们对植物繁殖体适应环境特征的认识[7]。本研究将对紫花针茅不同纬度梯度下种群锥形繁殖体(包括种子和芒等)的形态特征进行比较研究,从而揭示繁殖体的形态特征及其与地理及气候因子的关系,以期明确紫花针茅对高原环境的适应特征,进而探讨该植物对气候变化的适应。
1 材料与方法
1.1 样地选择与样品采集
在青藏高原上沿纬度梯度 (28°-37° N) 设置20个紫花针茅样方 (种群) (表1)。于2012年8月上、中旬紫花针茅种子成熟季节,在样方内采集其果穗。紫花针茅果穗是以株丛为单位分别采集,每种群随机采集50个株丛,每株丛采集1个果穗,每种群采集50个果穗,20个种群共计采集1 000个果穗。采集后将果穗装入标记好的采集袋中,带回实验室于室温干燥保存,直至测定。
1.2 形态性状的测量
植物繁殖体的形态测量是以种群为单位进行的。在每个紫花针茅果穗中选择两粒成熟饱满的繁殖体,每种群50个果穗选择了100个植物繁殖体,20个种群共计选择2 000个繁殖体。采用精度为0.01 mm的游标卡尺测量种长、种宽、芒长等指标。种长是指从种子基部到顶部的距离;种宽是指种子最宽处的距离;芒长是指从芒的基部至尖端的距离。测量、统计完毕后,将种子放至烘箱内60 ℃条件下烘至恒重(48 h),然后用天平(精度万分之一)称重,每种群5个重复。种子重以平均单粒种子质量表示。
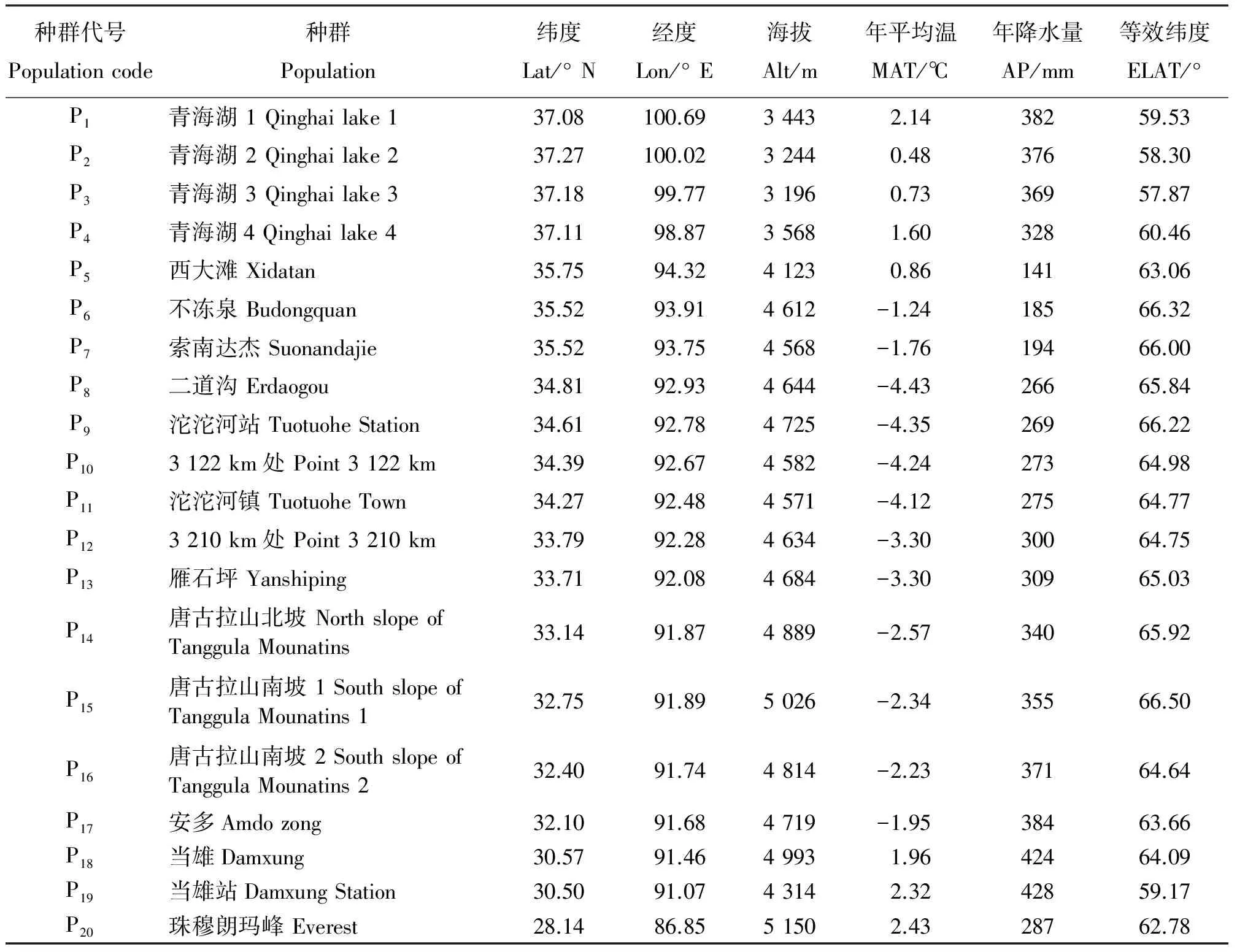
表1 20个紫花针茅种群的分布情况及气候因子
Note: MAT, mean annual temperature; AP, annual precipitation; Lat, latitude; Lon, longitude; Alt, altitude; ELAT, equivalent latitude.
1.3 种群地理信息和气候数据
依据各种群地理坐标及海拔高度,借助于全球气候数据集(http://www.worldclim.org),以0.008 3×0.008 3(1 km×1 km)的分辨率模拟各样地的年平均气温、年降水量等气候指标(表1)。该数据集根据1950-2000年50年的气象数据为基础进行模拟[8]。
由于各种群的海拔差异较大,为了反映纬度的真实效应,消除海拔因素的影响,采用Alena等[9]提出的等效纬度(Equivalent Latitude,ELAT)概念,将所有纬度换算为等效纬度以进行后续的比较。换算公式如下:
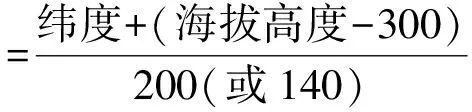
式中,当海拔高度≥300 m时,分母用140;海拔高度<300 m时,分母用200。
1.4 数据分析
利用SPSS 12.0软件 (IBM Corp.,Somers,NY,USA) 进行单因素方差分析 (One-way ANOVA),利用LSD法比较各种群之间形态指标的变异大小;并利用该软件进行Pearson相关分析;应用SPSS 12.0软件进行聚类分析,以比较不同种群繁殖体形态特点的相似性。
种群内变异系数可以反映种群内繁殖体表型的变异程度。种群间变异系数可以反映表型性状在种群间的离散性;变异系数越大,性状的离散程度越高。种群内的变异系数计算公式为:种群内变异系数=各种群标准差/各种群平均数。种群间变异系数是以20个种群内的平均数作为原始数据进行计算,计算公式为:
种群间变异系数=20个种群平均数的标准偏差/总平均数。
2 结果与分析
2.1 繁殖体的形态性状变异
紫花针茅的锥形繁殖体由芒、内稃、外稃、种子等部分组成;芒具有的两回膝曲将其分为芒尖、第一芒柱、第二芒柱三部分。不同种群间种长、种宽、芒长、种子重方差分析表明,在不同种群之间,紫花针茅的种长(F1,19=417.283,P<0.001)、种宽(F1,19=56.661,P<0.001)、芒长(F1,19=342.351,P<0.001)、种子重(F1,19=36.330,P<0.001)均存在极显著的差异。
紫花针茅不同种群间种长、种宽、芒长、种子重如表2所示。各种群间种长的变化幅度在0.692~1.255 cm,平均值为0.933 cm;唐古拉山南坡1种群(P15)的种子平均长度最长,而当雄种群(P18)的种子平均长度最短。各种群间种宽的变化幅度为0.392~0.713 mm,平均值为0.518 mm;来自青海湖种群4(P4)的种宽值最大,来自安多种群(P17)的种宽值最小。各种群间芒长的变化幅度为2.394~8.736 cm,平均值为6.657 cm;来自西大滩种群(P5)的平均芒长值最大,来自当雄种群(P18)的平均芒长值最小(表2)。芒各部分测量结果显示,芒尖长界在1.631~6.073 cm,第一芒柱长界于0.432~1.593 cm,第二芒柱长界于0.372~0.934 cm(未在表内列出)。种子重研究结果显示,各种群种子重界于0.678~1.560 mg,平均值为1.071 mg;来自西大滩种群(P5)的种子重最高,来自青海湖1种群(P1)的种子重最低。
种群内变异系数显示,紫花针茅锥形繁殖体各指标种群内变异程度较大(3.60%~25.39%)。其中,种长和种子重在种群内变异程度较小,分别为5.70%~14.12%和3.60%~17.23%;种宽和芒长在种群内变异程度较大,分别为11.08%~25.39%和7.58%~23.73%(表2)。种群间变异系数表明,繁殖体各指标在种群间存在较大的变异,芒长和种子重种群间变异系数分别达25.29%和24.68%,种长和种宽变异系数分别达17.49%和12.51%。
回归分析显示,种子重与种长呈极显著正相关(R2=0.605,P<0.001,y=0.480 0x+0.418 7),与芒长呈显著正相关(R2=0.200,P=0.048,y=2.846 3x+3.610 4)(图1),与种宽相关性不显著(R2=0.131,P=0.117)。回归分析显示,种长、种宽、芒长三者之间均呈现出极显著的正相关关系(P<0.000 1),表明种子大小可以反映锥形繁殖体的大小。
2.2 繁殖体形态性状变异与环境因子的关系
环境因子是影响繁殖体形态的主要因素,繁殖体对环境适应其形态将发生变化。紫花针茅繁殖体各形态指标与各环境因子的关系如图2所示。种长与等效纬度之间呈显著的正相关关系(R2=0.231,P=0.032,y=0.027 5x-0.813 0,图2A)、与年均温呈现出二次相关关系(R2=0.300,P=0.048,y=-0.017 3x2-0.053 4x+0.995 2,图2B),与年降水量呈显著的负相关关系(R2=0.242,P=0.028,y=-0.001x+1.252 7,图2C);种宽和芒长与等效纬度(R2=0.008,P=0.712;R2=0.009,P=0.694)、年均温(R2=0.021,P=0.547;R2=0.022,P=0.532)、年均降水量(R2=0.091,P=0.196;R2=0.078,P=0.233) 之间相关性均不显著。种子重与等效纬度之间呈显著的正相关关系(R2=0.229,P=0.033,y=0.044 3x-1.744,图2A),与年均温相关不显著(R2=0.065,P=0.277,图2B),与年降水量呈显著的负相关关系(R2=0.487,P=0.001,y=-0.002 4x+1.806 6,图2C)。
2.3 繁殖体形态的聚类分析
种长、种宽、种子重、芒长是繁殖体的重要特征。以这4个形态特征为分类指标进行聚类分析,20个紫花针茅种群的可分为3组(图3)。第1组包括青海湖2种群 (P2)、青海湖3种群(P3)、青海湖4种群(P4)、西大滩种群(P5)、不冻泉种群(P6)、索南达杰种群(P7)、沱沱河镇种群(P11)、唐古拉山北坡种群(P14)、唐古拉山南坡1种群(P15)共9个种群。该组种子形态最大,种长和种宽平均值分别为1.049 cm和0.669 mm,芒长平均值为7.946 cm,种子重平均值为1.238 mg。第2组包括青海湖1种群(P1)、沱沱河站种群(P9)、3 122 km处种群(P10)、3 210 km处种群(P12)、雁石坪种群(P13)、唐古拉山南坡2种群(P16)、安多种群(P17)、当雄站种群(P19)共8个种群。该组形态较大,种长和种宽平均值分别为0.866 cm和0.496 mm;芒长平均值为6.443 cm,种子重平均值为0.910 mg。第3组包括二道沟种群(P8)、当雄种群(P18)、珠穆朗玛峰种群(P20) 共3个种群。该组形态最小,种长和种宽平均值分别为0.760cm和0.486mm;芒长平均值为3.364cm;种子重平均值为0.998 mg。聚类分析结果与各种群所处地理位置基本相符。如P2―P7这6个种群是按纬度高低依次排列的,聚类结果显示这6个纬度相近的种群聚在一起。P12和P13、P16和P17等纬度相近的种群也聚为一类。这充分说明紫花针茅繁殖体形态变异与地理分布位置具有较高的一致性。
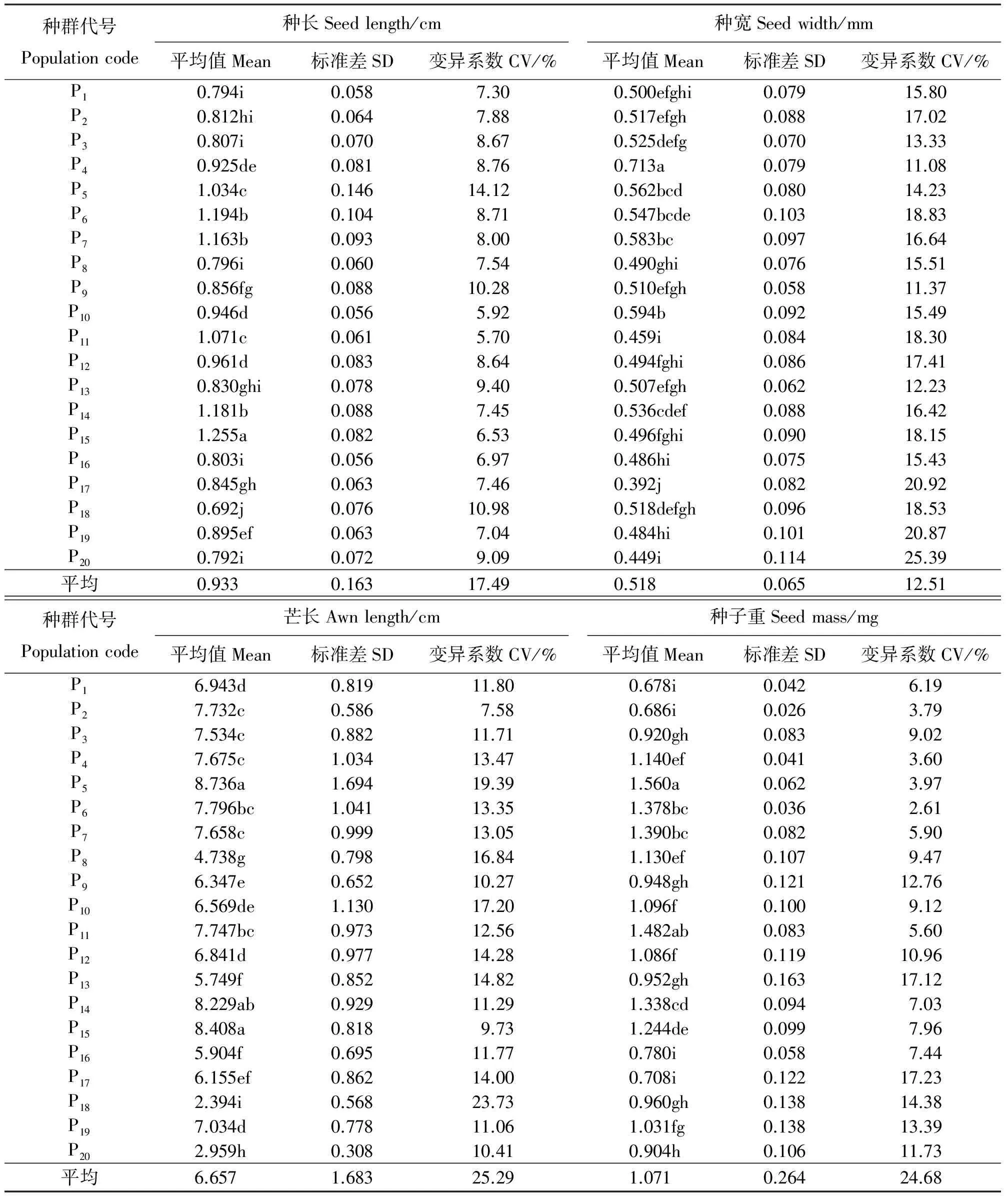
表2 20个紫花针茅种群的种长、种宽、芒长和种子重
注:种群代号同表1。同列不同小写字母表示不同种群间差异显著(P≤0.05)。
Note: Population code is the same as Table 1. Different lower case letters within the same column indicate significant difference among different populations at 0.05 level.
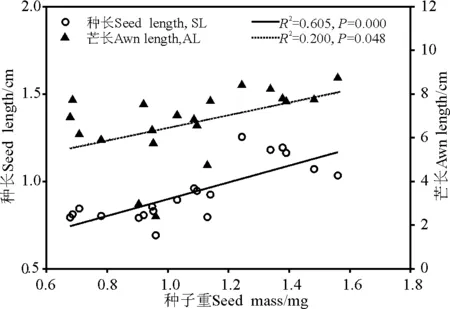
图1 紫花针茅种子重与种长、芒长的关系Fig.1 The relationship between seed mass (SM) and seed length (SL), awn length (AL) in Stipa purpurea
3 讨论
3.1 繁殖体的形态变异
紫花针茅的锥形繁殖体包括种子、内稃、外稃和芒等部分。其中,种子被内稃、外稃紧密包卷;芒为二回膝曲,芒柱上附毛,具有吸湿作用。繁殖体形态为适应其所处环境条件将产生一定变异[10-11]。本研究结果显示,紫花针茅不同种群之间繁殖体存在较大变异。例如,其种长的变化幅度在0.692~1.255 cm,种宽的变化幅度在0.392~0.713 mm,芒长的变化幅度在2.394~8.736 cm;芒尖长界于1.631~6.073 cm,第一芒柱长界于0.432~1.593 cm,第二芒柱长界于0.372~0.934 cm。中国植物志描述显示[12],紫花针茅外稃长约1 cm,背部遍生细毛,基盘尖锐,长约2 mm,密生柔毛;芒两回膝曲扭转,第一芒柱长1.5~1.8 cm,遍生3 mm的柔毛;种子长约6 mm。本研究结果与中国植物志的相关记载基本相符。
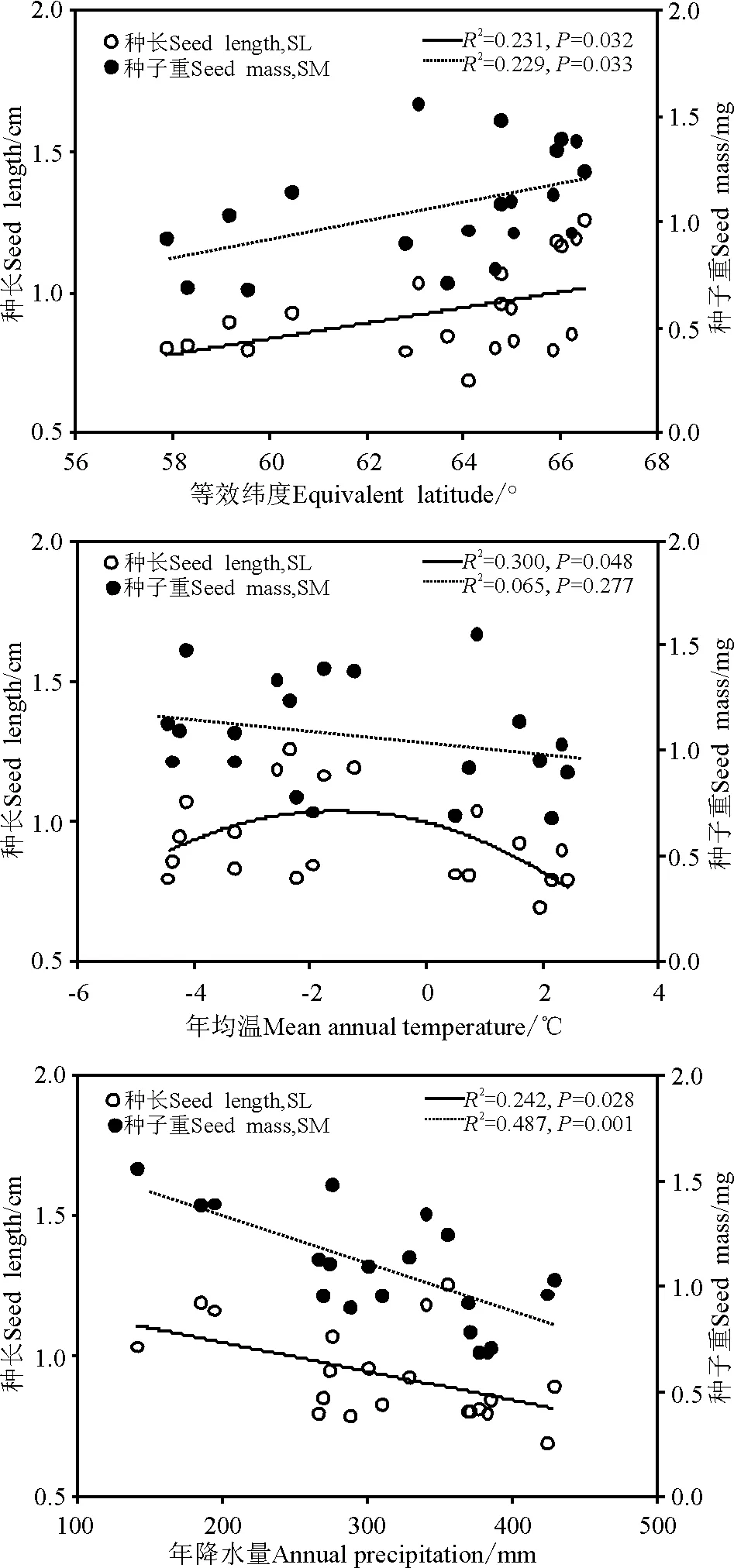
图2 紫花针茅各种群种长、种子重与 地理因子和气候的关系Fig.2 Relationship between seed length (SL), seed mass (SM) and geographic, climatic factors in 20 Stipa purpureapopulations on the Qinghai-Tibetan Plateau
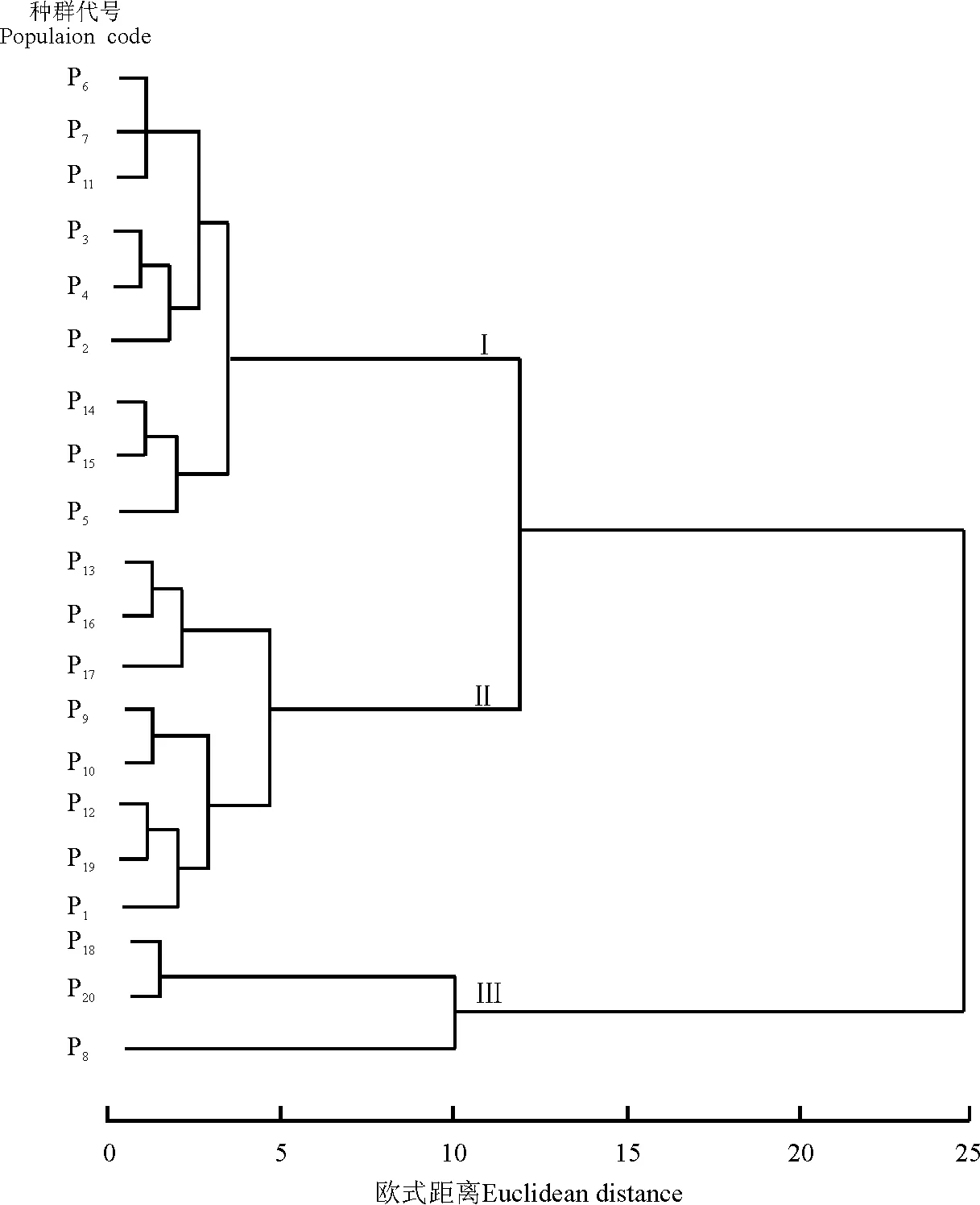
图3 基于种长、种宽、芒长、种子重的20个紫花针茅种群的聚类分析图Fig.3 Cluster dendrogram of 20 Stipa purpurea populations based on seed length, seed width, awn length and seed mass
注:种群代号同表1。
Note: Population code is the same as Table 1.
芒是针茅属植物适应环境的重要器官,也是针茅属植物及禾本科植物的重要分类特征[10,13]。针茅属许多植物是青藏高原及欧亚温带草原群落的建群种,在维持这些地区生态平衡中起着重要作用。
表3为这两类草原区常见的建群种芒长、种长及种宽的比较,结果表明大部分针茅属植物的芒为两回膝曲,仅沙生针茅(Stipaglareosa)与戈壁针茅(S.gobica)的芒为一回膝曲。与针茅属其他植物相比,紫花针茅的芒长较青藏高原其他针茅属植物的长,而较欧亚草原的建群种短;种长、种宽也显示出同样的趋势(表3)。紫花针茅是青藏高原分布最广泛的植物之一,这说明广布种有更大的种子形态。燕玲[14]对内蒙古草原区针茅属植物研究也显示,分布较广的针茅属植物种子较大,其具体机制尚待进一步研究。 本研究还显示,紫花针茅芒长与种长、种宽均呈正相关,这说明该植物不同构件之间大小是相互协调的。田胜平等[15]也发现山苍子(Litseacubeba)各表型性状之间呈正比。其原因可能是紫花针茅繁殖体在发育过程中,不同构件之间产生了能量分配权衡。这种相互协调可能有利于不同大小的种子完成自我埋藏。紫花针茅芒长在种群间变异系数较大(表2),这可能与其对环境的适应有关,即在不同生境中其种子埋入到土壤中的深度可能不一致,从而提高种子的萌发率和幼苗的成活率。较长的芒有利于增加繁殖体在空气中的停留时间,从而利于种子的自我埋藏。例如,Garnier和Dajoz[16]发现短梗苞茅(Hyparrheniadiplandra)繁殖体的芒长变化与种子埋藏深度呈显著正相关关系,芒较长的繁殖体可以将自身埋藏到较深的土壤中,从而避免被火烧死。因而,芒长是植物对环境适应的重要指标。

表3 紫花针茅繁殖体形态与同属其他植物的比较
注:A表示该植物为青藏高原高寒草原的建群种;B表示该植物为欧亚温带草原的建群种;AB表示该植物既为两类草原的建群种;Δ表示该植物的芒为一回膝曲;空格表示无相关数据。
Note: LAA, length of awn apex; LFSA, length of the first segment of awn; LSSA, length of the second segment of awn; A, denotes the plant is a constructive species of the alpine steppe on the Qinghai-Tibetan Plateau; B, denotes the plant is a constructive species of Eurasian temperate steppe; AB, denotes the plant belongs to both A and B; Δ, denotes the awn of the species is bended once; Blank place means there was no data of this species.
3.2 繁殖体的形态变异格局及原因
植物各器官的生长、发育受遗传和环境因素的共同影响,表现出对环境的高度适应[17-18]。针茅属植物 (包括紫花针茅) 种子均较细长、具有吸湿芒,这使得该类植物能够较好地完成自我埋藏作用,利于种子萌发与幼苗生长;另一方面,形状细长和具有吸湿芒的种子具有迅速萌发的趋势,这也利于植物适应青藏高原的严酷环境[7,19]。例如,笔者在试验中也发现,紫花针茅种子在光照培养箱中20 ℃条件下培养,第3天即开始有种子萌发,第7天达到萌发高峰,第15天萌发基本结束,说明该植物种子有较高的萌发速率。这可能是该植物能够在青藏高原严酷环境中占优势的重要原因。
本研究显示,紫花针茅种长、种子重均与等效纬度呈正相关,与年降水量呈负相关;种长与年均温呈二次相关关系。这显示在较严酷的环境条件下(低温、低降水量),紫花针茅将以产生大种子的策略来适应环境。贾美清等[20]发现克氏针茅(Stipakrylovii)种子在生境较差的条件下种子较大 (千粒重较重)。Ronnenberg等[21]也发现克氏针茅随着浇水量的增加,种子大小减小。赵萌莉等[22]研究也显示克氏针茅种宽随着降水量的降低而增加。这说明产生大种子适应恶劣生境是多种针茅属植物的一种重要策略,其原因可能是大种子储存有较多营养,利于种子萌发和幼苗初期的生长,从而有利于种群的生存[19,23-25]。如Easton和Kleindorfer[26]、El Atta等[27]均发现大种子萌发率较高。Landergotta等[28]发现大种子产生的幼苗有较强的竞争能力。刘振恒等[29]对青藏高原东部常见禾本科植物种子大小与萌发的关系研究显示,种子大小与萌发率成正相关。笔者对紫花针茅种子萌发研究的结果也显示,大种子有较高的萌发率。这种策略的产生可能主要是受遗传影响,也可能与该植物的开花模式有关,即开花受精/闭花受精的比例随土壤含水率的增加而降低[30]。在土壤干旱的条件下开花受精的比例较高,增加了种群之间的基因交流,从而利于大种子的产生[30]。而在干旱条件下,大种子可提高幼苗成活率,利于植物生存,这可能是该植物对干旱环境适应的一种机制。
紫花针茅各种群聚类分析结果显示,繁殖体形态变异与地理空间分布具有较高的一致性。其原因是地理位置 (如纬度) 与环境因子是高度相关的,环境因子则直接影响繁殖体的形态变异。Yue等[31]对紫花针茅群落进行排序研究结果也显示,以该植物为优势种的群落的分布与纬度有较强的相关性。Liu等[32]对紫花针茅遗传多样性研究也显示,该植物的遗传多样性与纬度呈负相关。这说明地理分布是影响紫花针茅繁殖体变异的重要因子。
繁殖体形态随着地理和气候因子的变化产生不同程度的变异。弄清它们的相互关系将会为认识全球变暖后植物的迁移方向和植物在不同环境下的变异趋势提供参考。青藏高原是全球变化最敏感的区域之一,全球变暖将深刻影响该高原广布种的生长、繁殖与分布。本研究表明,在较大的空间尺度上,紫花针茅繁殖体形态变异与气候因子密切相关;未来的气候变化将在一定程度上影响繁殖体的形态,从而影响该植物的迁移、繁殖和更新。因而,本研究结果为认识紫花针茅对环境变化的适应与响应机制提供了参考,也为全球变暖背景下紫花针茅草原的经营和管理提供了第一手资料,具有重要意义。
[1] 吴征镒.中国植被[M].北京:科学出版社,1980.
[2] Low A B,Robelo A.Vegetation of South Africa,Lesotho and Swaziland[M].Pretoria:Departments of Environmental Affairs and Tourism,1996.
[3] 青秀玲,白永飞.植物锥形繁殖体结构及其适应[J].生态学报,2007,27(6):2547-2553.
[4] Pluess A R,Schütz W,Stöcklin J.Seed weight increases with altitude in the Swiss Alps between related species but not populations of individual species[J].Oecologia,2005,144(1):55-61.
[5] Fenner M.Seeds,the Ecology of Regeneration inPlantcommunities[M].Wallingford:CABI Publishing,2000.
[6] Wirth L R,Graf R,Gugerli F,Landergott U,Holdergger R.Between-year variation in seed weights across altitudes in the high-alpine plantEritrichiumnanum[J].Plant Ecology,2010,207(2):227-231.
[7] 赵新风,朱艳芬,徐海量,叶茂,李媛.塔里木河下游21种荒漠植物繁殖体形态特征及对环境的适应[J].西北植物学报,2009,29(2):283-290.
[8] Hijmans R J,Cameron S E,Parra J L,Jones P G,Jarvis A.Very high resolution interpolated climate surfaces for global land areas[J].International Journal of Climatology,2005,25(15):1965-1978.
[9] Jonsson A, Eriksson G, Dormling I, Ifver J.Studies on frost hardiness ofPinuscontortaDougl.seedlings grown in climate chambers[J].Studia Forestalia Suecica,1981,157:1-47.
[10] 郭本兆,王世金,卢生莲,孙永华.我国针茅族小穗的形态演化及其属间亲缘关系的探讨[J].西北植物研究,1983,3(1):18-27.
[11] 周旋,何正飚,康宏樟,孙逍,刘春江.温带-亚热带栓皮栎种子形态的变异及其与环境因子的关系[J].植物生态学报,2013,37(6):481-491.
[12] 中国科学院中国植物志编委会.中国植物志:第9卷第1分册[M].北京:科学出版社,1998.
[13] 德英,穆怀彬,刘新亮,赵来喜,王照兰.披碱草属8种野生牧草居群穗部形态多样性[J].草业科学,2011,28(9):1623-1631.
[14] 燕玲.内蒙古草原区针茅属植物颖果特征的比较研究[J].干旱区资源与环境,1994,8(4):76-79.
[15] 田胜平,汪阳东,陈益存,韩小娇,占志勇.山苍子天然种群叶片和种实性状的表型多样性[J].生态学杂志,2012,31(7):1665-1672.
[16] Garnier L K M,Dajoz I.Evolutionary significance of awn length variation in a clonal grass of fire-prone savannas[J].Ecology,2001,82(6):1720-1733.
[17] Volis S,Bohrer G.Joint evolution of seed traits along an aridity gradient:Seed size and dormancy are not two substitutable evolutionary traits in temporally heterogeneous environment[J].New Phytologist,2013,197(2):655-667.
[18] Li Y,Yang H,Xia J,Zhang W,Wan S,Li L H.Effects of increased nitrogen deposition and precipitation on seed and seedling production ofPotentillatanacetifoliain a temperate steppe ecosystem[J].PLoS ONE,2011,6(12):e28601.
[19] Hendry G A F.Methods in Comparative Plant Ecology-A Laboratory Manual[M].London:Chapman & Hall,1993.
[20] 贾美清,高玉葆,刘海英,高慧,吴建波,包晓影.内蒙古中东部草原不同生境克氏针茅(StipakryloviiRoshev.)种群的形态差异分析[J].植物研究,2008,28(5):608-613.
[21] Ronnenberg K,Hensen I,Wesche K.Contrasting effects of precipitation and fertilization on seed viability and production ofStipakryloviiin Mongolia[J].Basic and Applied Ecology,2011,12(2):141-151.
[22] 赵萌莉,韩冰,武金凤,张海龙,郑浩,索培芬.克氏针茅群体变异研究初报[J].草地学报,2003,11(2):163-169.
[23] 王慧春,周华坤,王文颖,赵新全.三江源区高寒草甸43种植物繁殖体质量和形状的比较[J].西北农林科技大学学报,2009,37(8):195-203.
[24] Souza M L,Fagundes M.Seed size as key factor in germination and seedling development ofCopaiferalangsdorffii(Fabaceae)[J].American Journal of Plant Sciences,2014,17(5):2566-2573.
[25] Liu K,Baskin J M,Baskin C C,Bu H Y,Liu M X,Liu W,Du G Z.Effect of storage conditions on germination of seeds of 489 species from high elevation grasslands of the eastern Tibet Plateau and some implications for climate change[J].American Journal of Botany,2011,98(1):12-19.
[26] Easton L C,Kleindorfer S.Interaction effects of seed mass and temperature on germination inAustralianspeciesof Frankenia (Frankeniaceae)[J].Folia Geobotanica,2008,43(4):383-396.
[27] El Atta H,Aref I,Ahmed A.Effects of seed mass and seed coat on germination and seedling emergence ofAcaciaehrenbergianaHayne[J].Life Science Journal,2013,10(3):2438-2445.
[28] Landergotta U,Gugerlia F,Hoebeea S E,Finkeldey R,Holdereggera R.Effects of seed mass on seedling height and competition in European white oaks[J].Flora,2012,207(10):721-725.
[29] 刘振恒,徐秀丽,卜海燕,武高林.青藏高原东部常见禾本科植物种子大小变异及其与萌发的关系[J].草业科学,2006,23(11):53-57.
[30] Ronnenberg K,Wesche K,Hensen I.Effects of differing annual precipitation levels on seed viability of twoStipa-speciesof southern Mongolia[A].Abstracts of the 19th Annual Conference of the Section Plant Population Biology of the Ecological Society of Germany[C].Switzerland and Austria:Halle (Saale),2006.
[31] Yue P P,Lua X F,Yea R R,Zhang C X,Yang S B,Zhou Y B,Peng M.Distribution ofStipapurpureasteppe in the Northeastern Qinghai-Xizang Plateau (China)[J].Russian Journal of Ecology,2011,42(1):50-56.
[32] Liu W S,Dong M,Song Z P,Wei W.Genetic diversity pattern ofStipapurpureapopulations in the hinterland of Qinghai-Tibet Plateau[J].Annals of Applied Biology,2009,154(1):57-65.
(责任编辑 王芳)
Variations of reproductive organs morphology ofStipapurpureaand relationship with climate on the Qinghai-Tibetan Plateau
LIU Wen-sheng1,2, QI Dan-hui2
(1.College of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, China; 2.College of Environmental Sciences and Engineering, Southwest Forestry University, Kunming 650224, China)
As constructive species of alpine meadow and steppe,Stipapurpureaadapt to different climate conditions and is one of the most widely distributed plants on the Qinghai-Tibetan Plateau. Trypanophorous diaspora (including seeds and accessory organs) owned byS.purpureais one of the most important factors for the plant to adapt to harsh environment. To illustrate the adaptive characteristics of this plant to the plateau environments, trypanophorous diasporas of 20S.purpureapopulations along a latitudinal gradient on the Qinghai-Tibetan Plateau were collected. Morphology characteristics of these diasporas from different populations were measured and their relationship with environmental conditions were also analysis in the present paper. The results showed that seed length, seed width, awn length and seed mass ranged from 0.692~1.255 cm, 0.392~0.713 mm, 2.394~8.736 cm and 0.678~1.560 mg, respectively. There were high values of coefficient of variability (CV) among populations in awn length and seed mass. Seed mass positively correlated with seed length and awn length. Seed length, seed width and awn length were positively correlated with each other. Seed length and seed mass increased significantly with equivalent latitude, but decreased with annual precipitation. Seed length displayed humped-shape relationships with mean annual air temperature. These 20S.purpureapopulations clustered into 3 groups according to these tested characteristics of trypanophorous diaspora, which consistent with geographic distributions of these populations.
Stipapurpurea; trypanophorous diaspora; morphology variation; cluster analysis
QI Dan-hui E-mail:7942965@qq.com
10.11829j.issn.1001-0629.2014-0426
2014-09-22 接受日期:2015-02-11
国家自然科学基金资助(31160048)
刘文胜(1975-),男,湖北蕲春人,副教授,博士,主要从事植物生物学研究。E-mail:liuwsairr@163.com
齐丹卉(1979-),女,山东昌邑人,讲师,硕士,主要从事植物生态学研究。E-mail:7942965@qq.com
Q944.3
A
1001-0629(2015)06-0942-10
刘文胜,齐丹卉.紫花针茅生殖器官形态的变异及其与环境因子的关系[J].草业科学,2015,32(6):942-951.
LIU Wen-sheng,QI Dan-hui.Variations of reproductive organs morphology ofStipapurpureaand relationship with climate on the Qinghai-Tibetan Plateau[J].Pratacultural Science,2015,32(6):942-951.
