基于SSR标记的厚朴亲本及其子代群体的遗传多样性分析
2015-06-24杨志玲汪丽娜
麦 静, 杨志玲, 杨 旭, 汪丽娜
(中国林业科学研究院亚热带林业研究所 浙江省林木育种技术研究重点实验室, 浙江 富阳 311400)
基于SSR标记的厚朴亲本及其子代群体的遗传多样性分析
麦 静, 杨志玲①, 杨 旭, 汪丽娜
(中国林业科学研究院亚热带林业研究所 浙江省林木育种技术研究重点实验室, 浙江 富阳 311400)
以来自浙江遂昌的5株厚朴(MagnoliaofficinalisRehd. et Wils.)单株为母本,来自浙江磐安和富阳、江西分宜以及湖南沅陵的厚朴群体为父本,获得7个杂交授粉子代群体;并对5株母本单株进行自由授粉,获得5个自由授粉后代群体;在此基础上,采用SSR标记技术对厚朴亲本群体以及杂交和自由授粉子代群体的遗传多样性进行分析。结果表明:13对SSR引物扩增的片段长度为105~297 bp,共检测到54个等位基因,每个位点的观测等位基因数和有效等位基因数分别为4.2和2.6。总体上,杂交授粉子代群体的遗传多样性最高,其Shannon多样性指数(I)、Nei’s基因多样性指数(h)和期望杂合度(He)平均值分别为1.049 3、0.577 3和0.638 2;亲本群体的遗传多样性略低于其杂交授粉子代群体,其I、h和He平均值分别为1.022 1、0.559 7和0.601 3;自由授粉子代群体的遗传多样性最低,其I、h和He平均值分别为0.813 8、0.480 8和0.530 0。7个杂交授粉子代群体亲本间的Nei’s遗传距离为0.576 2~1.181 1,且与杂交授粉子代群体的遗传多样性呈正相关,但相关性不显著(R=0.392 4)。7个杂交授粉子代群体间的Nei’s遗传距离和遗传一致度分别为0.274 9~0.804 6和0.446 4~0.759 6,其中来源于同一父本的杂交授粉子代群体间的遗传一致度最高,且Nei’s遗传距离越大其遗传一致度越小。聚类分析结果表明:在Nei’s遗传距离为0.93处,供试的5个母本单株以及3个父本群体、7个杂交授粉子代群体和5个自由授粉子代群体可分成3类,其中来源于同一父本的杂交授粉子代群体及其父本群体具有较近的亲缘关系。研究结果显示:厚朴杂交授粉子代群体的遗传多样性水平明显高于其自由授粉子代群体,并且总体上高于其亲本,说明杂交授粉可加速厚朴群体间的基因交流,丰富其群体的遗传多样性。
厚朴; SSR标记; 杂交授粉; 遗传多样性; Nei’s遗传距离; 聚类分析
厚朴(MagnoliaofficinalisRehd. et Wils.)为木兰科(Magnoliaceae)木兰属(MagnoliaLinn.)落叶乔木,既是珍贵的用材树种,也是重要的中药材。厚朴的应用历史悠久,药用价值始载于《神农本草经》;其根皮、茎皮和花蕾均可入药,目前在国内的年使用量高达3 000 t[1]。厚朴为广布高山树种,并且是较为原始的种类,对研究植物区系及木兰科分类具有重要的科学意义。然而,20世纪60年代以来,野生厚朴遭到过度采伐,致使其野生资源急剧减少、分布面积越来越小,生境呈现典型的破碎化状态,目前野生厚朴仅零星分布于一些古村落或自然保护区内。因其特殊的分类学地位和重要的药用价值,厚朴已经被列为国家二级重点保护野生植物和二级保护中药材[2]。
国内外研究者一直非常重视对厚朴的相关研究,研究内容主要集中在栽培技术[3-4]、药用成分[5-7]、药理作用[8-10]及花香气成分分析[11]等几个方面;近年来,陆续有学者对厚朴的遗传结构及遗传多样性开展了相关研究,并取得了一定的研究成果。郑志雷[12]通过SRAP和RAPD技术构建了89份厚朴种质资源的指纹图谱,并认为厚朴物种水平的遗传多样性高于居群水平;蒋燕峰等[6]和He等[13]则分别应用AFLP技术探讨了厚朴种源间及个体间等多个层次的遗传多样性及其野生居群和栽培群体的遗传多样性;于华会等[14]应用ISSR技术对28个厚朴居群进行了遗传多样性研究,结果显示厚朴居群间的基因流较弱,并且居群间的遗传分化较严重。综上所述,在物种和居群水平上,厚朴的遗传多样性均存在差异。另外,厚朴为异交繁殖并需要传粉者协助才能完成传粉过程,在自然状态下的传粉效率较低,并且同株自花授粉和败育现象均十分严重,造成其自然更新缓慢,致使其面临濒危的危险[15]。
SSR(simple sequence repeat)标记又称微卫星(microsatellite)标记,是由1~6个碱基组成的基序串联重复而成的DNA序列,广泛随机分布于真核生物基因组中[16]。SSR标记为共显性标记,克服了RAPD和ISSR标记扩增产物不稳定、多态性低等问题,是比较基因组学、遗传多样性和系统学研究的理想标记。目前,运用SSR标记已对华木莲(ManglietiadeciduaQ.Y.Zheng)[17]、观光木〔Micheliaodora(Chun) Noot. et B. L. Chen〕[18]、长柄双花木(DisanthuscercidifoliusMaxim. var.longipesH. T. Chang)[19]、鹅掌楸〔Liriodendronchinense(Hemsl.) Sarg.〕[20]、日本天女花(Magnoliasieboldiisubsp.japonicaK. Ueda)[21]和日本厚朴(MagnoliaobovataThunb.)[22]等木兰科植物进行了遗传多样性分析。
为了提高厚朴的遗传多样性水平,作者以产自浙江遂昌神龙谷国家森林公园的厚朴植株为母本,以产自浙江磐安和富阳以及江西分宜和湖南沅陵的厚朴植株为父本进行居群间杂交实验,共获得7个杂交授粉群体和5个自由授粉群体,并利用SSR分子标记技术对上述子代群体和亲本群体的遗传多样性进行分析,以期明确子代群体和亲本群体间的遗传关系,从分子水平上阐述控制授粉之后子代群体遗传多样性的变化,为濒危物种群体遗传多样性的恢复及小种群重建提供理论依据和实践指导。
1 材料和方法
1.1 材料
以来自浙江遂昌神龙谷国家森林公园中的厚朴为母本,以来自浙江磐安园塘林场(PA)和富阳黄公望森林公园(FY)以及江西分宜树木园林场(JX)和湖南沅陵杜家坪乡(RL)的厚朴植株为父本,于2013年5月进行居群间杂交授粉。在厚朴的盛花期采集父本植株的花粉,每个居群至少采集15个单株80朵花的花粉,将各居群的花粉混合均匀;随机选择5株发育良好且开花数量较多的母本植株(分别记为SM1、SM2、SM3、SM4和SM5)进行人工套袋授粉并挂牌,每个母本植株同时与4个父本的花粉分别进行授粉,每个父本共授粉50~60朵花,其余花朵进行自由授粉(对照),连续授粉7 d。2013年10月,采集各杂交及自由授粉植株的种子,共获得7个杂交授粉群体(分别为SM1×RL、SM1×FY、SM2×RL、SM3×FY、SM4×RL、SM4×JX和SM5×JX)和5个自由授粉群体(包括FSM1、FSM2、FSM3、FSM4和FSM5)的种子。2014年1月,对各杂交和自由授粉植株的种子进行播种育苗,分别获得16、13、10、24、5、7、12、18、13、10、16和7株F1代幼苗。2014年5月,采集所有杂交和自由授粉植株的F1代幼苗嫩叶,同时采集父本(FY、JX和RL分别为15、22和27株;由于PA各杂交组合均未结籽,因此未采集PA父本)和母本(SM,5株)供试样株的嫩叶,将每个单株的嫩叶样品分别置于-70 ℃低温冰箱中保存、备用。
1.2 方法
1.2.1 DNA提取和检测 采用改良的SDS-CTAB结合法提取各样品的基因组DNA[14],使用NanoDrop 2000超微量分光光度计(美国Thermo Fisher Scientific 公司)检测DNA的纯度和浓度,采用质量体积分数1%的琼脂糖凝胶电泳检测DNA质量。将获得的DNA样品稀释至50 ng·μL-1,置于-20 ℃保存备用。
1.2.2 SSR-PCR扩增反应 供试的13对SSR引物均由生工生物工程(上海)股份有限公司合成,其中7对引物序列来自近缘种日本厚朴[22]和Magnoliastellata(Sieb. et Zucc.) Maxim.[23],其余6对引物序列采用生物信息技术自主设计获得,各引物序列见表1。
采用2720 Thermal Cycler PCR仪(美国ABI公司)进行SSR-PCR扩增反应,Taqplus DNA聚合酶、dNTPs及buffer(含Mg2+)均购自北京鼎国昌盛生物技术有限责任公司。反应体系总体积为25 μL,包含2 ng·μL-1DNA模板、正向引物和反向引物各0.3 μmol·L-1、2.0 mmol·L-1buffer(含Mg2+)、0.5 mmol·L-1dNTPs和0.03 U·μL-1Taqplus DNA聚合酶。扩增程序如下:94 ℃预变性4 min;94 ℃变性30 s,根据引物的退火温度(48 ℃~59 ℃)退火30 s,72 ℃延伸1 min,共35个循环;最后于72 ℃延伸10 min。扩增产物用质量体积分数8%聚丙烯酰胺凝胶在150 V恒压下电泳3 h,然后参照梁宏伟等[24]的方法进行银染并拍照。
表1 用于厚朴SSR-PCR扩增的引物序列及退火温度
Table 1 Sequence and annealing temperature of primers used for SSR-PCR amplification ofMagnoliaofficinalisRehd. et Wils.

引物编号 No.ofprimer引物序列(5′→3′) Primersequence(5′→3′) 正向引物Forwardprimer 反向引物Reverseprimer退火温度/℃Annealingtemperature HP02 GAGCCGAATAAAGAATGA ATCTATGGTCCGAAACTA53.8 HP08 GCATACGATTCATGGGGAGA AAACGCCTACGAAAAGAT48.0 HP13 AGAAATAGATCGAACGGAA GCAAACGCCTACGAAAAG48.0 HP15 CTCCGACCATAACATAAT TCCGAGGTATTTCCGTGA51.0 HP16 TCCAAGGAACAGGAAGAA GCAAACGCCTACGAAAAG52.0 HP19 ATAGATCGAACGGAACAC GCAAACGCCTACGAAAAG52.0 Stm0246 AGTAATTCCCGCTCGTTC AGGAGAAGGAGGAATGGA59.0 M17D5 AAGCAAAGCCTCCTAGGTC TCTACGCCTAACAGGTCTGTC54.0 M15D5 TGCTGCTCGAAGTTCTGAAT CGTGCAGTAAATCAGGATGT52.7 M10D8 GATCGTTGCTGGCTCGC GCCGCCTGGATTATGAA52.5 M10D3 AGCCCTCTATACACGCACACAT CGGAGCTACAAGGAGCAGAATA51.5 M6D10 GTCTAGTGAGCCGCAAATGG GTGAACAGCTTTCTTGTGAA51.8 M6D1 ACTGGAGCAGTGCCTGGATA TCGCAACTGCGTGTTCTCAT54.0
1.3 数据统计和分析
二倍体生物的SSR-PCR反应一般会扩增出1条(纯合体)或2条(杂合体)条带,若同一引物不同样品的条带迁移率一致则认为具有同源性。将电泳图谱中的清晰条带按照由大到小的顺序依次命名为A、B、C、D、……,其中,纯合体用2个相同的字母表示,如AA、BB、……;杂合体用2个不同的字母表示,如AB、BC、……;无条带用“-”表示。
采用POPGEN 32软件计算并统计各样品的观测等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、Nei’s基因多样性指数(h)及Shannon多样性指数(I)等指标,同时采用该软件计算遗传一致度(GI)及Nei’s遗传距离(D);采用NTSYS-pc 2.1软件对亲本及杂交和自由授粉F1代群体进行聚类分析。
2 结果和分析
2.1 厚朴杂交亲本及杂交和自由授粉子代群体的遗传多样性比较
采用13对SSR引物对厚朴亲本及杂交和自由授粉子代群体进行PCR扩增,扩增片段长度为105~297 bp,根据扩增结果分析出的厚朴杂交亲本群体、杂交授粉子代群体和自由授粉子代群体的遗传多样性见表2。在供试的7个杂交授粉子代、5个自由授粉子代、3个父本和1个母本群体总计220株样品中共检测到54个等位基因,每个位点的观测等位基因数(Na)为4.2,有效等位基因数(Ne)为2.6。
表2 基于SSR标记的厚朴杂交和自由授粉子代群体及其杂交亲本群体的遗传多样性分析
Table 2 Analysis on genetic diversity of progeny populations of hybrid and free pollinations and their hybrid parent populations ofMagnoliaofficinalisRehd. et Wils. based on SSR marker

群体1)Population1)样本量Samplenumber观测等位基因数Numberofobservedallele有效等位基因数Numberofeffectiveallele观测杂合度Observedheterozygosity期望杂合度ExpectedheterozygosityShannon多样性指数ShannondiversityindexNei’s基因多样性指数Nei’sgenediversityindex杂交授粉子代群体Progenypopulationofhybridpollination SM1×RL164.23.10.56920.70091.19280.6308 SM1×FY134.23.10.50000.56650.85570.5038 SM2×RL104.03.10.46150.67181.13490.6046 SM3×FY242.92.30.42690.54930.87700.4929 SM4×JX73.82.90.47690.69401.13200.6246 SM4×RL53.22.40.35000.62810.98820.5628 SM5×JX123.22.70.40340.65661.16480.6216 均值Mean3.62.80.45540.63821.04930.5773自由授粉子代群体Progenypopulationoffreepollination FSM1182.41.90.40000.57780.86250.5200 FSM2132.52.10.23080.35730.57690.3215 FSM3103.32.40.32370.53750.90340.5053 FSM4162.82.30.40000.65130.97380.5862 FSM573.02.50.13850.52630.75220.4712 均值Mean2.82.30.29860.53000.81380.4808杂交亲本群体Hybridparentpopulation JX224.03.20.40760.59441.08990.5706 RL274.23.10.35150.60341.10920.5825 FY153.22.50.27690.57830.91590.5196 SM53.22.70.29230.62910.97350.5662 均值Mean3.62.90.33210.60131.02210.5597
1)SM1-SM5: 5株母本单株,采自浙江遂昌神龙谷国家森林公园 Five individuals of female parent collected from Shenlonggu National Forest Park in Suichang of Zhejiang; RL: 父本,采自湖南沅陵杜家坪乡 Male parent collected from Dujiaping Township in Yuanling of Hu’nan; FY: 父本,采自浙江富阳黄公望森林公园 Male parent collected from Huanggongwang Forest Park in Fuyang of Zhejiang; JX: 父本,采自江西分宜树木园林场 Male parent collected from Shumuyuan Tree Farm in Fenyi of Jiangxi; FSM1-FSM5: 5株母本单株自由授粉的子代群体 Progeny populations of free pollination of five female parent individuals.
由表2可见:在7个杂交授粉子代群体中,SM1×RL和SM1×FY杂交授粉子代群体的Na值相同且最高(4.2),而SM3×FY杂交授粉子代群体的Na值则最低(2.9),平均值为3.6;SM1×RL杂交授粉子代群体的Ne值最高、SM3×FY杂交授粉子代群体的Ne值最低,分别为3.1和2.3,平均值为3.6。7个杂交授粉子代群体的观测杂合度(Ho)为0.350 0~0.569 2,平均值为0.455 4;期望杂合度(He)介于0.549 3~0.700 9,平均值为0.638 2。He和Shannon多样性指数(I)以及Nei’s基因多样性指数(h)在各杂交授粉子代群体间的大小顺序并不完全相同,总体上看, SM1×RL杂交授粉子代群体的He、I和h指数最高,SM1×FY和SM3×FY杂交授粉子代群体的He、I和h指数较低;7个杂交授粉组合I和h的平均值分别为1.049 3和0.577 3。说明各杂交授粉子代群体间的多态性水平差异较大。
由表2还可见:自由授粉子代群体的He、I和h的平均值分别为0.530 0、0.813 8和0.480 8,各杂交亲本群体的He、I和h的平均值分别为0.601 3、1.022 1和0.559 7。与杂交授粉子代群体及杂交亲本群体相比,自由授粉子代群体的Na、Ne、He、I和h5项遗传多样性指标的平均值均最低。比较结果表明,杂交授粉子代群体的遗传多样性水平最高,且与杂交亲本群体的遗传多样性差异较小,而自由授粉子代群体的遗传多样性水平最低。
2.2 厚朴杂交亲本群体间的Nei’s遗传距离及其与杂交授粉子代群体遗传多样性的相关性分析
根据厚朴亲本群体13个等位基因频率计算7个杂交授粉子代群体亲本间的Nei’s遗传距离,计算结果表明:SM5×JX杂交组合亲本间的Nei’s遗传距离最大(为1.181 1),SM1×RL杂交组合亲本间的Nei’s遗传距离最小(为0.576 2),而SM3×FY、SM1×FY、SM4×JX、SM2×RL和SM4×RL杂交组合亲本间的Nei’s遗传距离分别为0.600 2、0.862 1、0.733 0、0.651 6和0.769 3。
对杂交亲本群体间的Nei’s遗传距离与杂交授粉子代群体的遗传多样性进行相关性分析,结果见图1。相关性分析结果显示:厚朴杂交授粉子代群体的遗传多样性与其亲本群体间的Nei’s遗传距离呈正相关,表现为随亲本群体间Nei’s遗传距离的增大、杂交授粉子代群体的遗传多样性缓慢增加;但相关性不显著(P>0.05),相关系数(R)仅为0.392 4。

图1 厚朴杂交授粉子代群体的遗传多样性与其亲本群体间Nei’s遗传距离的相关性分析
Fig.1 Analysis on correlation between genetic diversity of progeny populations of hybrid pollination and Nei’s genetic distance of parent populations ofMagnoliaofficinalisRehd. et Wils.
2.3 厚朴杂交授粉子代群体间的Nei’s遗传距离和遗传一致度分析
根据SSR标记分析结果计算7个厚朴杂交授粉子代群体间的Nei’s遗传距离和遗传一致度,结果见表3。7个杂交授粉子代群体间的Nei’s遗传距离介于0.274 9~0.804 6之间,其中SM1×RL和SM2×RL这2个杂交授粉子代群体间的Nei’s遗传距离最小,而SM3×FY和SM5×JX这2个杂交授粉子代群体间的Nei’s遗传距离最大。7个厚朴杂交授粉子代群体间的遗传一致度的变化幅度小于Nei’s遗传距离,介于0.446 4~0.759 6之间,其中SM1×RL和SM2×RL这2个杂交授粉子代群体间的遗传一致度最大,而SM3×FY和SM5×JX这2个杂交授粉子代群体间的遗传一致度最小。综合分析结果显示:具有同一父本的杂交授粉子代群体间的遗传距离最小、遗传一致度最大,而父本及母本均不同的杂交授粉子代群体间的遗传距离最大、遗传一致度最小。
2.4 厚朴杂交亲本与杂交和自由授粉子代群体的聚类分析
依据SSR标记分析结果计算的Nei’s遗传距离对厚朴5株母本、3个父本群体及7个杂交授粉子代群体和5个自由授粉子代群体进行聚类分析,结果见图2。
由图2可见:在Nei’s遗传距离为0.93处,供试亲本及子代群体可以分为3类,第Ⅰ类包括自由授粉子代群体FSM1、 FSM2、 FSM3、 FSM4和FSM5,杂交授粉子代群体SM5×JX,父本群体JX和FY以及母本单株SM1;第Ⅱ类包括杂交授粉子代群体SM1×RL、SM2×RL、SM4×RL、SM1×FY、SM3×FY和SM4×JX,父本群体RL和母本单株SM2;第Ⅲ类仅包含母本单株SM3、SM4和SM5。其中,第Ⅱ类主要为杂交授粉子代群体,可进一步分为3个亚类,SM1×RL、SM2×RL、SM4×RL和RL为第1亚类,均拥有同一父本群体RL;SM1×FY、SM3×FY和SM4×JX为第2亚类;母本SM2单独为一组,即第3亚类。
表3 厚朴杂交授粉子代群体间的Nei’s遗传距离和遗传一致度
Table 3 Nei’s genetic distance and genetic identity among progeny populations of hybrid pollination ofMagnoliaofficinalisRehd. et Wils.
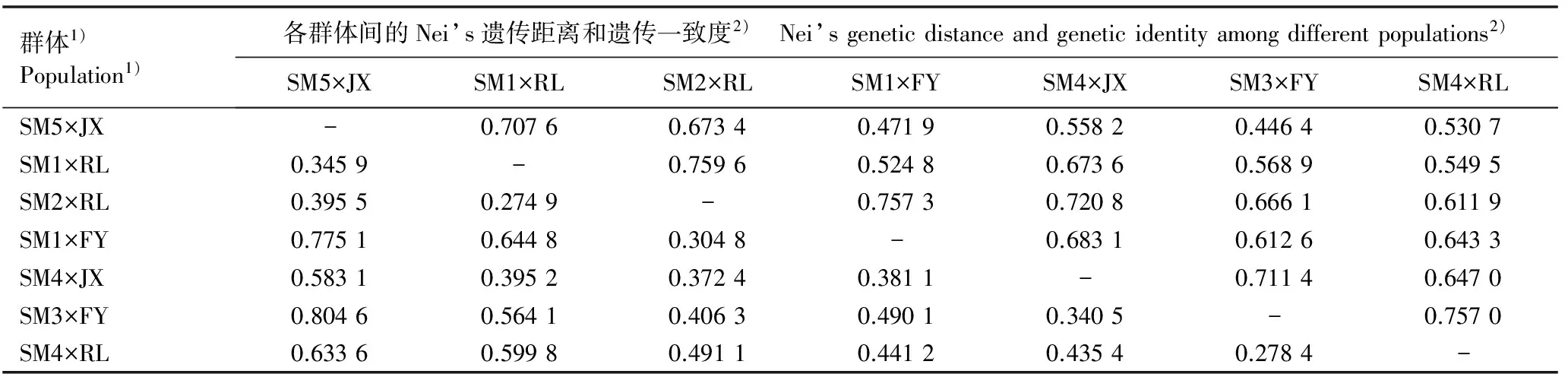
群体1)Population1)各群体间的Nei’s遗传距离和遗传一致度2) Nei’sgeneticdistanceandgeneticidentityamongdifferentpopulations2)SM5×JXSM1×RLSM2×RLSM1×FYSM4×JXSM3×FYSM4×RLSM5×JX-0.70760.67340.47190.55820.44640.5307SM1×RL0.3459-0.75960.52480.67360.56890.5495SM2×RL0.39550.2749-0.75730.72080.66610.6119SM1×FY0.77510.64480.3048-0.68310.61260.6433SM4×JX0.58310.39520.37240.3811-0.71140.6470SM3×FY0.80460.56410.40630.49010.3405-0.7570SM4×RL0.63360.59980.49110.44120.43540.2784-
1)SM1-SM5: 5株母本单株,采自浙江遂昌神龙谷国家森林公园 Five individuals of female parent collected from Shenlonggu National Forest Park in Suichang of Zhejiang; RL: 父本,采自湖南沅陵杜家坪乡 Male parent collected from Dujiaping Township in Yuanling of Hu’nan; FY: 父本,采自浙江富阳黄公望森林公园 Male parent collected from Huanggongwang Forest Park in Fuyang of Zhejiang; JX: 父本,采自江西分宜树木园林场 Male parent collected from Shumuyuan Tree Farm in Fenyi of Jiangxi.
2)遗传一致度和Nei’s遗传距离分别位于横线上、下方 Genetic identity and Nei’s genetic distance are located above and under the line, respectively.

SM1-SM5: 5株母本单株,采自浙江遂昌神龙谷国家森林公园 Five individuals of female parent collected from Shenlonggu National Forest Park in Suichang of Zhejiang; RL: 父本,采自湖南沅陵杜家坪乡 Male parent collected from Dujiaping Township in Yuanling of Hu’nan; FY: 父本,采自浙江富阳黄公望森林公园 Male parent collected from Huanggongwang Forest Park in Fuyang of Zhejiang; JX: 父本,采自江西分宜树木园林场 Maleparentcollectedfrom Shumuyuan Tree Farm in Fenyi of Jiangxi; SM5×JX, SM1×RL, SM2×RL, SM1×FY, SM4×JX, SM3×FY, SM4×RL: 分别为杂交授粉子代群体Progeny populations of hybrid pollination, respectively; FSM1-FSM5: 5株母本单株自由授粉的子代群体 Progeny populations of free pollination of five female parent individuals.
图2 基于SSR标记的厚朴杂交和自由授粉子代群体及其亲本群体的聚类分析
Fig. 2 Cluster analysis on progeny populations of hybrid and free pollinations and their parent populations ofMagnoliaofficinalisRehd. et Wils. based on SSR marker
3 讨论和结论
厚朴为第三纪孑遗物种[25],其祖先拥有丰富的遗传变异,但受第四纪冰川的影响,其分布范围逐渐减少,只有少数群体仍分布于中国的长江流域以及陕西和甘肃南部等地区[26]。由于厚朴自身的结实率和萌发率均较低,加之过度采挖等人为因素的影响,目前厚朴居群水平的遗传多样性远低于其物种水平的遗传多样性[12,14]。赵宏波等[27]认为,远交及混合花粉均能够增加厚朴的结实率,即提高其繁殖成功率,增强其对环境的适应性,有利于厚朴居群遗传多样性的恢复,促进其居群规模的恢复和扩大。本研究中,采用SSR标记分析厚朴杂交亲本以及杂交和自由授粉子代群体的遗传多样性(包括观测等位基因数、有效等位基因数、观测杂合度、期望杂合度、Shannon多样性指数和Nei’s基因多样性指数),其中,杂交授粉子代群体的遗传多样性指标大多高于其亲本,而自由授粉子代群体的遗传多样性指标则低于其亲本,且杂交授粉子代群体的遗传多样性指标均明显高于其自由授粉子代群体。说明在野生状态下厚朴居群内的遗传多样性水平较低,而居群间的杂交授粉能够提高子代的遗传多样性水平,说明通过人为控制杂交授粉可加速厚朴居群间的基因交流,并有效提高厚朴居群的遗传多样性。
一般来说,杂交亲本间的Nei’s遗传距离越大、遗传相似度越小,其杂交授粉子代的遗传多样性越高,本研究结果也基本上验证了这一观点。但是,虽然本研究中供试厚朴杂交亲本群体的Nei’s遗传距离与杂交授粉子代群体的遗传多样性呈正相关,但其相关性并未达到显著水平(R=0.392 4,P>0.05),造成这一结果的原因可能是杂交授粉子代群体的遗传多样性不仅取决于亲本的Nei’s遗传距离,还与父本和母本各自的遗传组成有关,同时还可能受到DNA重组的影响,即二倍体或多倍体植物减数分裂时发生同源染色体之间的交换或转换,通过打破遗传连锁而影响群体的DNA多态性[28]。由于根据形态标记、生化标记和分子标记等估算出的亲本间的Nei’s遗传距离只能反映亲本间的平均遗传差异状况,而不能确切指出某个基因位点的同质性或异质性[29],因此,亲本间的遗传距离并非是影响杂交授粉子代遗传多样性的主要因素。有研究结果[30-31]表明:杂交亲本间的遗传距离与杂交授粉子代遗传多样性的相关性不仅表现在分子水平上,更表现在表型性状上,杂交亲本间的遗传距离与杂交授粉子代的表型性状呈显著正相关;也有学者[32-34]认为杂交亲本间的遗传距离与杂交授粉子代的表型性状虽然存在相关性,但相关程度较低。由于本研究过程中获得的厚朴杂交和自由授粉的种子数量较少且播种后出苗率较低,加之后期生长过程中不良天气对幼苗生长的影响等原因,造成最终获得的厚朴子代幼苗数量极少,无法满足其表型性状统计分析的需求,因此,后续实验将进一步开展表型性状的相关研究。
聚类分析结果表明:虽然大部分母本单株间的亲缘关系较近,但在获得的7个厚朴杂交授粉子代群体中,有6个杂交授粉子代群体与其父本有较近的亲缘关系,这可能与本实验采用同一居群内多个父本单株混合花粉授粉有关。由于父本的遗传变异较丰富,因此,在亲本遗传信息融合和基因重组过程中,父本的遗传信息能够更多地传递给后代;而母本亲缘关系较近可能与其地理位置有关,供试5株母本单株均位于浙江遂昌神龙谷国家森林公园的山坳地带,周围有山体阻隔,加上其主要依赖动物进行种子传播,导致这5株母本单株很可能来源于同一祖先个体。韩国辉等[35]对沙田柚(Citrusmaxima‘Shatianyou’)群体间和群体内杂交后代的遗传分析结果也表明:群体内杂交较群体间杂交的基因交流更加充分,从而使其多数杂种偏向父本遗传。因此,在对厚朴进行控制授粉时,可考虑增加父本的个体数量,使父本的遗传信息更加丰富。值得一提的是,本研究中,有个别杂交后代群体(如SM5×JX)的聚类结果与上述理论不一致,推测这可能是由于在细胞分裂过程中发生了较大的染色体重组所致。
目前,用于度量植物遗传多样性的参数(包括Na、Ne、Ho、He、I和h等)主要基于物种或居群水平,尚未见用于度量栽培植物组合(家系)遗传多样性参数的研究报道,因而没有适合度量杂交组合遗传多样性的参数可供借鉴。本研究中,作者借鉴部分植物居群遗传参数评价厚朴杂交授粉子代群体及其亲本间的遗传多样性,由于人工授粉属于非自然状态下的基因流,因此用于评价植物居群遗传多样性的指标是否完全适用于杂交授粉子代群体的遗传多样性分析,还需进一步探讨。
经过人工授粉的厚朴杂交授粉子代群体的遗传多样性水平高于其自由授粉子代群体和亲本,表明人工授粉能够促进厚朴居群间的基因交流,利于保护和恢复厚朴居群的遗传多样性。在实际工作中,还可适当进行引种栽培,将来自不同群体的厚朴种子、幼苗或植株进行交叉种植,增加其自然异交的几率,以产生远交后代,提高厚朴群体的遗传多样性。
[1] 初 敏, 丁立文, 刘 红, 等. 厚朴商品资源概述[J]. 中草药, 2003, 34(6): 14-15.
[2] 傅立国. 中国植物红皮书: 稀有濒危植物(第一册)[M]. 北京: 科学出版社, 1992.
[3] 高德强, 王乃江, 刘建军. 厚朴人工林优树选择研究[J]. 北方园艺, 2013(17): 161-165.
[4] 胡凤莲. 厚朴的栽培管理技术及应用[J]. 陕西农业科学, 2012(4): 257-259.
[5] PARK E J, ZHAO Y Z, NA M K, et al. Protective effects of honokiol and magnolol on tertiary butyl hydroperoxide- orD-galactosamine-induced toxicity in rat primary hepatocytes[J]. Planta Medica, 2003, 69(1): 33-37.
[6] 蒋燕峰, 潘心禾, 朱 波, 等. 厚朴酚类物质含量层次变异规律研究[J]. 中国中药杂志, 2010, 35(22): 2963-2966.
[7] 王晓明, 杨硕知, 裴 刚, 等. 凹叶厚朴树体厚朴酚和厚朴酚含量变化模型的研究[J]. 中南林业科技大学学报, 2012, 32(2): 1-5.
[8] ZHAO C, LIU Z Q. Comparison of antioxidant abilities of magnolol and honokiol to scavenge radicals and to protect DNA[J]. Biochimie, 2011, 93(10): 1755-1760.
[9] KIM S J, KWON D Y, KIM Y S, et al. Peroxyl radical scavenging capacity of extracts and isolated components from selected medicinal plants[J]. Archives of Pharmacal Research, 2010, 33(6): 867-873.
[10] 傅 强, 马占强, 杨 文, 等. 厚朴酚对慢性温和刺激所致抑郁小鼠的抗抑郁作用研究[J]. 中药药理与临床, 2013, 29(2): 47-51.
[11] 王 洁, 杨志玲, 杨 旭, 等. 不同花期厚朴雌雄蕊和花瓣香气组成成分的分析和比较[J]. 植物资源与环境学报, 2011, 20(4): 42-48.
[12] 郑志雷. 厚朴遗传多样性研究及指纹图谱的构建[D]. 福州: 福建农林大学林学院, 2010.
[13] HE J, CHEN L, SI Y, et al. Population structure and genetic diversity distribution in wild and cultivated populations of the traditional Chinese medicinal plantMagnoliaofficinalissubsp.biloba(Magnoliaceae)[J]. Genetica, 2009, 135(2): 233-243.
[14] 于华会, 杨志玲, 刘若楠, 等. 四川六个厚朴种群遗传结构[J]. 生态学杂志, 2010, 29(11): 2168-2174.
[15] 杨 旭, 杨志玲, 王 洁, 等. 濒危植物凹叶厚朴的花部综合特征和繁育系统[J]. 生态学杂志, 2012, 31(3): 551-556.
[17] 熊 敏, 田 双, 张志荣, 等. 华木莲居群遗传结构与保护单元[J]. 生物多样性, 2014, 22(4): 476-484.
[18] 王 霞, 王 静, 蒋敬虎, 等. 观光木片断化居群的遗传多样性和交配系统[J]. 生物多样性, 2012, 20(6): 676-684.
[19] 李美琼. 濒危植物长柄双花木的遗传多样性[D]. 南昌: 南昌大学生命科学与食品工程学院, 2011.
[20] 朱其卫, 李火根. 鹅掌楸不同交配组合子代遗传多样性分析[J]. 遗传, 2010, 32(2): 183-188.
[21] KIKUCHI S, ISAGI Y. Microsatellite genetic variation in small and isolated populations ofMagnoliasieboldiissp.japonica[J]. Heredity, 2002, 88(4): 313-321.
[22] ISAGI Y, TATENO R, MATSUKI Y, et al. Genetic and repro-ductive consequences of forest fragmentation for populations ofMagnoliaobovata[J]. Ecological Research, 2007, 22(3): 382-389.
[23] SETSUKOS,ISHIDAK, UENOS, etal.Population differ-entiation and gene flow within a metapopulation of a threatened tree,Magnoliastellata(Magnoliaceae)[J]. American Journal of Botany, 2007, 94(1): 128-136.
[24] 梁宏伟, 王长忠, 李 忠, 等. 聚丙烯酰胺凝胶快速、高效银染方法的建立[J]. 遗传, 2008, 30(10): 1379-1382.
[25] 蒋志刚. 陕西青木川自然保护区的生物多样性[M]. 北京: 清华大学出版社, 2005.
[26] 中国科学院中国植物志编辑委员会. 中国植物志: 第三十卷第一分册[M]. 北京: 科学出版社, 2004: 119.
[27] 赵宏波, 周莉花, 郝日明, 等. 中国特有濒危植物夏蜡梅的交配系统[J]. 生态学报, 2011, 31(3): 602-610.
[28] 王云生, 黄宏文, 王 瑛. 植物分子群体遗传学研究动态[J]. 遗传, 2007, 29(10): 1191-1198.
[29] 李周岐, 王章荣. 用RAPD标记进行鹅掌楸杂种识别和亲本选配[J]. 林业科学, 2002, 38(5): 169-174.
[30] 张 一, 储德裕, 金国庆, 等. 马尾松亲本遗传距离与子代生长性状相关性分析[J]. 林业科学研究, 2010, 23(2): 215-220.
[31] JOSÉM A, IBAN E, SILVIA A, et al. Inheritance mode of fruit traits in melon: heterosis for fruit shape and its correlation with genetic distance[J]. Euphytica, 2005, 144(1): 31-38.
[32] YU C Y, HU S W, ZHAO H X, et al. Genetic distances revealed by morphological characters, isozymes, proteins and RAPD markers and their relationships with hybrid performance in oilseed rape (BrassicanapusL.)[J]. Theoretical and Applied Genetics, 2005, 110(3): 511-518.
[33] 李 梅, 施季森, 甘四明, 等. 杉木杂交亲本分子遗传变异与子代生长相关的研究[J]. 林业科学研究, 2001, 14(1): 35-40.
[34] KOPP R F, SMART L B, MAYNARD C A, et al. Predicting within-family variability in juvenile height growth ofSalixbased upon similarity among parental AFLP fingerprints[J]. Theoretical and Applied Genetics, 2002, 105(1): 106-112.
[35] 韩国辉, 向素琼, 汪卫星, 等. 沙田柚杂交后代群体的SSR鉴定与遗传多样性分析[J]. 中国农业科学, 2010, 43(22): 4678-4686.
(责任编辑: 佟金凤)
Analysis on genetic diversity of populations of parents and their progenies ofMagnoliaofficinalisbased on SSR marker
MAI Jing, YANG Zhiling①, YANG Xu, WANG Li’na
(Key Laboratory of Tree Breeding of Zhejiang Province, Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Fuyang 311400, China ),J.PlantResour. &Environ., 2015, 24(3): 10-17
Seven progeny populations of hybrid pollination were obtained by taking five individuals ofMagnoliaofficinalisRehd. et Wils. collected from Suichang of Zhejiang as female parents, and populations ofM.officinaliscollected from Pan’an and Fuyang of Zhejiang, Fenyi of Jiangxi and Yuanling of Hu’nan as male parents. And five female parent individuals were free pollinated and five progeny populations of free pollination were obtained. On this basis, genetic diversity of parent populations and progeny populations of hybrid and free pollinations ofM.officinaliswere analyzed by SSR marker technology. The results show that length of bands amplified by 13 pairs of SSR primer are 105-297 bp, 54 alleles are detected totally, and observed and effective allele numbers at each locus are 4.2 and 2.6, respectively. Overall, genetic diversity of progeny population of hybrid pollination is the highest, averages of its Shannon diversity index (I), Nei’s gene diversity index (h) and expected heterozygosity (He) are 1.049 3, 0.577 3 and 0.638 2, respectively; genetic diversity of parent population is slightly lowerthanthat of progenypopulationof hybrid pollination, averages of itsI,handHeare 1.022 1, 0.559 7 and 0.601 3, respectively; and genetic diversity of progeny population of free pollination is the lowest, averages of itsI,handHeare 0.813 8, 0.480 8 and 0.530 0, respectively. Nei’s genetic distance between parents of seven progeny populations of hybrid pollination is 0.576 2-1.181 1, and there is positive correlation between Nei’s genetic distance and genetic diversity of progeny populations of hybrid pollination, but the correlation is not significant (R=0.392 4). Nei’s genetic distance and genetic identity among seven progeny populations of hybrid pollination are 0.274 9-0.804 6 and 0.446 4-0.759 6, respectively. In which, genetic identity among progeny populations of hybrid pollination from the same male parent is the highest, and the greater the Nei’s genetic distance, the smaller the genetic identity. The cluster analysis result shows that at Nei’s genetic distance 0.93, five female parent individuals, three male parent populations, seven progeny populations of hybrid pollination and five progeny populations of free pollination tested can be divided into three categories, in which, there is a close relationship between progeny populations of hybrid pollination from the same male parent and their male parent populations. It is suggested that level of genetic diversity of progeny populations of hybrid pollination ofM.officinalisis obviously higher than that of progeny populations of free pollination, and is higher generally than that of parents, meaning that hybrid pollination can accelerate gene exchange among populations and rich population genetic diversity ofM.officinalis.
MagnoliaofficinalisRehd. et Wils.; SSR marker; hybrid pollination; genetic diversity; Nei’s genetic distance; cluster analysis
2015-01-23
国家自然科学基金资助项目(31270585)
麦 静(1990—),女,广西南宁人,硕士研究生,主要从事药用植物保护方面的研究。
①通信作者 E-mail: zlyang0002@126.com
Q946-33; S567.1+1
A
1674-7895(2015)03-0010-08
10.3969/j.issn.1674-7895.2015.03.02
