携带psm-mec基因耐甲氧西林表皮葡萄球菌的耐药谱研究
2015-06-23杨永长肖代雯胡洪华黄文芳四川省医学科学院四川省人民医院检验科四川成都610072
杨永长,肖代雯,喻 华,姜 伟,陈 亮,胡洪华,周 薇,黄文芳(四川省医学科学院·四川省人民医院检验科,四川 成都 610072)
携带psm-mec基因耐甲氧西林表皮葡萄球菌的耐药谱研究
杨永长,肖代雯,喻 华,姜 伟,陈 亮,胡洪华,周 薇,黄文芳
(四川省医学科学院·四川省人民医院检验科,四川 成都 610072)
目的 比较携带与未携带psm-mec基因耐甲氧西林表皮葡萄球菌(MRSE)的耐药谱,为治疗MRSE引起的感染提供理论依据。方法 收集临床分离并经过全自动微生物奠定系统准确鉴定的表皮葡萄球菌(Staphylococcus epidermidis,S.epidermidis)165株,通过PCR扩增esp和mecA基因,准确鉴定和区分甲氧西林敏感表皮葡萄球菌(MSSE)和MRSE。扩增psm-mec,fudoh和p221片段确认携带psm-mec基因的MRSE菌株,比较分析携带与未携带psm-mec 基因MRSE的耐药谱。结果 83.64%的临床分离S.epidermidis为MRSE,其中29株携带psm-mec基因,携带率为17.58%,且仅分布于MRSE中。临床分离MRSE易对苯唑西林、青霉素、红霉素、复方新诺明和克林霉素耐药,未发现对利奈唑胺、呋喃妥因、普丁/达福、万古霉素和替加环素耐药菌株。携带psm-mec基因MRSE对环丙沙星、庆大霉素、利福平和复方新诺明的耐药率明显高于未携带psm-mec基因MRSE。结论 携带psm-mec基因MRSE易对苯唑西林、青霉素、红霉素、克林霉素、环丙沙星、庆大霉素、利福平和复方新诺明耐药。
耐甲氧西林表皮葡萄球菌;psm-mec;耐药谱
表皮葡萄球菌(Staphylococcus epidermidis,S.epidermidis)是人体皮肤正常菌,可引起慢性感染和导管相关性感染,难以治愈,已引起医学界广泛关注[1~6]。甲氧西林耐药是院内感染S.epidermidis的主要特征之一,从全球范围来看,临床分离耐甲氧西林表皮葡萄球菌(MRSE)占75%~90%[7]。国外研究发现,引起院内感染的S.epidermidis常对氨基糖苷类和大环内酯类抗生素、四环素、氯霉素和克林霉素耐药,但对新出现的抗生素均敏感[2]。虽然出现了万古霉素中介菌株,但高水平万古霉素耐药菌株的传播尚未见报道[8]。近年来,研究者发现SCCmec III型和IV型与抗生素耐药谱之间存在一定关系[9]。前期预实验研究提示,携带psm-mec基因MRSE的SCCmec型别主要为以II型和/或III型为主要结构的混合型。我们猜想,携带psm-mec基因的MRSE可能表现出特有的抗生素敏感性。因此,本研究收集临床分离S.epidermidis,采用分子生物学方法区分和鉴定携带psm-mec基因MRSE,通过药敏结果分析携带psm-mec基因MRSE的耐药谱,为临床治疗MRSE引起的感染提供理论依据。
1 资料与方法
1.1 菌株来源 2012年3月至2014年3月四川省人民医院住院患者分离的165株S.epidermidis,所有菌株采用全自动微生物鉴定系统鉴定,其中血液分离128株,痰液分离15株,中段尿液分离5株,伤口分泌物分离7株。
1.2 试剂和仪器 细菌DNA提取试剂(广州达安);2×Taq Master Mix(北京康为世纪);100 bp DNA Ladder (北京天根);血平板(郑州安图生物);琼脂糖(Biowest),Tris碱(Novon);PCR扩增仪PTC-200、凝胶成像仪(Bio-Rad);生物安全柜、细胞培养箱(Heal Force);电泳仪(Sanvant);紫外分光光度计、高速低温离心机(Eppendorf);esp、mecA、psm-mec、fudoh和p221片段扩增的引物由上海Invitrogen公司合成。
1.3 细菌培养与基因组DNA提取 接种单个菌落至3 ml LB液体培养基,37 ℃ 220rpm培养过夜。取1 ml菌液,离心收集细菌,弃上清。沉淀加入100 μl DNA提取液,100 ℃ 10 min,10000 rpm离心5 min,上清即为S.epidermidisDNA,-20 ℃保存备用。
1.4 PCR扩增esp和mecA区分MRSE和MSSE
采用PCR扩增esp和mecA进一步区分MRSE和MSSE。esp基因的引物序列为esp F:5'-CCAGGGTAACCAGTAACAGT-3',esp R:5'-GAGCTAAGGGTAA TCCAAGA-3',PCR产物长度为244 bp;反应体系:2×Taq Master Mix 10 μl,10 μM上下游引物各1 μl,模板DNA 2 μl,ddH2O 6 μl。反应条件:93 ℃预变性2 min,93 ℃变性30 s,42 ℃退火30s,72 ℃延伸30 s,进行30个循环,最后72 ℃延伸2mim。mecA基因的引物序列为mecAF:5'-GGGATCATAGCGTCATTA TTC-3',mecAR:5'-AACGATTGTGACACGATAGCC-3',PCR产物长度为527bp。反应体系:2×Taq Master Mix 10 μl,10 μM上下游引物各1 μl,模板DNA 2 μl,ddH2O 6 μl。反应条件:94 ℃预变性3 min;94 ℃变性30 s,44 ℃退火30 s,72 ℃延伸30s,进行30个循环;最后72 ℃延伸3 min。PCR产物经1.5%琼脂糖凝胶电泳后Bio-Rad凝胶成像仪检测。
1.5 扩增psm-mec,fudoh和p221基因片段 MRSE psm-mec引物序列为:psm-mec F 5′-CGAAAGCCTGAA TGCAAGTCT-3′,psm-mec R5′-GGATTTCACTGGTGTTATTACAAGC-3′,产物大小为130 bp。反应体系:2×Taq Master Mix 5 μl,上下游引物各0.25 μl,DNA 1.5 μl,ddH2O 3 μl。反应条件:95 ℃预变性3 min,95 ℃变性30 s,42 ℃退火30 s,72 ℃延伸30s,进行30个循环,最后72 ℃延伸5mim。fudoh基因位于SCCmec上,序列包含psm-mec全长及其上下游区域,fudoh基因扩增引物序列F:5′-CAATTCACTTGTCTTAA ACTTTGTAGAAAA AGAAG-3,R:5′-TATTTTATTTTCCATAATTGCCTACCC CATAAG-3′,产物大小为530bp。反应体系:2×Taq Master Mix 10 μl,上下游引物各1 μl,DNA 2 μl,ddH2O 6 μl。反应条件:95 ℃预变性3 min,95 ℃变性30 s,48 ℃退火30 s,72 ℃延伸30 s,30个循环,最后72 ℃延伸5 min。产物经1%琼脂糖凝胶电泳后Bio-Rad凝胶成像仪检测。
1.6 抗生素敏感试验 采用BioMerieux药敏分析系统进行药敏实验,比较携带与未携带psm-mec MRSE耐药谱的差异。
1.7 统计学方法 采用SPSS 16.0统计软件进行数据处理。计数资料比较采用卡方检验。P< 0.05为差异有统计学意义。
2 结果
2.1 临床分离细菌 PCR扩增产物电泳结果显示,165株临床分离细菌均可扩增出esp基因片段,说明这些菌株均为S.epidermidis,与临床微生物学鉴定相符。mecA阳性138株,mecA阴性27株。提示MRSE占临床分离S.epidermidis的83.64%。其中血液、痰液、尿液和伤口分泌物分离MRSE分别占65.45%、6.06%、3.03%和3.03%,提示不同来源分离的S.epidermidis均以MRSE为主(图1)。
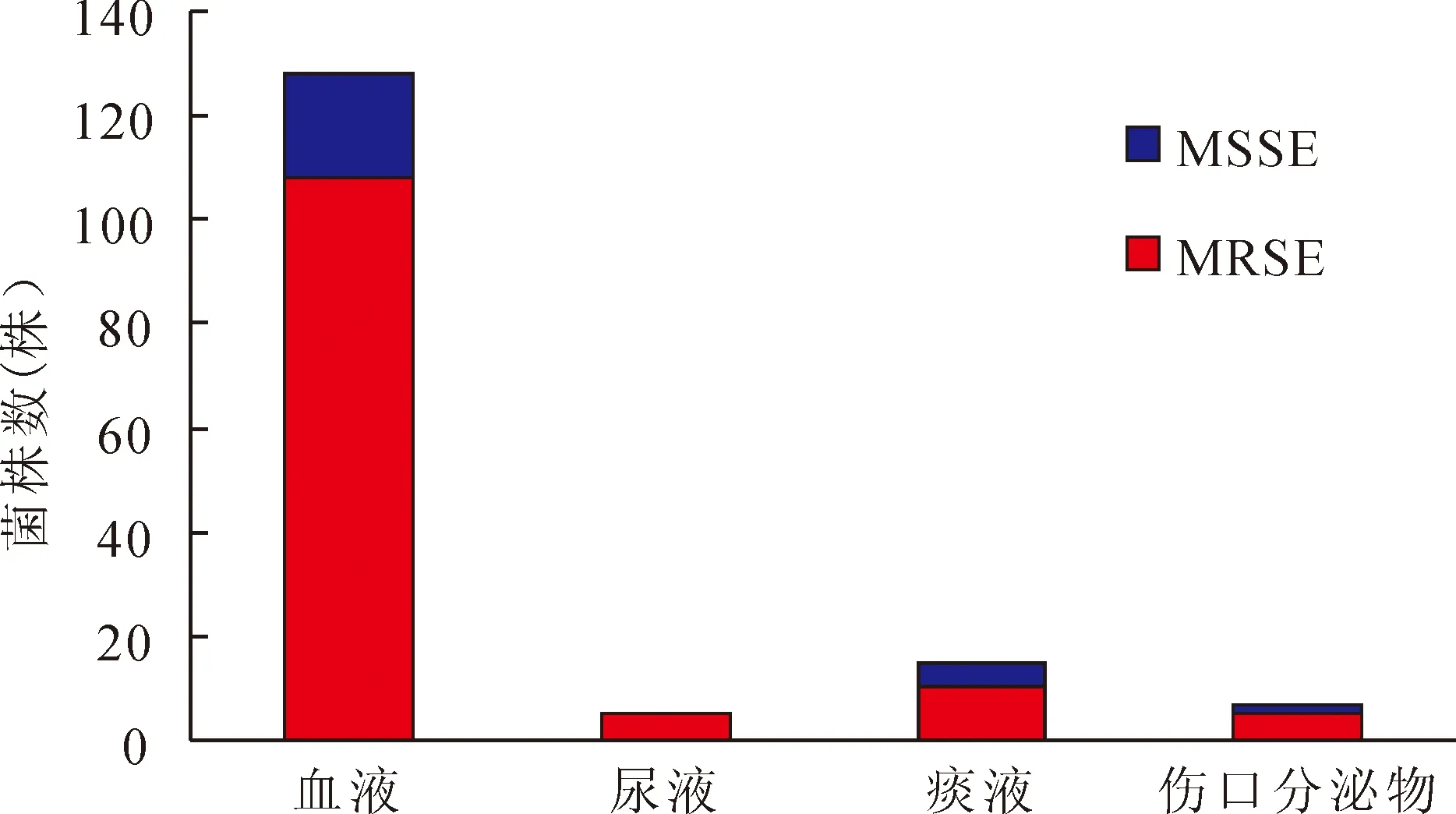
图1 不同标本来源MRSE和MSSE分布情况
2.2 携带psm-mec基因MRSE的筛选和验证 PCR扩增psm-mec、fudoh基因和p221片段的凝胶电泳结果如图2所示,165株临床分离S.epidermidis中有29株均可扩增出psm-mec、fudoh基因和p221片段,携带率为17.58%。进一步分析发现,所有psm-mec阳性标本均存在MRSE中,而27株MSSE未扩增出psm-mec,提示psm-mec基因仅存在MRSE中。

图2 psm-mec fudoh、p221 PCR扩增凝胶电泳结果 1:MSSE菌株;2:携带psm-mec 的MRSE菌株;3:携带psm-mec 的MRSE菌株;4:100bp DNA Ladder;5:fudoh 阳性菌株;6:p221 阳性菌株;7:psm-mec 阳性菌株
2.3 MRSE的耐药谱 药敏试验结果显示,59株MRSE中,未发现对利奈唑胺、呋喃妥因、普丁/达福、万古霉素、替加环素耐药菌株,苯唑西林(100%)、青霉素(100%)、红霉素(89.83%)、复方新诺明(72.88%)与克林霉素(71.19%)最易耐药,而对环丙沙星、庆大霉素、左氧氟沙星、莫西沙星、四环素的耐药率分别为45.76%、35.60%、11.86%、5.08%、27.12%和22.03%。同时发现15.25%环丙沙星和54.24%左氧氟沙星中介菌株(图3)。
2.4 携带psm-mec基因MRSE的耐药谱 29株携带psm-mec基因MRSE对环丙沙星、庆大霉素、利福平和复方新诺明的耐药率分别为68.97%、58.62%、51.72%和86.21%。30株未携带psm-mec 基因MRSE对环丙沙星、庆大霉素、利福平和复方新诺明的耐药率分别为23.33%、13.33%、3.33%和60.00%(表1)。携带psm-mec基因MRSE对环丙沙星、庆大霉素、利福平以及复方新诺明的耐药性明显高于未携带psm-mec 基因MRSE。

图3 不同菌株药物敏感性结果

表1 携带与未携带psm-mec 基因MRSE的耐药谱分析
3 讨论
定植人体皮肤表面的S.epidermidis是一种重要的院内感染条件致病菌,免疫抑制患者中大部分慢性感染和导管相关感染均由S.epidermidis引起[1]。在美国,22% ICU患者的血流感染和13%人造瓣膜心内膜炎归咎于S.epidermidis。据估计,每年用于治疗S.epidermidis感染的费用大约需要20亿美元[2]。我国一项涉及15个城市、17家医院的调查显示,80%以上临床分离S.epidermidis为MRSE[3]。近年来,MRSE的检出率越来越高,已成为全球院内感染的重要病原菌[4,5]。
甲氧西林耐药由可移动遗传元件SCCmec介导,2009年Queck等[12]在院内感染甲氧西林耐药金黄色葡萄球菌(MRSA)中发现一种新基因psm-mec,同时携带该基因的菌株主要为SCCmec II型与III型。预实验结果显示,该基因也存在院内感染MRSE中,且主要以SCCmecII和/或III型结构为主。研究发现,某些型别的SCCmec具有独特的抗生素耐药谱[11]。我们推测携带psm-mec基因的MRSE在抗生素敏感性上具有一定的特征。
本研究通过PCR扩增psm-mec、fudoh基因和p221片段证实165株临床分离S.epidermidis中,携带psm-mec基因的菌株为29株,在MRSE中占21%。为了探讨携带psm-mec基因MRSE的耐药谱,本文首先分析了临床分离MRSE的耐药情况,结果显示,除利奈唑胺、万古霉素和替加环素等敏感外,其它抗生素均有不同程度耐药,与国内研究结果一致[13~15]。接下来比较了携带和未携带psm-mec基因MRSE在抗生素敏感性上的差异,结果发现,携带psm-mec基因MRSE易对环丙沙星、庆大霉素、利福平和复方新诺明耐药。但其具体的机制仍需进一步研究。
综上所述,临床分离携带psm-mec基因的MRSE在抗生素敏感性上具有明显特征,易对苯唑西林、青霉素、红霉素、克林霉素、环丙沙星、庆大霉素、利福平和复方新诺明耐药,本研究为治疗MRSE引起的感染提供了理论依据。
[1] Otto M.Staphylococcus epidermidis--the 'accidental' pathogen [J].Nat Rev Microbiol,2009,7(8):555-567.
[2] Rogers KL,Fey PD,Rupp ME.Coagulase-negative staphylococcal infections [J].Infect Dis Clin North Am,2009,23(1):73-98.
[3] Xiao YH,Wang J,Li Y.Bacterial resistance surveillance in China:a report from Mohnarin 2004-2005 [J].Eur J Clin Microbiol Infect Dis,2008,27(8):697-708.
[4] Raad I,Hanna H,Maki D.Intravascular catheter-related infections:advances in diagnosis,prevention,and management [J].Lancet Infect Dis,2007,7(10):645-657.
[5] Xu ZB,Shi L,Alam MJ,et al.Integron-bearing methicillin-resistant coagulase-negative staphylococci in South China,2001-2004[J].FEMS Microbiol Lett,2008,278(2):223-230.
[6] Otto M.Molecular basis of Staphylococcus epidermidis infections[J].Semin Immunopathol,2012,34(2):201-214.
[7] 张渊,毛敏,张亚玲,等.血液透析患者股静脉置管导管感染病原菌及治疗效果分析[J].实用医院临床杂志,2012,9(3):87-88.
[8] 刘祥琴,喻华,乔宁,等.2011年四川省人民医院分离致病菌的分布特点和耐药分析[J].实用医院临床杂志,2012,9(6):105-109.
[9] Diekema DJ,Pfaller MA,Schmitz FJ,et al.Survey of infections due to Staphylococcus species:frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States,Canada,Latin America,Europe,and the Western Pacific region for the SENTRY Antimicrobial Surveillance Program,1997-1999[J].Clin Infect Dis,2001,32(Suppl 2):S114-132.
[10]Jones RN.Microbiological features of vancomycin in the 21st century:minimum inhibitory concentration creep,bactericidal/static activity,and applied breakpoints to predict clinical outcomes or detect resistant strains [J].Clin Infect Dis,2006,42(Suppl 1):S13-24.
[11]Iorio NL,Caboclo RF,Azevedo MB,et al.Characteristics related to antimicrobial resistance and biofilm formation of widespread methicillin-resistant Staphylococcus epidermidis ST2 and ST23 lineages in Rio de Janeiro hospitals,Brazil[J].Diagn Microbiol Infect Dis,2012,72(1):32-40.
[12]Queck SY,Khan BA,Wang R,et al.Mobile genetic element-encoded cytolysin connects virulence to methicillin resistance in MRSA [J].PLoS Pathog,2009,5(7):e1000533.
[13]赵艳丰,赵水娣,焦梅,等.2007-2010年表皮葡萄球菌的分布及耐药性分析[J].检验医学与临床,2011,8(22):2767-2768.
[14]蒋景华,王宗欣.2006~2007年表皮葡萄球菌的科室分布及耐药性分析[J].中华医院感染学杂志,2009,19(18):2505.
[15]吴铭,田梅,张杰,等.218例表皮葡萄球菌的耐药性分析[J].中国微生态学杂志,2011,23(5):456.
R446.5
A
1672-6170(2015)06-0031-04
2015-09-07;
2015-09-10)
