ALK7基因敲除对小鼠心电图的影响及可能机制
2015-06-13余太辉胡晓军唐艳红
余太辉 胡晓军 王 鑫 陈 卉 李 乐 唐艳红
ALK7基因敲除对小鼠心电图的影响及可能机制
余太辉 胡晓军 王 鑫 陈 卉 李 乐 唐艳红
目的 探讨ALK7基因敲除对小鼠心电图的影响及可能机制。方法 采用8~10周的C57BL/6的野生型小鼠以及ALK7 基因敲除小鼠,使用自制皮下电极连接Powerlab系统记录9:30~10时小鼠Ⅱ导联心电图,使用Labchart软件直接分析RR间期、HR、PR间期、P波宽度、QRS宽度、QT间期以及QTc,并进一步免疫组化检测PPAR-γ的表达。结果 与正常野生型小鼠相比,ALK7基因敲除小鼠的RR间期、HR、P波脉宽、PR间期、QRS间期无明显差异(P>0.05),然而QT间期明显延长,QTc明显增大(P<0.05)。免疫组化检测ALK7基因敲除小鼠PPAR-γ的阳性表达率显著减少(P<0.05)。结论 ALK7基因敲除小鼠PPAR-γ的减少可能影响小鼠心室复极变化,出现QT间期的延长。
ALK7 QT延长 复极异常
激活素受体样激酶7(ALK7)是转换生长因子-β(TGF-β)超家族的Ⅰ型受体。主要介导GDF-1、GDF-3 、Nodal和Activin B这些配体的生物学效应。ALK7所介导的信号通路在细胞的凋亡与增殖以及组织发育中发挥着重要的作用,并且参与了神经肌肉疾病、内分泌紊乱、肥胖、肿瘤等多种疾病[1~4]。ALK7相关的信号通路对机体有一些重要的调节作用。RGS5基因敲除可引起电压依赖性的钾电流的重构,延长了心脏的复极情况,增加了房性以及室性心律失常的易感性等[5, 6]。由此可见一些基因的异常可能影响心脏离子通道异常从而出现心电图异常及心律失常。ALK7可能通过下游的多个信号通路以及效应因子来调节心脏组织重构和电重构,以及影响了心肌的离子通道的异常,因此可能通过多种效应产生抗心律失常等地一些作用。但ALK7在心血管疾病中的研究,特别是心律失常中的作用及其机制,国内外尚无报道。因此,本实验拟探索ALK7敲除后对心电图可能的影响及机制,为深入认识心律失常的分子调控机制提供理论基础。
材料与方法
1.实验动物:采用C57BL/6 品系的野生型小鼠、ALK7-/-小鼠(C57BL/6背景)各12只,8~10周。饲养环境符合了国家规定的实验条件要求。实验期间小鼠生长良好,饲养和实验过程均遵循武汉大学人民医院所属的动物伦理委员会的规定。
2.主要仪器及试剂:PowerLab数据采集系统及LabChart分析软件(澳大利亚ADInstruments公司), Olympas BX60 光学显微镜,SPOT2型数码照相机,自制皮下电极, 兔抗鼠PPAR-γ一抗、DAB显色剂(美国Sigma公司),羊抗兔二抗、辣根酶链霉素(国产国药试剂公司)。
3.实验方法:(1)心电图的记录:纳入的小鼠被分为ALK7基因敲除小鼠组(ALK7)以及野生小鼠组(WT)。所有小鼠在同一环境温度下,尽量避免噪声干扰影响,小鼠于早上9时开始记录,直接用自制皮下电极记录小鼠清醒状态下标准Ⅱ导联心电图(右上肢连接负电极线,左下肢连接正电极线,左上肢为参比电极)。机器提前预热后,连接Powerlab系统(所有记录模式均采用同一滤波),待心电图稳定后,记录小鼠心电图并做好注释,保存9:30~10:00的心电图。(2)心电图数据分析:使用Labchart软件对记录的心电图信号进行标准化分析获得下列指标:PR间期、HR、RR间期、P波脉宽、QRS脉宽、QT间期值以及QTc (用Bazett′s公式:QTc=QT/RR1/2)。
4.标本采集及免疫组化分析:实验结束后,快速取出心脏置于4%的甲醛溶液中固定保存,经过常规脱蜡、脱水以及切片、封片后,将切片经过PPAR-γ一抗以及二抗反应显色后(即常规免疫组化染色)在光镜下观察,PPAR-γ的细胞核被染成了棕褐色可认为阳性反应。随机在每张玻片上取4个清晰地视野,计算PPAR-γ地阳性表达率:PPAR-γ细胞数占切片上所有的细胞数目计算的百分比。

结 果
1.ALK7基因敲除后心电图的变化特点:正常野生型小鼠与ALK7-/-小鼠的心电图测量(图1)。小鼠的心电图形态(图1A)。与正常小鼠相比, ALK7-/-小鼠的P波脉宽、PR间期、QRS间期差异无统计学意义(P>0.05),然而QT间期明显的延长,QTc明显增大(P<0.05,图1B)。此外,小鼠的心率分布图(图2A)。与正常小鼠相比, ALK7-/-小鼠的RR间期及HR差异无统计学意义(图2中B、C)。
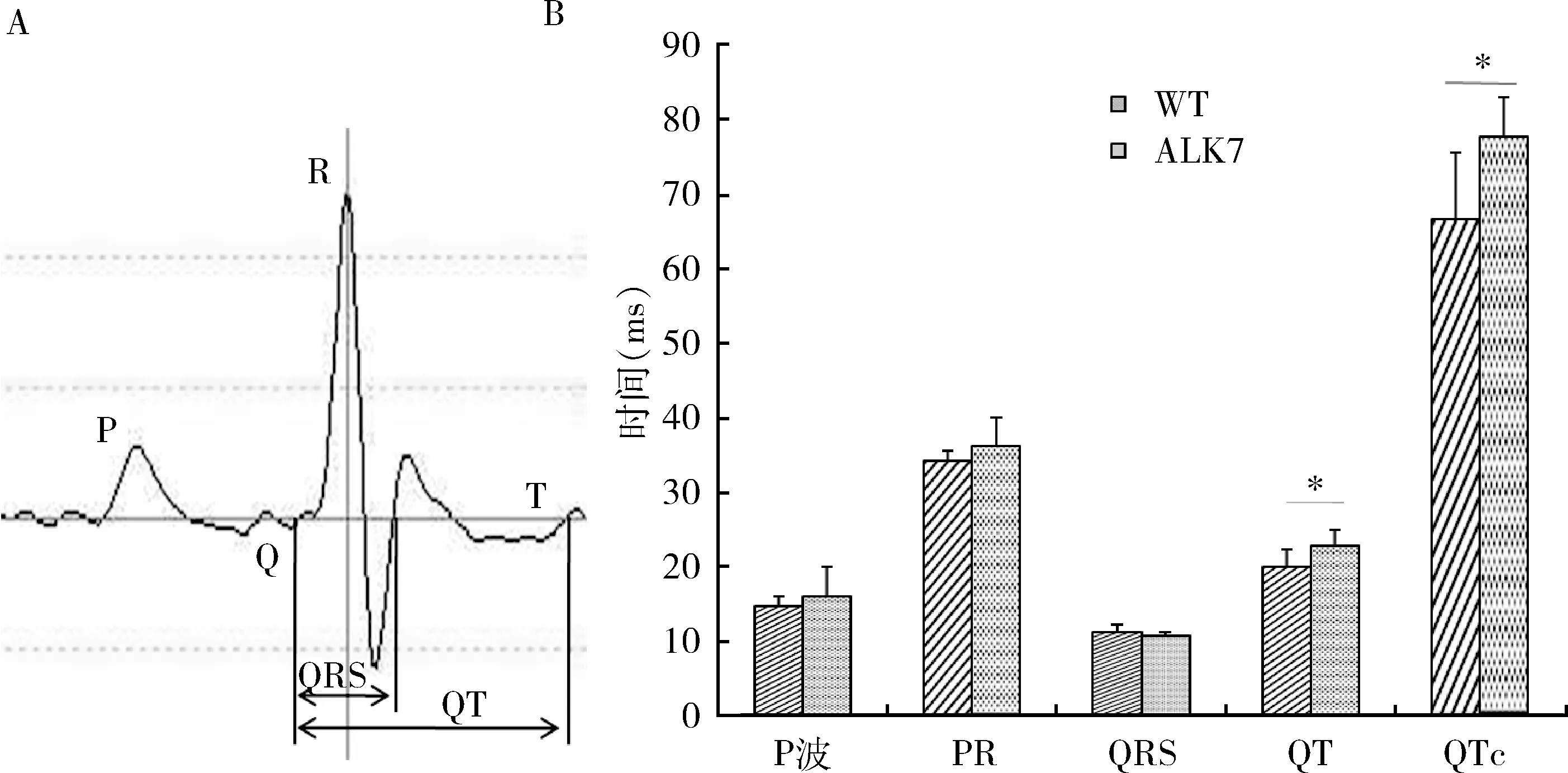
图1 ALK7基因敲除后小鼠心电图变化A.小鼠的心电图形态;B.小鼠的心电图指标的测量;两组相比,*P<0.05
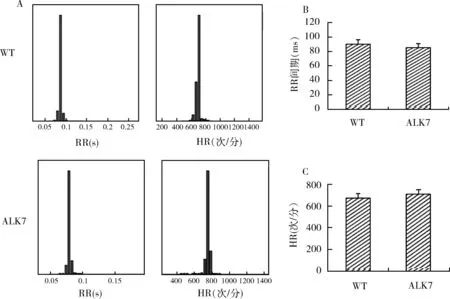
图2 小鼠的心率分布变化、RR间期比较与HR的比较A.小鼠的心率分布变化;B.小鼠RR间期比较;C.小鼠的HR的比较
2.小鼠心肌PPAR-γ免疫组化染色:正常小鼠与ALK7-/-小鼠PPAR-γ细胞核被染成了棕褐色(图3)。与正常小鼠相比,ALK7-/-小鼠PPAR-γ的表达率是显著减少的(P<0.05)。WT、ALK7小鼠的PPAR-γ的阳性表达率为34.9%±3.9%和27.9%±2.4%。
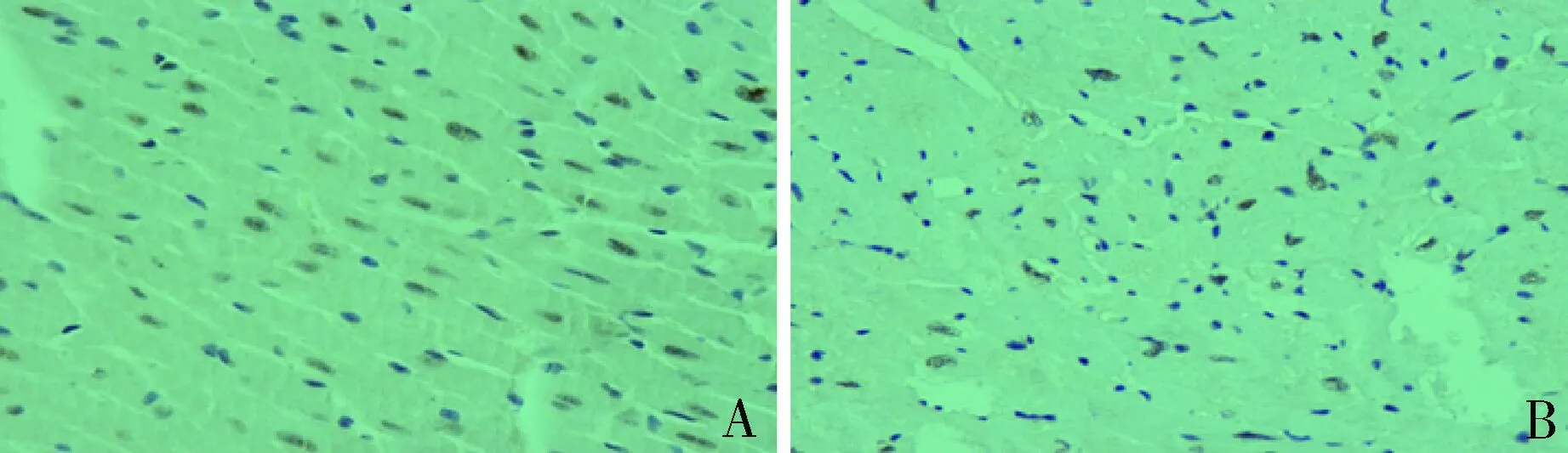
图3 小鼠的PPAR-γ染色(免疫组化染色,×400)
讨 论
心房的去极化电位变化产生了P波,而心房从去极化到心室开始去极化的时间为PR间期。心室去极的电位的改变产生了QRS波。心室去极化以及复极化的整个时程为QT间期。QT间期的延长易出现心律失常,然而导致QT的异常的原因很多。在本实验中,笔者发现 ALK7基因敲除小鼠有更明显延长的QT间期。此外,免疫组化发现PPAR-γ的表达率显著减少。ALK7在体内有着重要的调节作用,可能通过下游多个信号通路和效应子调节心脏组织重构和电重构,以及影响相关的心脏离子通道,从而可能有多种效应最终产生抗心律失常的影响。而本研究显示了ALK7基因敲除后小鼠心肌PPAR-γ的改变可能影响了心室的复极情况出现QT的延长改变。
在本研究中发现ALK7基因敲除小鼠P波、PR间期以及QRS间期、RR间期、HR没有明显变化,然而QT间期明显有延长。说明了ALK7基因敲除后可能影响了心室的复极,对心房的除极和复极以及心室的去极可能没有影响。实验中所有小鼠在同一条件下采集心电图,发现ALK7基因敲除小鼠的QT间期明显延长,QTc显著增大。因此认为ALK7小鼠的心室肌发生了复极化的延长。在长QT综合征患者中因为IKs通道地密度的下降从而使心肌的跨室壁的动作电位发生了不一致地延长,而且明显的增加了复极离散度,从而产生了EAD,因此极容易诱导发生TDP[7]。心室动作电位的时程(也就是QT间期)发生延长是激动以及折返的条件,最终会引起危及生命的恶性心律失常(比如TDP以及心室颤动等)。有报道β受体阻滞剂可以让QT间期的改变伴随着心率的变化而改变,如心率加快,则QT间期会减小,因此能显著降低复极离散度,这可能是β受体阻滞剂在心血管病中有抗心律失常作用的机制[8]。心血管病的发生率以及病死率的上升与心肌复极的延长有关[9]。QTc(即心率的校正QT间期)是SCD发生心律失常的研究中常用的指标之一。有报道显示SCD的危险因素有QTc的延长[10]。而遗传性的QT间期的变异约为35%左右[11]。因此笔者的研究显示了ALK7基因影响了小鼠心室的复极,可能是小鼠QT延长的一个影响情况,从而为恶性心律失常的研究提供新靶点。
PPARs是在体内调节基因表达的转录因子超家族成员中的配体激活受体,在生物体内有着重要的调节作用(如调节体内糖平衡, 影响肿瘤生长,抑制炎性因子生成及炎症形成,以及保护心血管的效应[12,13];此外还能影响脂肪细胞分化以及脂肪地生成, 增加对胰岛素的敏感度[14])。主要有3个亚型:PPARα、PPAR β/δ、PPARγ。目前认为PPARγ是其中最重要的亚基之一。研究表明PPARγ在炎症发生、动脉粥样硬化、胰岛素地抵抗和糖代谢调节、肿瘤以及肥胖等疾病中有着重要的调节作用[15~17]。ALK7可以诱导肝癌细胞的凋亡通过了激活Smad2/3和MAPK这两条信号通路[18]。Zhang等[19]研究显示,ALK7可以激活诱导胰腺β细胞的凋亡通过两条独立的信号通路:PI3K/Akt和Smad2/3信号通路。然而,Lu等[20]的研究发现抑制了磷脂酰肌醇3激酶(PI3K)信号通路可以影响心肌细胞钠、钾、钙等多个的离子通道,延长了细胞动作电位时程,是药物诱导的长QT综合征的重要机制。既往有研究证实,MAPK和PI3K/Akt等信号通路不仅参与了心肌肥大、凋亡、纤维化、炎症等病理过程,还可调控细胞内下游离子通道[21]。心肌细胞动作电位是由氯、钠、钙以及钾等一些地跨膜的离子流所产生的一种复杂的电位变化。如果离子通道蛋白的编码基因产生了一些改变,则有一部分的离子通道的结构以及功能会有一些改变,而许多的内向以及外向的离子流会出现增加或者出现减少的改变,最终会引起心肌的去极化以及复极化异常,从而会出现一些恶性心律失常。因此钠离子以及钙离子地内流和钾离子地外流地平衡情况可以影响复极的时间。当钠离子和钙离子内流发生增多,或者钾离子的外流减少因此会引起细胞发生复极减慢,心电图则表现为QT间期的延长。
ALK7/Smad2/3通路可通过下调PPAR-γ以及C/EBPα而减少脂肪分解,导致脂肪形成[22]。心脏中PPAR-γ细胞异常可能影响心脏钾通道及钠通道的改变。有研究显示心脏特异性过表达PPAR-γ小鼠心肌细胞钾通道表达降低,动作电位时程延长,产生严重的心肌复极异常并且自发了恶性危及生命的室性心律失常[23]。可见PPAR-γ在生物体内的调节可能引起心脏的复极异常。然而本研究中发现ALK7基因敲除小鼠复极异常,心肌PPAR-γ的表达明显减少。PPAR-γ的激动剂有利于修复在心肌地缺氧复氧模型中产生的损伤。有研究显示PPAR-γ激动剂有利于减少糖尿病相关的心肌障碍,影响钾电流[24]。此外,有报道PPAR-γ激动剂对大鼠心脏钠通道有影响。影响钾钠离子通道上离子流的微小变化都会出现动作电位的复极异常。因此,在本研究认为ALK7基因敲除小鼠可能通过PPAR-γ蛋白的变化影响了钾钠通道的改变从而出现心室的复极异常。
在本研究中通过记录ALK7-/-小鼠及正常野生型小鼠的心电图以及PPAR-γ细胞免疫组化染色,从而发现ALK7-/-小鼠有着显著延长的QT间期,且QTc也是明显的增大。此外,ALK7-/-小鼠PPAR-γ细胞在心室的阳性率显著减少。考虑ALK基因敲除小鼠PPAR-γ蛋白的改变可能影响小鼠心室复极变化,出现QT间期的延长。QT间期的改变和恶性心律失常的发生有些联系,从而为恶性心律失常的相关基因研究提供一些研究证据。
1 Reissmann E, Jornvall H, Blokzijl A,etal. The orphan receptor ALK7 and the Activin receptor ALK4 mediate signaling by Nodal proteins during vertebrate development [J]. Genes & Development, 2001, 15(15): 2010-2022
2 Bertolino P, Holmberg R, Reissmann E,etal. Activin B receptor ALK7 is a negative regulator of pancreatic beta-cell function [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(20): 7246-7251
3 Andersson O, Korach-andre M, Reissmann E,etal. Growth/differentiation factor 3 signals through ALK7 and regulates accumulation of adipose tissue and diet-induced obesity [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(20): 7252-7256
4 Fu G, Peng C. Nodal enhances the activity of FoxO3a and its synergistic interaction with Smads to regulate cyclin G2 transcription in ovarian cancer cells [J]. Oncogene, 2011, 30(37): 3953-3966
5 QIN M, HUANG H, WANG T,etal. Absence of Rgs5 prolongs cardiac repolarization and predisposes to ventricular tachyarrhythmia in mice [J]. Journal of Molecular and Cellular Cardiology, 2012, 53(6): 880-890
6 Qin M, Huang H, Wang T,etal. Atrial tachyarrhythmia in Rgs5-null mice [J]. PloS one, 2012, 7(11): e46856
7 Viskin S. Long QT syndromes and torsade de pointes [J]. Lancet, 1999, 354(9190): 1625-1633
8 Conrath CE, Wilde AA, Jongbloed RJ,etal. Gender differences in the long QT syndrome: effects of beta-adrenoceptor blockade [J]. Cardiovascular Research, 2002, 53(3): 770-776
9 Eijgelsheim M, Aarnoudse AL, Rivadeneira F,etal. Identification of a common variant at the NOS1AP locus strongly associated to QT-interval duration [J]. Human Molecular Genetics, 2009, 18(2): 347-357
10 Pfeufer A, Sanna S, Arking DE,etal. Common variants at ten loci modulate the QT interval duration in the QTSCD Study [J]. Nature Genetics, 2009, 41(4): 407-414
11 Newton-cheh C, Larson MG, Corey DC,etal. QT interval is a heritable quantitative trait with evidence of linkage to chromosome 3 in a genome-wide linkage analysis: The Framingham Heart Study [J]. Heart Rhythm , 2005, 2(3): 277-284
12 Zhu Y, Kan L, Qi C,etal. Isolation and characterization of peroxisome proliferator-activated receptor (PPAR) interacting protein (PRIP) as a coactivator for PPAR [J]. The Journal of Biological Chemistry, 2000, 275(18): 13510-13516
13 Gurnell M, Wentworth JM, Agostini M,etal. A dominant-negative peroxisome proliferator-activated receptor gamma (PPARgamma) mutant is a constitutive repressor and inhibits PPARgamma-mediated adipogenesis [J]. The Journal of Biological Chemistry, 2000, 275(8): 5754-5759
14 Bordji K, Grillasca JP, Gouze JN,etal. Evidence for the presence of peroxisome proliferator-activated receptor (PPAR) alpha and gamma and retinoid Z receptor in cartilage. PPARgamma activation modulates the effects of interleukin-1beta on rat chondrocytes [J]. The Journal of Biological Chemistry, 2000, 275(16): 12243-12250
15 Rocchi S, Auwerx J. Peroxisome proliferator-activated receptor-gamma: a versatile metabolic regulator [J]. Annals of Medicine, 1999, 31(5): 342-351
16 Gillies PS, Dunn CJ. Pioglitazone [J]. Drugs, 2000, 60(2): 333-343; discussion 44-45
17 Sugiyama Y, Murase K, Ikeda H. Mechanisms of thiazolidinedione derivatives for hypoglycemic and insulin sensitizing effects [J]. Nihon Rinsho Japanese Journal of Clinical Medicine, 2000, 58(2): 370-375
18 Kim BC, Van Gelder H, Kim TA,etal. Activin receptor-like kinase-7 induces apoptosis through activation of MAPKs in a Smad3-dependent mechanism in hepatoma cells [J]. The Journal of Biological Chemistry, 2004, 279(27): 28458-28465
19 Zhang N, Kumar M, Xu G,etal. Activin receptor-like kinase 7 induces apoptosis of pancreatic beta cells and beta cell lines [J]. Diabetologia, 2006, 49(3): 506-518
20 Lu Z, Wu CY, Jiang YP,etal. Suppression of phosphoinositide 3-kinase signaling and alteration of multiple ion currents in drug-induced long QT syndrome [J]. Science Translational Medicine, 2012, 4(131): 131ra50
21 Smani T, Calderon-Sanchez E, Gomez-Hurtado N,etal. Mechanisms underlying the activation of L-type calcium channels by urocortin in rat ventricular myocytes [J]. Cardiovascular Research, 2010, 87(3): 459-466
22 Yogosawa S, Izumi T. Roles of activin receptor-like kinase 7 signaling and its target, peroxisome proliferator-activated receptor gamma, in lean and obese adipocytes [J]. Adipocyte, 2013, 2(4): 246-250
23 Morrow JP, Katchman A, Son NH,etal. Mice with cardiac overexpression of peroxisome proliferator-activated receptor gamma have impaired repolarization and spontaneous fatal ventricular arrhythmias [J]. Circulation, 2011, 124(25): 2812-2821
24 Nanayakkara G, Viswaprakash N, ZHONG J,etal. PPARgamma activation improves the molecular and functional components of Ⅰ(to) remodeling by angiotensin Ⅱ [J]. Current Pharmaceutical Design, 2013, 19(27): 4839-4847
(修回日期:2015-05-13)
ECG Characteristics in the ALK7-Null Mice and the Possible Mechanisms.
YuTaihui,HuXiaojun,WangXin,etal.
DepartmentofCardiology,HospitalsofTraditionalChineseandWesternMedicineinHubeiProvince,Hubei4300060,China
Objective To elucidate the effects of activin receptor-like kinase 7(ALK7) in ECG, and possible mechanism.Methods Male wildtype and ALK7-/-mice (C57BL/6 background) aged 8 to 10 weeks were used in the studies. ECG (Lead Ⅱ) was continuously recorded in consciously moving mice by homemade subcutaneous electrode from 9:30 to 10.The P-wave duration and, RR interval, PR interval and QRS duration,QT interval and QTc were measured with the Labchart software.In addition, expression of PPAR-γ were analysed by immunohistochemistry.Results There was no significant difference in P-wave duration,RR interval,PR interval and QRS duration between wildtype and ALK7-/-mice.But QT interval and QTc of ALK7-/-mice were prolonged obviously compared with wildtype mice.In addition,positive expression rate of PPAR-γ in ALK7-/-mice was significantly reduced compared with wildtype mice.Conclusion The abnormal ventricular repolarization in ALK7-/-mice may be due to reduce in expression of PPAR-γ, and results in prolonged obviously of QT interval.
ALK7-/-mice;QT interval;Abnormal repolarization
国家自然科学基金资助项目(81370282)
430060 武汉,湖北省中西医结合医院心血管内科(余太辉、胡晓军、王鑫、陈卉、李乐);430063 武汉大学人民医院心血管内科(唐艳红)
唐艳红,主任医师,硕士生导师,电子信箱: wurmheart@vip.163.com
R541
A DOI 10.11969/j.issn.1673-548X.2015.10.008
2015-04-22)
