转基因猪细胞中CMV启动子区域甲基化的研究*
2015-06-06任广彩丛佩清陈瑶生何祖勇
任广彩,张 英,丛佩清,陈瑶生,何祖勇
(1.中山大学生命科学学院//有害生物控制与资源利用国家重点实验室,广东广州510006;2.广东大华农动物保健品股份有限公司,广东广州510642)
自20世纪80年代动物转基因技术出现以来,基因导入技术已经研究得较为深入,例如原核显微注射、体细胞核移植、逆转录病毒转导、精子介导以及胚胎干细胞介导等方法。虽然这些方法都存在不同的优缺点,但如何保证外源基因表达和遗传的稳定性仍是研究的关键内容[1-4]。
大多情况下,外源基因的表达会随着转基因细胞培养时间的延长,表达量逐渐降低;在转基因动物传代过程中,外源基因的表达也会出现不稳定性[2-3]。该现象的具体机制目前尚未研究清楚,但目前认为整合到受体基因组中的外源基因的拷贝数和及其DNA甲基化修饰程度是影响其表达水平的两个重要因素[5-6]。DNA甲基化是抑制基因转录的重要机制,存在着大量的可遗传信息。DNA甲基化除了直接与转录抑制因子结合外,大多还需要通过与DNA甲基结合蛋白结合,引起基因沉默[7-9]。在转基因动物中,体内外的实验表明基因沉默可能与转基因启动子区CpG岛的甲基化相关[10-12]。CpG岛主要分布在基因的5'端转录调控区或者附近,一般位于管家基因和组织特异性基因的启动子和第1个外显子区域[13]。DNA甲基化以后,其核苷酸序列没有改变,但基因表达却受到了影响,这是一种与基因活性开启和关闭密切联系的动态过程[14]。位于启动子区的CpG岛通常处于非甲基化状态,这样便于与转录因子等结合,但如果启动子区域处于甲基化状态,转录因子不能与其结合,从而出现基因沉默。
另外,外源基因常常以多拷贝的形式整合到某一位点上,形成首尾相连的重复[15-17],拷贝数越多,基因沉默就越严重,这可能是由于重复序列之间自发配对,甲基化酶识别这种结构而将其甲基化[18]。2009年 Kong等[19]测定了转基因猪细胞中外源基因的拷贝数,并用亚硫酸基因测序的方法来检测CMV启动子区域的甲基化情况,发现随着细胞体外培养时间的延长,外源基因的表达水平逐渐降低,启动子区的甲基化程度也随着增大。然而外源基因表达水平与其启动子区发生甲基化的关系在不同的研究报道得到的结果经常是不一致的,而且在转基因猪细胞中检测外源基因甲基化的研究报道极少,因此本文采用亚硫酸盐基因测序的方法来研究转基因猪细胞中外源EGFP基因表达与CMV启动子区域甲基化的关系,为评价转基因动物中外源基因表达稳定性提供一定的参考数据。
1 材料与方法
1.1 材料
两头EGFP转基因猪 (编号为318-4,364-2)为本实验室通过体细胞克隆方法获得;成纤维细胞系源于两头转基因猪的耳样细胞所建系;pMD19-T Vector kit购自 Takara公司;EcoRⅠ和NotⅠ限制性内切酶购自NEB(New England Biolabs)公司;DMEM购自Sigma公司;Endo-free Plasmid Midi Kit、Gel Extraction Kit 和 Tissue DNA kit均购自OMEGA公司;EZ DNA Methylation-Gold Kit购自Zymo research。
1.2 流式细胞仪检测细胞荧光强度
猪成纤维细胞以105个/孔接种至24-well培养板中,过夜培养,待细胞密度为80%~90%时收集细胞。流式检测数目为10000个,细胞悬液不能少于300 μL。细胞必须经过滤膜过滤以防仪器堵塞。用300目滤膜将细胞过滤到流式管中检测。EGFP的激发光488 nm,发射光为500~543 nm,设为通道1。设EGFP荧光强度大于100的event为阳性,统计EGFP的阳性细胞比例和平均荧光强度。使用FlowJo 7.6.1软件对实验结果进行分析。
1.3 亚硫酸盐处理及启动子区域PCR扩增
分别取1 μg传代至第3、10和15代的细胞提取的转基因猪基因组用亚硫酸盐处理 (根据EZ DNA Methylation-Gold Kit操作),分析启动子区域的CpG岛(http://www.urogene.org/methprimer/)并用Primer Premier 5.0软件设计启动子区域的引物CMV-F和CMV-R(CMV-F 5'-ATAGTAATTAATTA CGGGGTTATTAGTT-3',CMV-R 5'-CAACTCTACTT ATATAAACCTCCCAC-3'),PCR反应条件:94℃,3 min;94℃,30 s;50℃,30 s;72℃,30 s;72℃,10 min;4℃,保存;40个循环。
1.4 酶切、连接和转化
在w=1%琼脂糖凝胶上电泳分离PCR产物,切下含有目的片段的凝胶,用OMEGA凝胶回收试剂盒进行对应片段的回收纯化。凝胶回收的PCR产物,经分光光度计测定浓度后,将PCR产物连接至T载 (pMD19-T Vector kit)。16℃过夜后,用Top10感受态进行转化,挑单克隆摇菌培养,提取质粒,用EcoRⅠ和 HindⅢ进行双酶切检测,将酶切检测结果正确的10个质粒送去测序。
1.5 CpG岛的甲基化程度检测
经分析,CMV IE启动子区域的CpG岛共有30个,以亚硫酸盐处理后的序列为标准序列与测序结果进行比对:
ATAGTAATTAATTACGGGGTTATTAGTTTATAGTTTATATATG GAGTTTCGCGTTATATAATTTACGGTAAATGGTTCGTTTGGTT GATCGTTTAACGATTTTCGTTTATTGACGTTAATAATGACGTA TGTTTTTATAGTAACGTTAATAGGGATTTTTTATTGACGTTAA TGGGTGGAGTATTTACGGTAAATTGTTTATTTGGTAGTATATT AAGTGTATTATATGTTAAGTACGTTTTTTATTGACGTTAATGA CGGTAAATGGTTCGTTTGGTATTATGTTTAGTATATGATTTTA TGGGATTTTTTTATTTGGTAGTATATTTACGTATTAGTTATCG TTATTATTATGGTGATGCGGTTTTGGTAGTATATTAATGGGC GTGGATAGCGGTTTGATTTACGGGGATTTTTAAGTTTTTATT TTATTGACGTTAATGGGAGTTTGTTTTGGTATTAAAATTAAC GGGATTTTTTAAAATGTCGTAATAATTTCGTTTTATTGACGT AAATGGGCGGTAGGCGTGTACGGTGGGAGGTTTATATAAG TAGAGTTG。
2 结果
2.1 细胞荧光强度的变化
实验选择第5、10和15代转基因猪成纤维细胞系 (364-2)进行流式分析,观察其荧光表达变化。从图1可以看出,随着培养代数的增加,第10代细胞荧光强度较第5代变弱,但是当培养到第15代的时候,荧光强度又会变强。细胞的平均荧光强度如图2(a)所示,第10代的细胞平均荧光强度低于500,而第5代和第15代的平均荧光强度超过1000。EGFP阳性荧光细胞的比例则没有明显的变化,均接近于100%,见图2(b)。
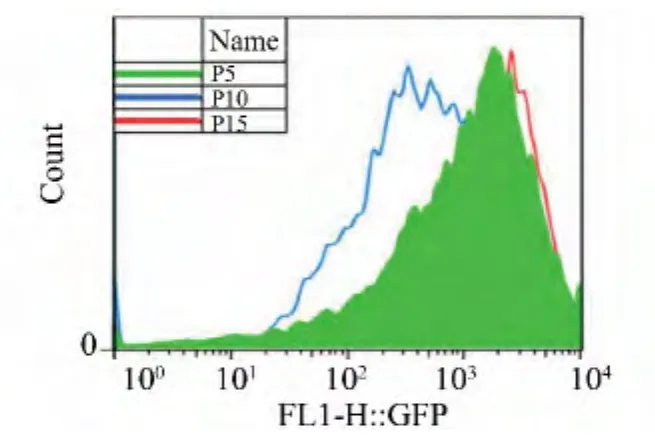
图1 流式分析细胞荧光强度的变化Fig.1 The variation of cell fluorescence intensity by flow cytometry analysis
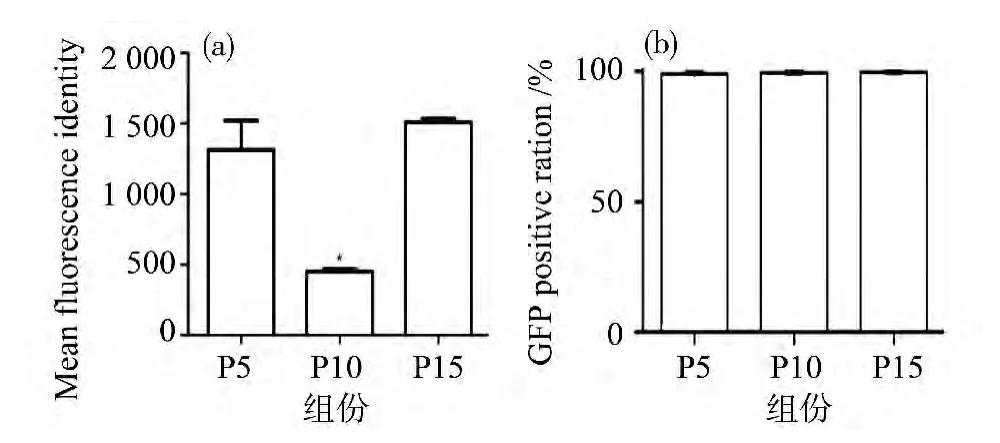
图2 细胞的平均荧光强度 (a)和荧光细胞的比例 (b)Fig.2 The mean fluorescence intensity(a)and the EGFP positive ratio(b)P5:第5代转基因猪细胞;P10:第10代转基因猪细胞;P15:第15代转基因猪细胞
2.2 启动子CpG岛甲基化程度检测
将酶切鉴定正确的10个克隆送去测序,以亚硫酸盐处理过的启动子区域为标准序列,用Vector NTI软件进行序列比对,部分比对结果如图3所示。胞嘧啶是否转化为胸腺嘧啶可以表明此位点是否发生了甲基化,在测序结果中可以发现,在一些非CpG岛也有胞嘧啶没有转化为胸腺嘧啶,说明这些非CpG岛的胞嘧啶被甲基化了。在启动子区域的CpG岛总共有30个,在所分析的10个克隆中,CpG岛的甲基化结果统计结果 (图4)表明第5、10和15代细胞CMV启动子区域的CpG岛甲基化阳性率分别为3.64% ±1.25、2.97% ±1.03、1.65%±0.74,三代细胞间的甲基化阳性率差异不显著 (P>0.05)。

图3 CMV IE启动子区域经亚硫酸盐处理后的部分比对序列Fig.3 A part of bisulfite sequence data for a representative region of CMV IE promoter
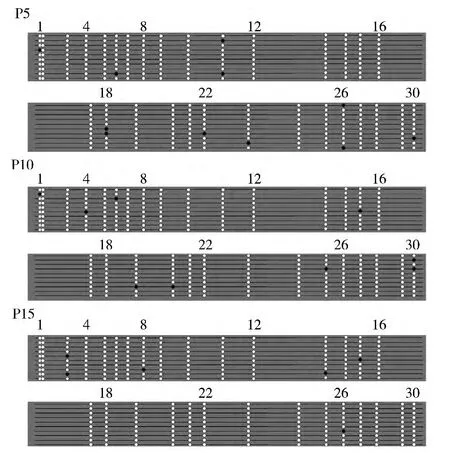
图4 部分CpG岛甲基化统计Fig.4 A part statistics of methylation at CpG sitesP5:第5代细胞;P10:第10代细胞;P15:第15代细胞
3 讨论
目前对影响转基因动物外源基因表达稳定性的影响因素的研究比较少,本研究从外源基因启动子区域甲基化的角度对转基因猪中外源EGFP的表达稳定性进行了探讨。利用流式细胞仪检测体外传代至第5、10和15代的转基因猪细胞中EGFP荧光强度的变化情况,发现从第5代到第10代细胞荧光强度逐渐变弱,再培养到第15代时荧光强度又变强,并没呈现随着培养代数的增加,细胞荧光强度有逐渐变弱的趋势。该结果与Qingran Kong等[19]研究结果不一致,在他们研究中发现转基因猪传代细胞从20 d培养到90 d,外源基因EGFP的表达量逐渐降低,EGFP细胞的阳性也逐渐降低,该作者发现EGFP的拷贝数随着培养时间的增加逐渐降低,启动子区域甲基化程度随着培养时间的增加逐渐增加,作者认为启动子区域甲基化水平的增高是影响EGFP表达水平下降的主要影响因素。
通常认为外源基因沉默是由于启动子区域CpG岛的甲基化引起的。在一些研究中已经证明了启动子区域的甲基化和基因表达成负相关[19-21]。本研究对CMV IE启动子区域的30个CpG岛在不同时间点的甲基化情况进行了分析,第10代细胞荧光强度变弱,而启动子区域的CpG岛的甲基化并没有增加,与第5代的甲基化情况相同,第15代时甲基化程度反而有所减少,在本研究中并没有发现启动子区域的甲基化程度会随着培养时间而增加,也没有发现启动子的甲基化会与基因表达有成负相关的联系。两者研究不一致的原因可能是外源基因在宿主基因组的整合位点不一样。当一个外源基因插入到异染色质区域时,如端粒或者着丝粒区域,外源基因的表达有可能不稳定,导致表达水平的不一样。如果外源基因插入到能够活跃表达的宿主基因区域内,它可以促进外源基因的表达。另外,外源基因和宿主本身基因之间的相互作用也影响着外源基因的表达,这种作用机制通常认为是比较复杂的。甲基化情况可能与EGFP整合到宿主基因组的位点有关系,附近基因的表达也会调控外源基因的表达。
另外外源基因通常随机整合到受体基因组中,高拷贝的随机整合可能也是造成外源基因沉默的原因[17,20]。通常认为外源基因是随机整合到基因组中任何一个位点,但是也有学者认为在基因组中有热点整合位点[19],整合到热点位点的拷贝数越多,在传代的过程中丢失的几率性就越大。在体外CMV是一个很强的启动子[22],但有些研究表明因为DNA甲基化的原因CMV启动子在体内也可呈沉默状态[23-25]。另外EGFP作为一个外源基因,可能会受到机体免疫机制的影响对其进行破坏或者清除。在外源基因进行传代和表达的时候受多种因素的影响,如拷贝数、甲基化、组蛋白的乙酰化、调控因子、免疫机制等,但是否某一因素占主要地位或各种因素相互作用,还需要进一步的研究。
从目前转基因猪的耳组织细胞中EGFP的表达情况及甲基化的研究结果表明,该转基因猪中外源基因的表达相对来比较稳定,启动子区域的甲基化程度也没有增高。
4 结论
转基因猪成纤维细胞中外源EGFP的表达水平相对稳定,未受到沉默,可能与其CMV启动子区的甲基化水平较低,在传代过程中甲基化水平并未增高有关。
[1]GUBIN A N,REDDY B,NJOROGE J M,et al.Longterm Retroviralmediated stable expression of Green Fluorescent Protein in mamalian cells[J].Biochem Biophys Res Commun,1997,236:347-350.
[2]MIGLIACCIO A R,BENGRA C,LING J,et al.Stable and unstable transgene integration sites in the human genome:extinction of the Green Fluorescent Protein transgene in K562 cells[J].Gene,2000,256:197-214.
[3]HOUDEBINE L M.Transgenic animal bioreactors[J].Transgenic Res,2000,9:305-320.
[4]YAMAUCHI Y,DOE B,AJDUK A,et al.Genomic DNA damage in mouse transgenesis[J].Biol Reprod,2007,77:803-812.
[5]GARRICK D,FIERRING S,MARTIN D I K,et al.Repeat-induced gene silencing in mammals[J].Nature Genet,1998,18:56-59.
[6]MARTIN D I K,WHITLAW E.Vagaries of variegating transgenes[J].Bio Essays,1996,18:919-923.
[7]BALOW D.Gametic imprinting in mammals[J].Science,1995,270:1610-1613.
[8]SCHUMACHER A,KOETSIER P A,HERTZ J,et al.Epigenetic and genotype-specific effects on the stability of de Novo imposed methylation patterns in transgenic mice[J].Biol Chem,2000,275:37915-37921
[9]KEARNS M,PREIS J,MCDONALD M,et al.Complex patterns of inheritance of an imprinted murine transgene suggest incomplete germline erasure[J].Nucleic Acids Res,2000,28:3301-3309.
[10]PROSCH S,STEIN J,STAAK K,et al.Inactivation of the very strong HCMV immediate early promoter by DNA CpG methylation in vitro[J].Biol Chem Hoppe Seyler,1996,377:195-201.
[11]BROOKS A R,HARKINS R N,WANG P,et al.Transcriptional silencing is associated with extensive methylation of the CMV promoter following adenoviral gene delivery to muscle[J].J Gene Med,2004,6:395-404.
[12]MEHTA A K,MAJUMDAR S S,ALAM P,et al.Epigenetic regulation of cytomegalovirus major immediateearly promoter activity in transgenic mice[J].Gene,2009,428:20-24.
[13]SHI W,ZAKHARTCHENKO V,WOLF E.Epigenetic reprogramming in mammalian nuclear transfer[J].Differentiation,2003,71:91-113.
[14]WHITELAW E.SUTHERLAND H.KEARNS M,et al.Epigenetic effects on transgene expression[J].Methods Mol Biol,2001,158:351-68.
[15]ESZTERHAS S K,BOUHASSIRA E E,MARTIN D I K,et al.Transcriptional interference by independently regulated genes occurs in any relative arrange arrangement of the genes and is influenced by chromosomal integration position[J].Mol Cell Biol,2002,22:469-479.
[16]CHIARAMONTE F,MILLER W,BOUHASSIRA E E.Gene length and proximity to neighbors affect genomewide expression levels[J].Genome Res ,2003,13:2602-2608.
[17]STRATHDEE D,IBBOTSON H,GRANT S G N.Expression of transgene targeted to the Gt(ROSA)26Sor locus is orientation dependent[J].PLoS ONE,2006,1:e4.
[18]DORER D R,HENIKOFF S.Transgene repeat arrays interact with distant heterochromatin and cause silencing in cis and trans[J].Genetics,1997,147:1181-1190.
[19]KONG Q,WU M,HUAN Y,et al.Transgene expression is associated with copy number and cytomegalovirus promoter methylation in transgenic pigs[J].2009,PLoS One,4:e6679.
[20]TANG W,NEWTON R J,WEIDNER D A.Genetic transformation and gene silencing mediated by multiple copies of a transgene in eastern white pine[J].J Exp Bot,2007,58:545-554.
[21]CURRADI M,IZZO A,BADARACCO G,et al.Molecular mechanisms of gene silencing mediated by DNA methylation[J].2002,Mol Cell Biol,22(9):3157-3173.
[22]van den POL A N,GHOSH P K.Selective neuronal expression of green fluorescent protein with cytomegalovirus promoter reveals entire neuronal arbor in transgenic mice[J].J Neurosci,1998,18:10640-10651.
[23]GRASSI G,MACCARONI P,MEYER R,et al.Inhibitors of DNA methylation and histone deacetylation activate cytomegalovirus promoter-controlled reporter gene expression in human glioblastoma cell line U87[J].Carcinogenesis,2003,24:1625-1635.
[24]MEIER J L.Reactivation of the human cytomegalovirus major immediateearly regulatory region and viral replication in embryonal NTera2 cells:role of trichostatin A,retinoic acid,and deletion of 21-base-pair repeats and modulator[J].J Virol,2001,75:1581-1593.
[25]CHOI K H,BASMA H,SINGH J,et al.Activation of CMV promoter controlled glycosyltransferase and b-galactosidase glycogenes by butyrate,trichostatin A,and 5-Aza-29-deoxycytidine[J].Glycoconjugate J,2005,22:63-69.
