化学反应速率与化学平衡知识常见考点探究
2015-05-30汤伟张茹英
汤伟 张茹英

化学反应速率与化学平衡知识在高考中的体现形式多数为图像分析题,借助图像中曲线的变化规律,考查我们的信息迁移能力和自学能力。因为此类试题以图像的形式呈现的几率较大,所以我们要特别关注图像问题的解答技巧,关注图像中点、线、面等所表示的意义。解答此类试题时,应重点关注如下知识点:
1.正确理解反应速率的本质,不要将速率与平衡移动混淆,如升高温度,不管是正反应速率还是逆反应速率,均增大,不能理解为若正反应速率增大,则逆反应速率必然减小。
2.化学反应速率的影响因素是高考的重点,解答时我们不仅要关注常见的条件,如浓度、温度、压强、催化剂等影响;还要特别注意一些冷点,如形成原电池可以加快反应速率,增大固体接触面积可以增大反应速率等。注意:近年来在高考实验探究中关于速率的影响因素出现的几率较大,常常借助该知识点,考查控制变量思想。
3.涉及化学平衡常数K影响因素时,浓度、压强、催化剂等改变不会影响平衡常数K,K仅随着温度的变化而变化。
4.涉及平衡移动问题时,准确理解化学平衡移动的基本原理。注意:加入固体反应物不会使平衡发生移动。
5.准确理解平衡移动与平衡体系中密度、气体平均相对分子质量等之间的相互关系;解答平衡移动相关问题时,还要特别关注是恒温恒压下还是恒温恒容下。恒温恒压条件下是最易出错的知识点,我们应高度重视。
6.涉及图像分析时,若有多种变量出现,注意采用“定一议二”的控制变量法分析(即图像中有三个变量时,先确定一个量不变,再讨论另外两个量之间的关系)。
命题角度一:化学反应速率的本质与基本计算
例 1 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应X(g)+2Y(g)→2Z(g),并达到平衡,以Y的浓度改变表示的反应速度与时间t的关系如图1所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)(
)。
A. 2-SaDb
B. 1-Saob
C. 2-Sabdo
D.1-Sbod
解析:借助图像,我们可以分析出,Sabdo表示Y向正反应方向进行时减少的浓度,而Sbod则表示Y向逆反应方向进行时增大的浓度,所以,Saob→Sabdo-Sbod,表示Y向正反应方向进行时“净”减少的浓度,而Y的初始浓度为1mol·L-1,所以Y的平衡浓度表达式为1-Sab。
答案:B
例 2 一定条件下,溶液的酸碱性对T102光催化燃料R降解反应的影响如图2所示。下列判断正确的是(
)。
A.在0~50min,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25min,pH=10时R的平均降解速率为0.04mol·L-1·min-l
解析:从图像中可以读出pH=2时,曲线下降最快,说明溶液的酸性越强,降解速率越大,所以B项错误。一般来说,反应物的浓度越大,反应速率越大,R的起始浓度越小,其降解的速率越小,C项错误。D项中可计算出其速率为0.04×10-4mol·L-l·min-l,D项错误。A项中R都是完全降解,降解百分率都是100%。
答案:A
命题角度二:化学反应速率的影响因素
例 3 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是(
)。
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
解析:加热、增加c(H+)、发生原电池反应、增大同体反应物的表面积,都能加快反应速率;浓硫酸能使铁发生钝化,阻止了进一步的反应,若加热则发生反应牛成SO2。
答案:B
例 4 一定条件的浓度对乙酸在光照下催化降解速率的影响如图3所示。下列判断不正确的是(
)。
A.该实验方案的缺陷之一是未做空白对照实验
B.CU2-I、Mn2-提高乙酸降解速率的最佳浓度为0. Immol·L-1
C.Fe3+不能提高乙酸降解速率
D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小
解析:根据信息可以得出,Cu2+、Mri2+、Fe3+的浓度不同,对乙酸在光照下催化降解速率的影响不同,三者之间,本来就是一个很好的对照实验,所以选项A说法错误。
答案:A
命题角度三:化学平衡状态的判断
例 5 在一定温度下体积固定的密闭容器中,当①混合气体的压强、②气体的总物质的量、③混合气体的密度、④B的物质的量浓度不再变化时,能表明可逆反应A(s)+2B(g)→C(g)+D(g)已达平衡的是(
)。
A.①②
B.③④
C.①④
D.只有④
解析:反应前后,气体的物质的量不变,压强不变,不能作为平衡状态判断的标准,①②说法错误;注意物质A的状态为固体,可以推理出③④说法正确。
答案:B
命题角度四:化学平衡常数、转化率等相关定量计算或推断
例 6 一定条件下存在反应CO(g)+HO(g)→CO2(g)+H2O(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、Ⅱ、Ⅲ,在工中充人lmolCO和1molH2O,在Ⅱ中充入1molCO2和1molH2,在Ⅲ中充入2molCO和2moH2O,700℃条件下扦始反应达到平衡时,下列说法正确的是(
)。
A.容器I、Ⅱ中正反应速率相同
B.容器工、Ⅲ中反应的平衡常数相同
C.容器工中CO的物质的量比容器Ⅱ巾的少
D.容器工中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
解析:选项A,在I中充人1molCO和1molH20,在Ⅱ中充入lmolCO2和1molH2,刚开始时,容器I中正反应速率最大,容器Ⅱ中正反应速率为零。达到平衡时,容器I温度大于700℃.容器Ⅱ温度小于700℃,所以,容器I中正反应速率大干容器Ⅱ中正反应速率。选项B,容器Ⅲ可看成容器Ⅰ体积压缩一半,各物质浓度增加一倍,若温度恒定,则平衡不移动;但恒容绝热的情况下,容器Ⅲ中温度比容器I高,更有利于平衡向逆反应方向移动,故容器Ⅲ中反应的平衡常数小于容器I中的。选项c,若温度恒定,容器I、Ⅱ等效,但两者温度不相等。达到平衡时,容器I温度大于700℃,容器Ⅱ温度小于700℃,有利于容器工平衡向逆反应方向移动,敞容器工中CO的物质的量比容器Ⅱ中的多。选项I),若温度恒定,容器I、Ⅱ等效,容器I中CO的转化率与容器Ⅱ中CO2的转化率之和等于1。但两者温度不等,达到平衡时,容器I温度大于700℃.容器Ⅱ温度小于700℃,有利于容器I平衡向逆反应方向移动,有利于容器Ⅱ平衡向正反应方向移动,故容器I中CO的转化率相应减小,容器Ⅱ中CO2的转化牢同样会相应减小,因此,容器I中CO的转化率与容器Ⅱ中CO2的转化率之和小于1。
答案:D
命题角度五:化学平衡的移动及图像分析
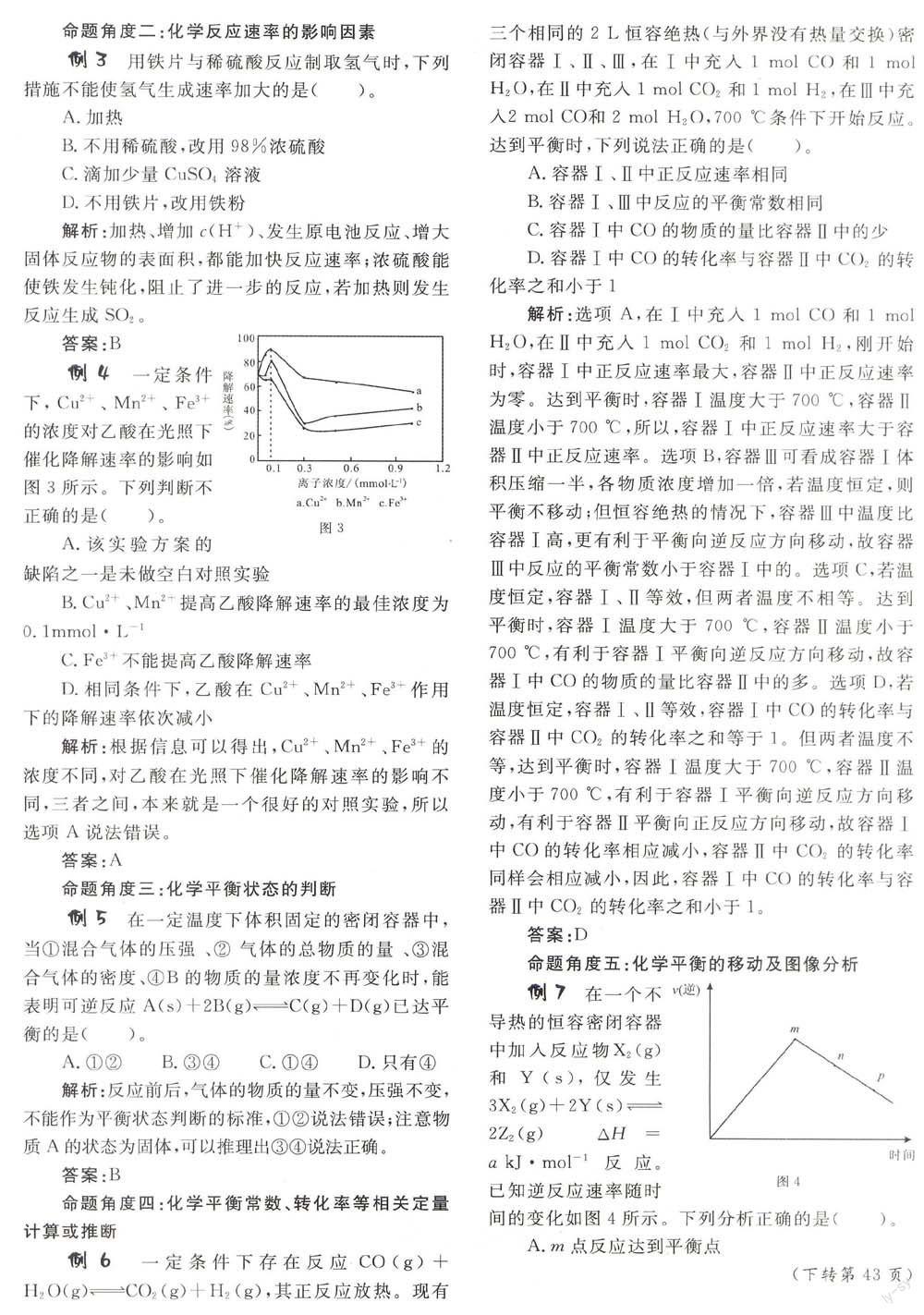
例 7 在一个不导热的恒容密闭容器中加入反应物X2(g)和Y(s),仅发生3X2(g)+2Y(s)→2z2 (g)
△H=a kJ·mol-1反应。已知逆反应速率随时间的变化如图4所示。下列分析正确的是(
)。
A.m点反应达到平衡点
B.该反应平衡常数K随着温度升高而增大
C.m点的转化率高于n点
D.平衡后加入少量Y,平衡向正反应方向移动
解析:随着反应进行,生成物的浓度越来越大,逆反应速率应该越来越快,而根据图像可以得出,m点之后,逆反应速率越来越慢,说明温度降低,造成反应速率减慢,即该反应为吸热反应,△H>O,所以达到平衡后,升高温度,平衡向正反应方向移动,平衡常数K会增大,选项B正确。
答案:B
