囊胚玻璃化冷冻对雄鼠精子质量的影响*
2015-05-20王生存郁敏燕
孙 华 ,高 原 ,王生存 ,郁敏燕 ,郭 丰
(1南通大学附属医院生殖医学中心,江苏226001;2南通大学实验动物中心)
在人类辅助生殖技术中,囊胚移植可以获得较高的临床妊娠率,剩余囊胚冻存可以最大限度地提高胚胎利用率。囊胚玻璃化冷冻技术因胚胎复苏成活率高而被广泛应用于辅助生殖治疗周期[1-2]。2001年第一例玻璃化冷冻囊胚的试管婴儿出生[3-4],已有的研究认为玻璃化冷冻复苏对围生期及新生儿子代发育无不利影响[2,5],但玻璃化冷冻试管婴儿未进入育龄期,玻璃化冷冻复苏技术对子代生殖力的影响报道很少。应用甚广的玻璃化冷冻技术是否会影响下一代的生育能力值得进一步研究。本研究对C57BL/6小鼠的3.5 d囊胚进行玻璃化冷冻复苏移植,检测其雄性仔鼠的精子质量,为囊胚玻璃化冷冻子代的生殖安全性提供参考。
1 材料与方法
1.1 材料 (1)实验动物:SPF级C57BL/6雄鼠、雌鼠,ICR雄、雌鼠由南通大学动物中心提供,实验动物生产许可证:SCXK(苏)2008-0010,实验动物使用许可证:SYXK(苏)2012-0031。实验动物饲养于标准屏障环境实验设施内IVC笼盒内,雄鼠单笼饲养,自由采食和饮水。(2)试剂:孕马血清促性腺激素PMSG(宁波第二激素厂),人绒毛膜促性腺激素hCG(丽珠),蔗糖、DMSO、乙二醇、矿物油、M2(Sigma),G-Mops、G1、HSA(Vitro life),Diff-Quik 试剂盒(珠海贝索生物有限公司)。
1.2 方法 将玻璃化冷冻复苏后小鼠囊胚进行代孕鼠体内移植,成功获得妊娠产仔,外观及体重与正常C57BL/6雄鼠无差异。选择6只子代雄鼠处死采集精子,同时处死6只同月龄自然受孕出生的C57BL/6雄鼠为对照,采集精子。若长时间不合笼交配,雄鼠的精子数量虽多活力却差,而交配后1~3 d内雄鼠的精子数量下降。为收集数量适宜、活率较好的精子进行研究,本实验选择雄鼠合笼见栓后3~5 d采集精子。将囊胚玻璃化冷冻组(观察组)与对照组进行比较,研究囊胚玻璃化冷冻对精子质量的影响。
1.2.1 囊胚获取:取4周龄C57BL/6雌鼠,分批促排卵,分别用PMSG腹腔注射10U/只,46~48 h后腹腔注射hCG10U/只,后合笼,雌鼠于见阴栓后72 h脱颈处死,取子宫,冲洗出囊胚。
1.2.2 囊胚玻璃化冷冻复苏移植:囊胚于玻璃化冷冻液1中洗涤3 min后,转移入冷冻液 2洗涤,1min内装杆,直接投入液氮内保存。复苏时,将胚胎依次放入0.25 mol/L蔗糖 2 min、0.125 mol/L蔗糖3 min和G-mops中5 min,转移至G1滴中,放入培养箱培养3~4 h后,选择形态好的囊胚移植入假孕2.5 d ICR雌鼠(与结扎雄鼠合笼见栓后2.5 d的ICR雌鼠)子宫。
1.2.3 小鼠培养:待妊娠16.5 d后,代孕ICR雌鼠自然分娩。3周后断奶分笼饲养。
1.2.4 睾丸脏器系数的检查:4~5月龄雄鼠合笼见栓后3~5 d处死,处死前称取小鼠体重,处死后用酒精消毒腹部,剪开腹壁,取睾丸及附睾组织。于解剖显微镜下去除脂肪组织,将睾丸和附睾分开。称取睾丸重量,计算睾丸脏器系数,睾丸脏器系数=睾丸重量/体重。
1.2.5 采集精子:取附睾尾部用M2冲洗干净,放入盛有0.5mLM2的3037皿中,将附睾尾多处以细针尖刺破,并稍挤压使精子游离到培养液中,37℃孵育20min左右,使精子充分游离,去除附睾组织,吹打混匀,制备精子悬液。
1.2.6 雄鼠精子密度、活力检测:取5μL精子悬液上清,使用Makler计数板,于20×显微镜下计数,每10小格的总数×106为1mL精子悬液的密度。同时记录前向、非前向及不动精子数目。3次取样计数,计算平均数为密度,分别计算精子总活力、前向活力。
1.2.7 小鼠精子畸形率分析:取1小滴精液滴于载玻片上,涂片。用精子染色试剂盒Diff-Quik染色,自然干燥后镜检。每只小鼠观察500个头、尾完整的并且不与其他精子重叠的精子,按头部畸形、颈部畸形、体部畸形、尾部畸形分别记录畸形精子数,并计算每组小鼠的精子畸形率。精子畸形率(%)=畸形精子总数/检查精子总数×100%。畸形精子指数(teratozoospermia index,TZI)=总缺陷类型/缺陷精子数。
1.3 统计学处理 采用GraphPad Prism 5统计软件分析处理数据,计量资料采用均数±标准差(means±SD)表示,组间差异性比较采用t检验,以P<0.05表示具有统计学意义。
2 结 果
2.1 囊胚玻璃化冷冻对睾丸发育的影响 囊胚玻璃化冷冻组睾丸外观正常,睾丸重(0.198±0.020)g略低于对照组(0.212±0.023)g,但差异无统计学意义(P>0.05),且两组的睾丸指数也非常接近,差异均无统计学意义(P>0.05),见表1。
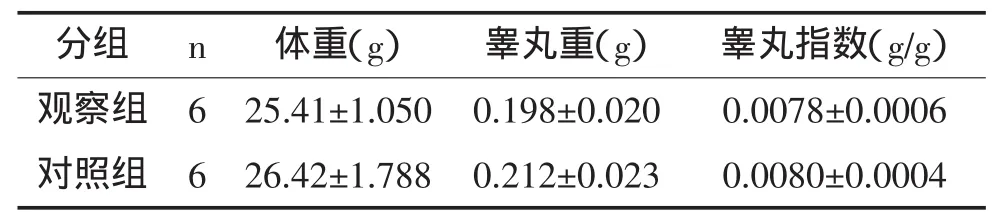
表1 囊胚玻璃化冷冻与对照雄鼠的体重、睾丸重量和睾丸指数
2.2 囊胚玻璃化冷冻对精子密度、活力的影响 采用WHO 2010精液分析方法,分析各组精子功能。囊胚玻璃化冷冻组精子密度为(13.57±3.07)×106/mL,总活力与前向活力分别为50.67%±2.03%和28.87%±2.54%,与对照组相比各项指标差异均无统计学意义(P>0.05),见表 2。

表2 囊胚玻璃化冷冻与对照雄鼠的精子密度、活力及前向活力
2.3 玻璃化冷冻对精子畸形率的影响 本研究选用男科实验室常用的Diff-Quik染色法,对小鼠精子涂片染色后镜检,囊胚玻璃化冷冻组精子畸形率为49.67%±1.21%,精子畸形指数为1.147±0.006与对照组相比差异均无统计学意义(P>0.05)。两组精子畸形类型亦相似,以头部畸形和颈部畸形居多,见表3,图 1。

表3 囊胚玻璃化冷与对照雄鼠的精子畸形率、畸形指数

图1 精子正常形态和常见畸形类型
3 讨 论
在人类辅助生殖技术中,囊胚的培养和移植对于提高妊娠率、减少多胎妊娠风险具有非常重要意义[2],玻璃化冷冻因为操作简单、复苏后成活率高,成为囊胚期胚胎冻存的主要方法而广泛应用于辅助生殖领域[1-2]。在动物实验中,囊胚玻璃化冷冻可用于重要品系的保种,降低饲养成本,提高经济效益。进行玻璃化冷冻时需将胚胎暴露于高浓度的冷冻保护剂中,增加了冷冻保护剂的毒性作用和渗透性休克对胚胎的影响[6]。初步研究认为玻璃化冷冻对妊娠率及围产期子代发育无不利影响[5],移植玻璃化胚胎并不增加新生儿的早产率及先天性出生缺陷[2-3]。但是,这些研究大都集中在围生期或新生儿出生缺陷。1998年玻璃化冷冻人类卵裂期胚胎获得成功[7],2001年报道第一例囊胚玻璃化冷冻复苏获得妊娠[3-4]。由于囊胚玻璃化冷冻的试管婴儿未进入育龄期,玻璃化冷冻技术对子代生殖力影响的研究报道很少。应用甚广的玻璃化冷冻技术是否会影响下一代的生育能力值得进一步研究。精子质量分析是评判男性生育能力的重要指标[8]。本文研究了小鼠囊胚玻璃化冷冻对精子质量的影响,目的是为子代的生殖安全性提供参考。
睾丸是精子生成的器官,睾丸参数反映的是睾丸组织的发育情况,是反映药物对睾丸的影响或损伤的重要指标[9]。本研究结果显示玻璃化冷冻与正常组的睾丸参数差距不大,提示囊胚玻璃化冷冻不影响雄鼠的睾丸发育。
精子的数量和活力是除生殖系统激素的神经内分泌调节外,影响男性生殖的的首要因素[10],这些指标的任何一项异常都可能导致生育力受损。本实验选用的是附睾尾部的精子,与雄鼠射精所得的精子成熟度类似,具有研究意义。实验结果显示,玻璃化冷冻对精子的数量与活力无影响,但小鼠群本来就是一个大群体,正常小鼠群中精子数量间也有偏差,本组研究中小鼠精子参数也有一些波动,增大样本量可进一步提高研究结果的可靠性。
精子畸形率作为重要的生殖指标,广泛用于雄性生殖能力的观察。本研究中使用了2010年WHO第五版推荐的男科实验室常用的精子检查染色方法,结果更清楚直观。结果显示囊胚玻璃化冷冻小鼠与对照小鼠的精子畸形率均为50%左右,2组差异无统计学意义,但与文献相比,本文畸形率数值均偏高。C57BL/6的小鼠精子畸形率在2.36%~23.9%[11-14],昆明小鼠畸形率在1.44%~25.98%[15-17],ICR的畸形率较低,为1.58%~2.26%[18]。也有小鼠精子畸形率较高的报道,2015年Rodriguez等报道的CD-1的畸形率为41.5%[19],与本文数值接近。我们认为正常雄鼠精子畸形率数值差异大的原因,可能是因为不同品系、不同年龄的小鼠精子畸形率不同,也可能与所采用的精子染色方法有关。畸形指数是反映体内生育力的重要指标,本实验中囊胚玻璃化冷冻组与对照组无明显差异。
综上,本研究初步认为囊胚玻璃化冷冻对雄仔鼠的精子质量无不良影响。然而全面评估囊胚玻璃化冷冻的子代的生殖安全性,需要更大样本和更详细的检测。
[1]黄国宁,孙海翔.体外受精-胚胎移植实验室技术[M].北京:人民卫生出版社,2012:131-134.
[2]赵静,张媔秋,张军强,等.玻璃化冷冻囊胚复苏移植与新鲜囊胚移植的临床结局比较[J].南京医科大学学报(自然科学版),2014,34(1):41-43.
[3]Mukaida T,Nakamura S,Tomiyama T,et al.Successful birth after transfer of vitrified human blastocystswith use of a cryoloop containerless technique[J].Fertility and sterility,2001,76(3):618-620.
[4]Yokota Y,Sato S,Yokota M,et al.Birth of a healthy baby following vitrification of human blastocysts[J].Fertility and sterility,2001,75(5):1027-1029.
[5]Takahashi K,Mukaida T,Goto T,et al.Perinatal outcome of blastocyst transfer with vitrification using cryoloop:a 4-year follow-up study[J].Fertility and sterility,2005,84(1):88-92.
[6]Valdez C A,Mazni O A,Takahashi Y,et al.Successful cryopreservation of mouse blastocysts using a new vitrification solution[J].Journal of reproduction and fertility,1992,96(2):793-802.
[7]Mukaida T,Wada S,Takahashi K,et al.Vitrification of human embryos based on the assessment of suitable conditions for 8-cellmouse embryos[J].Human Reproduction,1998,13(10):2874-2879.
[8]黄国宁,孙海翔.体外受精-胚胎移植实验室技术[M].北京:人民卫生出版社,2012:135.
[9]曹琼洁,陈忠义,阮冬芬,等.氯化镉对小鼠脏器系数及睾丸生殖细胞线粒体 D-Loop基因突变的影响[J].环境与职业医学,2010,(11):695-697.
[10]僧雪雁,张富青,刘毅,等.生殖激素,精液与男性不孕不育的相关性[J].中国医学工程,2012,20(11):47.
[11]田永刚,张迎梅.低剂量三聚氰胺对小鼠精子质量影响的研究[J].四川动物,2010,(3):466-468.
[12]Fan Y,Liu Y,Xue K,et al.Diet-induced obesity in male C57BL/6 mice decreases fertility as a consequence of disrupted blood-testis barrier[J].PloS one,2015,10(4):e0120775.
[13]Yin X,Qi Y,Ren M,et al.Roscovitine treatment caused impairment of fertilizing ability in mice[J].Toxicology letters,2015,237(3):200-209.
[14]Fabricant JD,Parkening T A.Sperm morphology and cytogenetic studies in ageing C57BL/6 mice[J].Journal of reproduction and fertility,1982,66(2):485-489.
[15]李江,李晓明,雷健,等.苯甲酸钠对小鼠精子畸形率的影响[J].当代畜牧,2013,(7):32-33.
[16]范红艳,任旷,王艳春,等.苦参总黄酮对醋酸铅诱导雄性小鼠睾丸损伤的影响[J].中药材,2014,(12):2279-2281.
[17]陈爽,侯振中.亚急性硒中毒对小鼠精子质量的影响研究[J].黑龙江畜牧兽医,2014,24:108-110.
[18]林健,林蔚,吴育文.不同品系小鼠精子畸形基础值探讨[J].医学动物防制,2010,(5):421-422.
