新型含能化合物3,3′-偶氮双(3-氨基三呋咱)合成及性能
2015-05-10贾思媛张海昊王伯周
贾思媛, 张海昊, 王伯周, 霍 欢, 周 诚
(西安近代化学研究所, 陕西 西安 710065)
1 引 言
呋咱类化合物因其具有能量高、密度高、富含氮、分子稳定性好等特点已成为含能材料领域的研究热点[1-3]。研究表明,在分子结构中引入偶氮基有利于提高化合物的生成焓[4]。偶氮呋咱化合物由于其高氮含量、高生成焓、燃烧无残渣、无污染等优点,可广泛用于炸药、高燃速推进剂和烟火技术领域[5-7]。本课题组以3,4- 双(3′-氨基呋咱-4′-基)呋咱为原料(BATF)[8-9],利用其氨基的反应活性,可合成一系列新型含能化合物如3,4- 双(3′-硝基呋咱-4′-基)呋咱(BNTF)、7H-三呋咱并[3,4-b: 3′,4′-f:3″,4″-d]- 氮杂环庚烯,7-氨基 -三呋咱并[3,4-b: 3′,4′-f:3″,4″-d]- 氮杂环庚烯 、三呋咱并氧杂环庚三烯[10-13]。
本研究利用BATF中氨基的反应活性,在酸性条件下经高锰酸钾氧化,合成了未见文献报道的含能化合物3,3′-偶氮双(3-氨基三呋咱)(ABATF),并采用红外光谱、核磁共振、元素分析和质谱等表征了目标化合物及其中间体的结构; 探讨了ABATF质谱裂解机理,并研究了氧化反应加料时间、温度、BATF和KMnO4摩尔比等关键因素对反应收率的影响,确定了最优反应条件; 采用差示扫描量热法(DSC)和热重-微商热重(TG-DTG)研究了ABATF的热分解过程; 通过理论计算获得了ABATF主要的物化与爆轰性能,以期为应用研究提供必要的数据。
2 实验部分
2.1 主要仪器与试剂
仪器: NEXUS870型傅里叶变换红外光谱仪,美国热电尼高力公司; AV500型(500 MHz)超导核磁共振仪,瑞士BRUKER公司; Vario EL-Ⅲ型元素分析仪,德国EXEMENTAR公司; LC-2010A 液相色谱仪,日本岛津公司; TA2950热重仪,美国Nicolet公司; DSC-60型差示扫描光谱仪,德国Netzsch公司;GCMS-QP2010型质谱仪,日本岛津公司。
试剂: 浓盐酸(36%),工业级,西安福晨化学试剂有限公司; KMnO4,分析纯,天津市科密欧化学试剂有限公司; BATF自制[8]。
2.2 实验过程
2.2.1 合成路线

Scheme1Synthetic route of ABATF
2.2.2 3,3′-偶氮双(3-氨基三呋咱)(ABATF)的合成
搅拌下,将4.0 g (17mmol) BATF加入 50.0 mL(36 %)盐酸中,缓慢滴加2.7 g (17 mmol mol)高锰酸钾水溶液,滴加时间为20 min ,滴加完毕升温至50 ℃反应5 h ,冷却、过滤、干燥得黄色固体3.2 g,收率为82 %,纯度98%(HPCL)。1H NMR(DMSO-d6, 500 MHz),δ: 6.65(s,H, NH);13C NMR(DMSO-d6,125 MHz),δ:162.54,155.88,144.59,142.58,137.97,136.01; MS(EI)m/z(%): 468(M+,11 ),438(11),411(14),206(10),149(18),96(23),69(21),58(60),30(100); IR(KBr,ν/cm-1): 3480,3340(—NH2); 1641,1607,1391,1156(呋咱环)Anal.Calcd for C12H4O6N16(%): C 30.76,N 47.86,H 0.855; found C 30.65,N 47.92,H 0.831。
3 结果与讨论
3.1 红外分析(IR)
ABATF的红外谱图(图1)中3480 cm-1,3340 cm-1处有两个尖锐的吸收带,为N—H伸缩振动; 1482 cm-1,1434 cm-1为N—H的面内变形振动; 866 cm-1,699 cm-1为N—H的面外的弯曲振动; 1641,1607,1567 cm-1和1391 cm-1为呋咱环的伸缩振动; 999 cm-1,985 cm-1为呋咱环的弯曲振动。

图1ABATF的红外光谱图
Fig.1FT-IR spectrum of ABATF
3.2 质谱分析及裂解机理(MS)
采用电子轰击的方法获得ABATF的质谱图(图2),其中分子离子峰为m/z468,与该化合的分子量相符,化合物分子量为偶数,又含有偶数个氮原子,根据N规则判断含有奇数个电子[14]。分子离子峰m/z468分两部分裂解,首先,NN键断裂得到碎片离子m/z236,m/z236裂解失去碎片离子NO得到m/z206,m/z206失去NO或HCN分别得到m/z176,m/z179的碎片离子,m/z179进一步裂解分别失去NO、HCN、C2N2H形成m/z=149、122、96 碎片离子,m/z96碎片离子分别失去C2N、HCN 、CN 得到更小的碎片m/z=58、69、43; 其次分子离子峰m/z468失去NO得到m/z438,碎片离子m/z438进一步失去HCN、NO得到m/z=411、351,偶氮键断裂得到m/z191,进一步裂解得到m/z69。 可能的裂解途径见Scheme 2。
图2ABATF的质谱图
Fig.2Mass spectrum of ABATF
3.4 核磁共振分析
由ABATF样品1H NMR图谱(图3)可知:1H NMR图谱中,δH2.5017为二甲基亚砜(溶剂)峰,δH3.3187为少量的水峰,δH6.653为氨基上的氢,该结果与预定结构式一致。

图3ABATF的1H NMR谱图
Fig.31H NMR spectrum of ABATF
由ABATF样品质子宽带去耦13C NMR图谱(图4)可知,ABATF为对称结构,ABATF有6个峰,由于分子内的诱导效应,电负性取代基都能使其相连的C原子化学位移向低场位移,位移的大小随取代基的电负性增大而增大。 因此和C—NN和C—NH2相连的C原子化学位移向低场移动,δC数值增加。由于C—NN的电负性强于C—NH2,所以δ数值最大,为156.6。δC1、δC2、δC3、δC4、δC5、δC6分别为162.5、144.5、137.9、136.0、142.5、155.8,其碳原子数及化学位移值与预定分子一致。

Scheme2Fragmentation pathways of ABATF
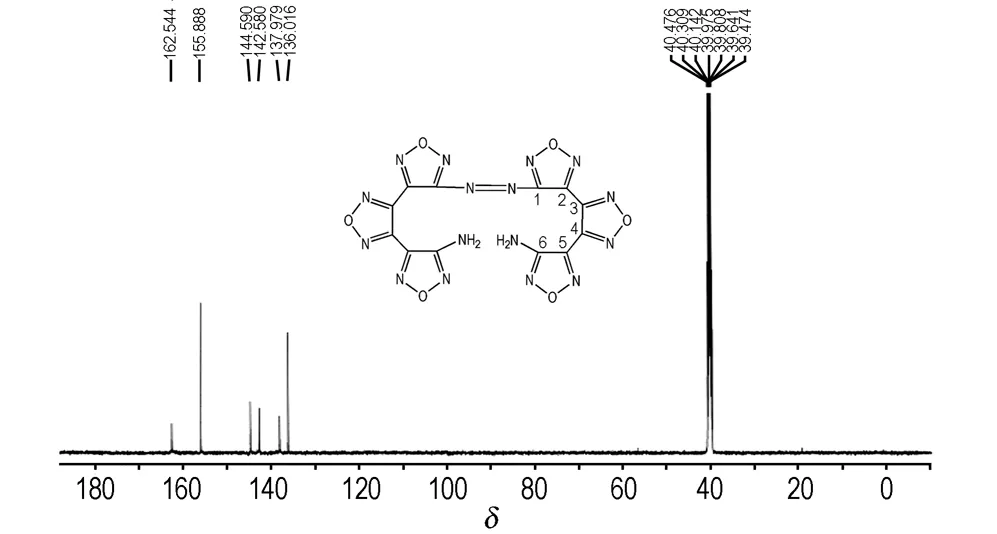
图4ABATF的13C NMR谱图
Fig.413C NMR spectrum of ABATF
3.5 应条件优化
3.5.1 加料时间
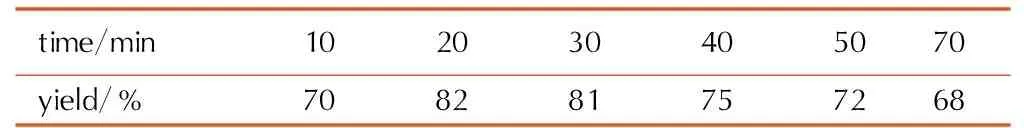
KMnO4滴加时间对ABATF收率的影响见表1。
表1KMnO4滴加时间对ABATF收率的影响
Table1Effect of dropping time of KMnO4on yield of ABATF
time/min102030405070yield/%708281757268
由于滴加KMnO4的过程中有一定的放热,同时产生氯气,会产生大量的泡沫,滴加速度过快容易冲料,存在安全隐患,滴加时间过长反应收率较低。由表1可知,当KMnO4滴加时间为20~30 min,收率最高。延长滴加时间,收率降低。这可能是因为滴加时间过长,生成的中间体分解导致收率降低,因此,适宜的滴加时间为20~30 min。
3.5.2 氧化剂用量
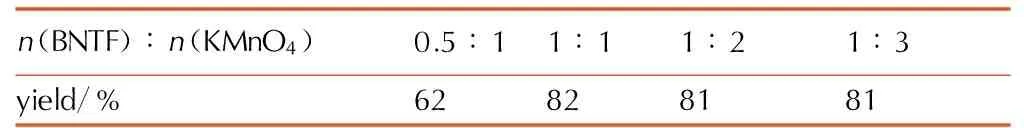
不同用量的KMnO4对ABATF收率的影响见表2。
由表2可以看出,n(BNTF)∶n(KMnO4)=0.5∶1时,收率最低,这可能是因为KMnO4用量太少使反应不能完全进行,继续增加KMnO4的用量,n(BNTF)∶n(KMnO4)=1∶1时收率最高,为82%,继续增加KMnO4的用量收率没有提高,同时,过量的KMnO4会和盐酸反应生成较多的无机盐MnCl2和KCl,降低产品的纯度。因此,n(BNTF)∶n(KMnO4)=1∶1最优。
表2n(BNTF)∶n(KMnO4)对ABATF收率的影响
Table2Effect ofn(BNTF)∶n(KMnO4) on yield of ABATF
n(BNTF)∶n(KMnO4)0.5∶11∶11∶21∶3yield/%62828181
3.5.3 反应温度
反应温度对ABATF收率的影响见表3。
从表3可以看出,反应温度为40 ℃时 反应不充分,收率低; 当温度为50℃,收率最高达到82%; 继续提高反应温度,收率下降。这可能是因为盐酸的强挥发性,反应温度过高引起大量的盐酸挥发产生的氯化氢气体,导致盐酸浓度降低反应不充分收率降低。因此适宜的反应温度为50 ℃。
表3反应温度对ABATF收率影响
Table3Effect of temperature on yield of ABATF

temperature/℃3040506070yield/%6575827250
3.6 ABATF的热行为
N2气氛,流速50 mL·min-1,10 ℃·min-1升温速率,0~600 ℃范围内ABATF的DSC和TG-DTG图如图5和图6所示。
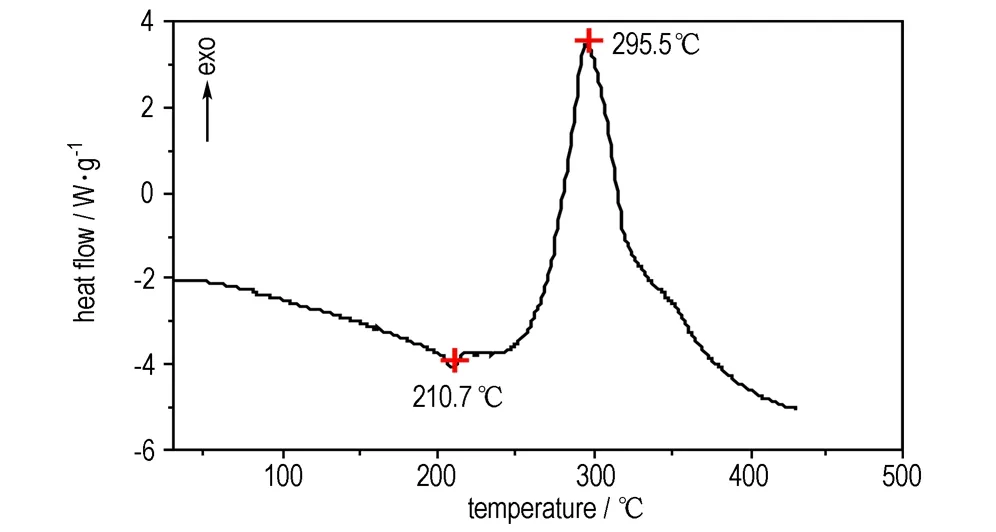
图5ABATF的DSC曲线
Fig.5DSC curve of ABATF

图6ABATF的TG/DTG曲线
Fig.6TG-DTG curves of ABATF
从图5可以看出,在210.7 ℃,有一个较小吸热峰,为ABATF的少量的挥发峰。随着温度继续升高,在295.5 ℃有个明显的放热峰,表明ABATF具有较好的热稳定性。从图6可以看出,当温度低于235 ℃ 时失重较少,累积失重仅为4.2%左右,继续升温,最大的失重峰出现在288.9 ℃,当温度达到363.3 ℃时,失重达75.4%,当温度升高到568.5 ℃,几乎完全失重,只剩少量的残渣(11.7%)。
经过以上分析表明: ABATF在受热过程中先挥发后分解,最大放热峰为295.5 ℃。
3.7 ABATF的性能计算
采用GAUSSIAN 09 程序[15]和VLW爆轰方程[16]计算ABATF和BATF的性能,结果如表4。
从表4中可以看出,BATF氧化生成偶氮化合物ABATF以后能量增加,且具更优异的爆轰性能。
表4ABATF和BATF的物化和爆轰性能对比
Table4Comparison of physico-chemical and detonation performance between ABATF and BATF

propertiesABATFBATFtestconditionappearanceyellowsolidwhiteeyeballingdensity/g·cm-31.7651.6831)Gaussian09programdissolubilitysolubleinacetoneandDMSOsolubleinacetoneandDMSOexperimentalmethodmeltingpoint/℃-183.6DSCdecompositiontemperature/℃295.5310.1DSCdetonationvelocity/m·s-182507089VLWmethoddetonationpressure/GPa29.421.39VLWmethodenthalpyofformation/kJ·mol-11626.6490.4Gaussian09programexplosionheat/J·g-163504965.6VLWmethod
Note: 1) represents experiment value.
4 结 论
(1) 以3,4-双(3′-氨基呋咱-4′-基)氧化呋咱为原料经还原、氧化反应合成未见文献报道的化合物ABATF,收率82%,并通过红外、核磁、质谱、元素分析对其结构进行了表征。
(2) 对氧化反应条件进行了优化,确定了最佳的反应条件为: KMnO4与BATF的摩尔比为1∶1,KMnO4滴加时间为20~30 min,反应温度为50 ℃。
(3) 对ABATF的热性能、物化和爆轰性能进行了测试和计算,结果表明,其分解温度为295.5 ℃,爆速,爆压和爆热均优于BATF,是一种具有应用前景的新型含能材料。
参考文献:
[1] Rakitin O A , Zalesova O A, Kulikov A S, et al. Synthesie and reactivity of furazanyl-and furoxanyldiazonium salts[J].RussianChemicalBulletin, 1993,42(11): 1865-1870.
[2] Sheremetev A B, Ivanova E A, Dmitriev D E, et al. Synthesis of macrocycles incorporating azo-bis(azofurazan) framework[J].JHeterocyclicChem,2005, 42(6): 803-810.
[3] 王伯周, 李辉, 李亚南, 等. 呋咱醚含能化合物研究进展[J]. 含能材料, 2012,20(4): 385-390.
WAGN Bo-zhou, LI Hui, LI Ya-nan, et al. Review on energetic compounds based on furoxanyl ether[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(4): 385-390.
[4] Aleksei B S, Nataliya S A, Dmitrii E D. Synthesis and X-ray study of novel azofurazan-annulated macrocylic l actams[J].JHeterocyclicChem, 2005, 42(4): 519-524.
[5] Talawar M B, Sivabalan R, Senthikumar N,et al. Synthesis,characterization and thermal studied on furazan- and tetrazine-based high energy materials[J].JournalofHazarousMaterials,2004,115: 11-25.
[6] Sheremetev A B,Kulagina O.Zero-hydrogen furazan macrocycles with oxy-and azo-bridges[J].JOrgChem,1996, 61(5): 1510-1511.
[7] Michael A H, David E C, Robert L B, et al. Preparation of 3,3′-diamino-4,4′-azofurazan: US 6552201 [P]. 2003.
[8] 贾思媛, 张海昊, 王伯周, 等. 3,4- 双(3′-氨基呋咱-4′-基)呋咱合成与表征[J]. 含能材料, 2013, 21(3): 289-293.
JIA Si-yuan, ZHANG Hai-hao, WANG Bo-zhou, et al. Synthesis and characterization 3,4-bis(3′-aminofurazal-4′-yl)furazan[J].CheineseJournalofEnergeticMaterials(HannengCailiao),2013, 21(3):289-293.
[9] 王伯周, 贾思媛, 王锡杰, 等. 3,4-双(3′-硝基呋咱-4′-基)呋咱化合物: CN 201010047638.2[P]. 2010 .
WANG Bo-zhou, JIA Si-yuan, WANG Xi-jie, et al. The compound of 3,4-bis(3′-nitrofurazan-4′-yl)furazan: CN 201010047638.2[P].2010.
[10] 张海昊, 贾思媛, 王伯周, 等. 7-氨基三呋咱并[3,4-b:3′,4′-f :3″,4″-d]氮杂环庚烯的合成、晶体结构及热行为[J]. 火炸药学报,2014, 37(4): 19-24.
ZHANG Hai-hao, JIA Si-yuan, WANG Bo-zhou, et al.Synthesis crystal structure and thermal behavior of.7-aminotrifurazano [3,4-b : 3′, 4′-f :3″,4″-d]azepine[J].ChineseJournalofExoplosivesandPropllants, 2014, 37(4): 19-24.
[11] 王锡杰, 王伯周, 贾思媛, 等. 三呋咱并氧杂环庚三烯的合成研究(TFO)[J]. 含能材料, 2012, 20(2): 258-259.
WANG Xi-jie,WANG Bo-zhou, JIA Si-yuan, et al. Trifurazanooxaheptatrien (TFO) synthesis[J].CheineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(2): 258-259.
[12] 常建华.波普原理及解析[M].科学出版社,2001.
CHANG Jian-hua .Principles of bop and analysis[M]. Science Press, 2001.
[13] Frisch M J, Trucks G W, Schlegel H B, et al. GAUSSIAN 98(Revision A. 11)[CP/CD]. Gaussian: Inc. of Walling,PA , 2009.
[14] 吴雄, 龙新平, 何碧, 等. VLW爆轰产物状态方程[J]. 中国科学(B辑), 2008, 38(12): 1129-1132.
WU Xiong,LONG Xin-ping, HE Bi, et al. The VKW equation of state for detonation products[J].ScienceinChina, 2008, 38(12): 1129-1131.
