紫外结合亚硝酸诱变选育中性蛋白酶高产菌株
2015-05-08唐雪鹭雷芬芬赵谋明
唐雪鹭,崔 春,雷芬芬,舒 会,赵谋明,*
(1.华南理工大学轻工与食品学院,广东广州 510640;2.广东省食品绿色加工与营养调控工程技术研究中心,广东广州 511400)
紫外结合亚硝酸诱变选育中性蛋白酶高产菌株
唐雪鹭1,2,崔 春1,2,雷芬芬1,2,舒 会1,2,赵谋明1,2,*
(1.华南理工大学轻工与食品学院,广东广州 510640;2.广东省食品绿色加工与营养调控工程技术研究中心,广东广州 511400)
为提高一株深海来源微小杆菌属细菌Exiguobacteriumsp. SWJS2 产中性蛋白酶的酶活,本文先后采用紫外线和亚硝酸对其进行诱变处理。紫外诱变条件为8W紫外灯在20cm处直接照射50s;三轮诱变后得突变株UV-48,其酶活较原始菌株提升21.32%。再以UV-48为出发菌株进行亚硝酸诱变,条件为0.03mol/L亚硝酸作用8min;三轮诱变后得突变株HN-34,其酶活为1109U/mL,较突变株UV-48提升13.97%,较原始菌株提升38.28%。HN-34传代5次相对酶活均在94%以上,遗传性状稳定。
中性蛋白酶,诱变,紫外,亚硝酸,微小杆菌属
中性蛋白酶是一类作用于蛋白质肽键的水解酶,其在中性pH(6.0~7.5)条件下活力最高,并在食品加工领域应用广泛,如饮料澄清[1]、风味改善[2]、动植物蛋白酶解[3]及其副产物的高值利用[4]等。此外,中性蛋白酶在皮革处理和饲料生产方面也有重要应用。
常见的微生物蛋白酶以细菌[5](芽孢杆菌属和假单胞菌属)来源为主,也有来自放线菌(链霉菌属[6])和真菌[7](曲霉、根霉和毛霉属)等,但以细菌蛋白酶的酶反应速率和稳定性较好[8]。本实验室从中国南海深海海泥中筛选得到一株微小杆菌属细菌,其产蛋白酶的基本酶学特性[9]如下:最适pH为7,并在pH5~9范围内稳定;最适作用温度40~45℃,活性受EDTA抑制明显;40℃下保温1h全部失活;属中性中温金属蛋白酶,但热稳定性靠近低温蛋白酶。在优化后的培养条件[7]下该细菌所产中性蛋白酶的酶活可达802U/mL,相较其他产碱性蛋白酶且酶活不高的微小杆菌属细菌[10-11],该菌株优势明显。
紫外照射能在同链DNA的相邻嘧啶间形成胸腺嘧啶二聚体,亚硝酸则可脱去碱基中的氨基。不同种类、剂量诱变剂的搭配使用效果不同[12],以上两者的结合使用就已成功用于提高α-环糊精葡萄糖基转移酶[13]、乳酸链球菌素[14]和ε-聚赖氨酸[15]等代谢物的产量。本文先后采用紫外线、亚硝酸进行诱变处理,以期进一步提高该深海菌株产中性蛋白酶的酶活,为其与陆生菌种所产蛋白酶在酶解方向的对比研究奠定基础。
1 材料与方法
1.1 材料与仪器
Exiguobacteriumsp. SWJS2 筛选自中国南海深海海泥,由本实验室保藏。
酪氨酸 购于sigma公司;酪蛋白(干酪素) 购于上海润捷化学试剂有限公司;高级海水素 购于广州海宝生物科技有限公司。其余化学试剂均为分析纯。
试管斜面保藏培养基(g/L) 牛肉浸膏4,蛋白胨6,酵母浸出粉2,氯化钠5,琼脂5,pH7.2±0.1;液体种子培养基(g/L) 蛋白胨5,酵母浸出粉1,海水素33.3,pH7.2±0.1;发酵培养基(g/L) 甘油3,葡萄糖5,酵母浸出粉10,氯化钠10,磷酸氢二钾0.5,硫酸镁0.3,硫酸铵1,氯化钙1,pH7.2±0.1;筛选培养基(酪蛋白-琼脂平板)(g/L) 酪蛋白10,牛肉浸膏3,氯化钠5,磷酸氢二钾2,琼脂15,pH7.2±0.1。上述所有培养基的灭菌条件均为121℃,20min。
3-18k台式离心机 德国sigma仪器公司;SW-CJ-1F洁净工作台 苏州安泰空气技术有限公司;HZQ-X300C恒温振荡培养箱 上海一恒科学仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;XMTD-204电热恒温水浴锅 北京市医疗设备厂;UV-2100紫外可见分光光度计 上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 生长曲线的建立
1.2.1.1 制备菌悬液 将保藏菌种Exiguobacteriumsp. SWJS2转接至酪蛋白平板,3次划线分离得纯培养物。取一环接入液体种子培养基,180r/min、37℃摇床培养12h即得。
1.2.1.2 测定生长曲线 以2%接种量将上述菌悬液接种于10mL液体种子培养基中(100mL锥形瓶),振荡混匀后以相同条件继续培养。每隔2h取出一瓶,立即放于4℃冰箱中保存[16]。24h结束后,以未经接种的液体种子培养基为空白调零,于600nm波长下测定各瓶菌液的吸光度值OD600。以培养时间为横坐标,OD600为纵坐标,绘制菌株生长曲线。
1.2.2 最适稀释倍数的确定 以无菌生理盐水对未经诱变剂处理的菌悬液进行十倍稀释,以能使平板上的初始菌落总数在100~300之间者为最适稀释倍数。诱变所需菌悬液采用相同稀释倍数。
1.2.3 紫外(UV)诱变 取稀释后的菌悬液100μL涂布酪蛋白平板。在黑暗条件下使涂布完成的平板于8W紫外灯正下方20cm处直接照射不同时间。照射前应预热20min稳定紫外灯;照射达设定时间后关灯,每组设3个平行。所有平板37℃恒温避光培养36h后取出计数,以未经照射的平板为对照,计算致死率。以紫外照射时间为横坐标,致死率为纵坐标,绘制致死率曲线。
1.2.4 亚硝酸(HNO2)诱变
1.2.4.1 确定最适作用浓度 向盛有2mL菌悬液的灭菌锥形瓶中分别加入0.1、0.2、0.3、0.4、0.5mol/L亚硝酸钠溶液各1.0mL,立即加入7mL(0.5mol/L)pH4.5的醋酸-醋酸钠缓冲溶液(反应所得HNO2的终浓度为0.01~0.05mol/L)。混合液于37℃水浴保温振荡5min,各取500μL加入9.5mL(0.07mol/L)pH8.5磷酸氢二钠溶液中,终止反应。以不经水浴保温而立即振荡均匀并稀释至适宜倍数的菌悬液为空白对照,不同处理浓度各设一个对照。处理后的菌悬液稀释至适宜倍数,各取100μL涂布酪蛋白平板,每组设3个平行。所有平板37℃恒温培养36h后取出计数,计算致死率。由遗传育种经验,选择存活菌变异显著且正变率较高的80%左右致死率[17],并以该致死率对应的亚硝酸钠溶液浓度为最适作用浓度。
1.2.4.2 确定最佳作用时间 选用最适作用浓度的亚硝酸钠溶液,以1.2.4.1方法处理菌悬液,但将水浴保温时间调整为1、2、3、4、5、6、7、8、9min,空白对照设置方法相同。以亚硝酸作用时间为横坐标,致死率为纵坐标,绘制致死率曲线。
1.2.5 突变菌株的筛选
1.2.5.1 平板初筛 从致死率为80%~90%的酪蛋白平板上挑取菌落,划线培养获得单菌落后点种于酪蛋白平板,每组设3个平行。37℃恒温培养36h后均匀滴入10%三氯乙酸(TCA)。选择透明圈直径与菌落直径的比值(H/C值)较大的单菌落再次纯化。
1.2.5.2 摇瓶复筛 初筛所得单菌落经富集培养,取500μL种子液接种至25mL发酵培养基(250mL锥形瓶),180 r/min、25℃摇床培养44h[9]。8000×g离心10min取上清液即得粗酶液。3次测定求平均值,选择酶活最高的菌株再次诱变。
1.2.6 蛋白酶活力的测定 在特定条件下每分钟催化1μmol底物转化为产物所需的酶量定义为1个单位(U)[18],本实验以福林法[19]测定粗酶液的酶活力。蛋白酶活力(U/mL)=ΔOD680×K×(4/10)×n。其中,ΔOD680为待测样品与空白对照的吸光度差值;K为吸光系数,即OD值为1.0时对应的1mL酪氨酸的质量,μg;本实验中K=97.7614;n为粗酶液的稀释倍数。
1.2.7 遗传稳定性实验 将筛选所得突变菌株连续传代5次,分别测其摇瓶发酵所得粗酶液的中性蛋白酶活力。
2 结果与讨论
2.1 菌株生长曲线
由图1可知,菌株在接入种子培养基后延滞期较短,从第2h起进入对数生长期并持续约8h。10~22h菌体数量稳定,第24h表现出衰退特征。处于对数生长中后期的菌悬液,其菌体对理化因素较为敏感且大小均匀;较大的菌液浓度则能在一定程度上减少致死率误差。综合以上两点选用种龄为12h的种子液进行诱变处理。
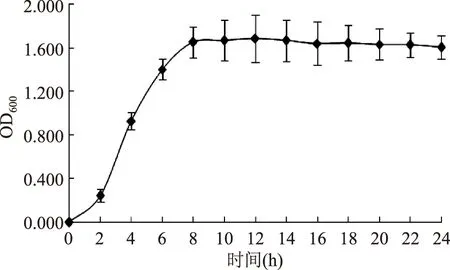
图1 菌株Exiguobacterium sp. SWJS2的生长曲线Fig.1 Growth curve of Exiguobacterium sp. SWJS2
2.2 紫外诱变结果
由图2可知,紫外照射60s时菌体已接近完全死亡。前60s内菌体死亡率与照射时间呈正相关,50s时致死率可达80%。从该组平板分离单菌落进行初筛和复筛,并将粗酶液酶活最高的菌株再次诱变。3轮诱变后所得结果见表1,可知酶活高低与H/C值的正相关性较弱;可能是由于菌株在固、液培养基中的产酶能力不同[20]。突变株UV-48摇瓶发酵所得粗酶液的酶活为973U/mL,较原始菌株酶活802U/mL提高21.32%。将UV-48作为出发菌株进行亚硝酸诱变。
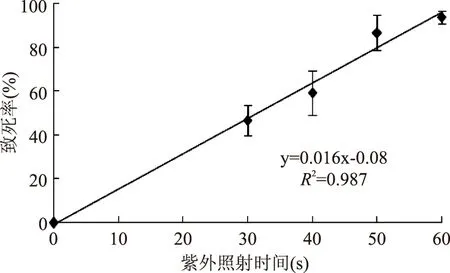
图2 致死率随紫外照射时间的变化Fig.2 Death curve of ultraviolet mutation

菌株号H(cm)C(cm)H/C蛋白酶活(U/mL)酶活提升程度(%)原始菌株2.800.654.3802-UV-482.200.504.497321.32UV-412.500.406.395519.08UV-632.800.515.595018.45UV-582.550.604.393416.46UV-552.700.604.592815.71UV-452.400.415.991313.84UV-142.800.456.290412.72UV-532.500.604.590212.47
注:*H为水解圈直径,C为菌落直径,H/C为二者比值。
2.3 亚硝酸诱变结果
由图3,UV-48经0.03mol/L HNO2作用5min后致死率接近80%,故以0.03mol/L为亚硝酸诱变的最适浓度(对应亚硝酸钠溶液的浓度为0.3mol/L)。以最适浓度作用不同时间所得的致死率曲线如图4,亚硝酸作用8min后致死率达80%以上。从该组平板分离单菌落进行初筛和复筛,并将粗酶液酶活最高的菌株再次诱变。3轮诱变后所得结果见表2。突变菌株HN-34的酶活较该菌株UV-48提高13.97%,较原始菌株提高38.28%。

图3 致死率随亚硝酸作用浓度的变化Fig.3 Relationship between lethality and the concentration of HNO2

图4 致死率随亚硝酸作用时间的变化Fig.4 Relationship between lethality and the action time of HNO2

菌株号H(cm)C(cm)H/C蛋白酶活(U/mL)酶活提升程度(%)UV-482.200.504.4973-HN-342.700.604.5110913.97HN-402.550.653.9110513.57HN-442.500.604.210669.56
注:*H为水解圈直径,C为菌落直径,H/C为二者比值。
2.4 遗传稳定性实验
将HN-34连续传代5次,测定各代菌株摇瓶发酵所得粗酶液的中性蛋白酶酶活。由表3可知,蛋白酶活并不严格随传代次数的增加而减少,而是表现出一定的波动性,但各代菌株所产蛋白酶的相对酶活比较接近并均在94%以上。整体而言突变菌株HN-34酶活稳定,结果的波动性可能源于除培养基组成、温度、时间和转速以外其他因素对发酵产酶的影响。
3 结论
深海菌株Exiguobacteriumsp. SWJS2的对数生长期开始于第2h并持续约8h,稳定期时长12h,与陆生细菌同中存异,二者酶解效果的差异值得进一步研究。紫外诱变将该细菌所产中性蛋白酶的酶活提升21.32%,亚硝酸诱变再提升13.97%,最终较原始菌株提升38.28%;但提升程度不及已报道的其他菌种的代谢产物(50%以上至数倍)。分析原因可能有以下五点:其一,微小杆菌属为革兰氏阳性菌,厚密的细胞壁使其对于紫外线和亚硝酸作用的耐受能力较革兰氏阴性菌更强;其二,合成机制不同的代谢产物对于诱变剂的作用效果存在差异;其三,原始菌株所产蛋白酶的酶活远高于其他已报道的微小杆菌属细菌,其本身的酶活提升程度有限;其四,两种诱变剂的分开使用对于细菌基因的改造程度不及二者的复合作用;其五,3轮诱变尚不足以获得可观的提升程度。因而,换用其他种类诱变剂和其相互之间的搭配使用方式并适当增加诱变轮数,将有可能获得更高的酶活提升程度。除与陆生菌种蛋白酶酶解效果的对比研究外,后续还可关注该细菌蛋白酶与同属其他种细菌蛋白酶酶学特性的异同。

表3 突变株HN-34的遗传稳定性实验结果
[1]朱建华,钟瑞敏,麦绮云. 复合酶法高品质澄清猕猴桃果汁生产工艺研究[J]. 江西农业学报,2010,22(5):128-129.
[2]曲杜娟,赵强忠,赵谋明. 乳清蛋白中性蛋白酶酶解物对酸奶发酵的促进作用及其对酸奶品质的影响研究[J]. 食品科技,2009(10):59-63.
[3]Wang L,Wang Y J. Rice starch isolation by neutral protease and high-intensity ultrasound[J]. Journal of cereal science,2004,39(2):291-296.
[4]Lasekan A,Abu Bakar F,Hashim D. Potential of chicken by-products as sources of useful biological resources[J]. Waste management,2013,33(3):552-565.
[5]Sumantha A,Larroche C,Pandey A. Microbiology and industrial biotechnology of food-grade proteases:a perspective[J]. Food Technology and Biotechnology,2006,44(2):211-220.
[6]陈昉,王以光. 来源于链霉菌的蛋白酶[J]. 国外医药(抗生素分册),2002,23(2):67-72.
[7]Ng T B. Peptides and proteins from fungi[J]. Peptides,2004,25(6):1055-1073.
[8]Morihara K,Tsuzuki H,Oka T. Comparison of the specificities of various neutral proteinases from microorganisms[J]. Archives of biochemistry and biophysics,1968,123(3):572-588.
[9]雷芬芬.深海菌株Exiguobacterium sp. SWJS2发酵产蛋白酶、酶学性质及酶解特异性的研究[D].广州:华南理工大学.2014.06.
[10]Kasana R C,Yadav S K. Isolation of a psychrotrophic Exiguobacterium sp. SKPB5(MTCC 7803)and characterization of its alkaline protease[J]. Current microbiology,2007,54(3):224-229.
[11]石卉,周志江,韩烨. 金橙黄微小杆菌产碱性蛋白酶培养基组成及发酵条件优化[J]. 食品工业科技,2012,33(18):205-208.
[12]王树宁,高晗,孙俊良,等. 不同诱变剂对醋酸杆菌诱变效果的研究[J]. 河南科技学院学报,2007,34(3):5-8.
[13]张智维,雷新辉,张海群. 紫外线和亚硝酸诱变选育高产α-环糊精葡萄糖基转移酶菌株[J]. 粮油食品科技,2013,21(5):101-104.
[14]徐文生,陈湘宁,张艳艳,等. 高产乳酸链球菌素生产菌的诱变[J]. 北京农学院学报,2010,25(1):37-40.
[15]余明洁,田丰伟,范大明,等. 高产ε-聚赖氨酸白色链霉菌的复合诱变选育研究[J]. 食品工业科技,2008(7):99-101.
[16]陶令霞,夏铁骑,常慧萍. 两种测定固氮菌 NT06 菌株生长曲线方法的比较[J]. 生物学杂志,2007,24(5):57-58.
[17]谭东南,刘昕. 采用紫外线和亚硝酸处理诱变筛选酱油曲菌[J]. 甘肃农业大学学报,1997,32(1):38-42.
[18]彭志英.食品酶学导论(第二版)[M].北京:中国轻工业出版社,2009:38.
[19]中华人民共和国国家质量监督检验检疫总局.GB/T 23527-2009蛋白酶制剂[S].北京:中国标准出版社,2009.
[20]宋欣,魏留梅. 脂肪酶高产菌株选育和菌种库的建立[J].微生物学通报,2002,29(1):6-10.
Study on the screening high yield neutral-protease-producing strain by combing UV and nitrous acid mutagenesis
TANG Xue-lu1,2,CUI Chun1,2,LEI Fen-fen1,2,SHU Hui1,2,ZHAO Mou-ming1,2,*
(1.School of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China;2.Guangdong Food Green Processing and Nutrition Regulation Technologies Research Center,Guangzhou 510640,China)
UV and HNO2were successively used to promote the enzyme-activity of the neutral protease produced by a marine bacteriaExiguobacteriumsp. SWJS2. Being directly exposed to 8W UV for 50s with a vertical dimension of 20cm,mutant strain UV-48 with a promotion of 21.32% were obtained after three turns of mutagenesis and then be applied into HNO2mutagenesis for further promotion. Being diluted by 0.03mol/L HNO2for 8min,UV-48 was finally turned into HN-34 with a promotion of 13.97% than itself and 38.28% than the starting strain after three turns. After pass-generation tests for five times,the mutant strain HN-34 was proved to be genetically stable since the five relative enzyme-activity were all above 94%.
neutral protease;mutagenesis;UV;nitrous acid;Exiguobacteriumsp.
2014-07-14
唐雪鹭(1991-),女,硕士研究生,研究方向:食品生物技术。
*通讯作者:赵谋明(1964-),男,博士,教授,研究方向:食品生物技术,蛋白质深加工技术。
深海微生物活性物质挖掘与其利用技术(2012AA092104);广东省海洋经济创新发展区域示范专项(GD2012-D01-002);热带海洋微生物新型耐盐特异性蛋白酶的挖掘与应用(2013418018-7)。
TS201.3
A
1002-0306(2015)07-0163-04
10.13386/j.issn1002-0306.2015.07.026
