威兰胶中性蛋白酶法脱蛋白的研究
2015-05-08章望重
邓 宽,李 娜,邵 闯,段 能,章望重,赵 萌
(湖北工业大学轻工学部食品与制药工程学院,湖北武汉 430068)
威兰胶中性蛋白酶法脱蛋白的研究
邓 宽,李 娜,邵 闯,段 能,章望重,赵 萌*
(湖北工业大学轻工学部食品与制药工程学院,湖北武汉 430068)
研究中性蛋白酶法制备低蛋白威兰胶的最佳工艺及对威兰胶样品性质的影响。本实验通过单因素实验和正交优化实验,确定了中性蛋白酶对威兰胶样品的最优除蛋白工艺。结果表明,当威兰胶浓度1%、温度50℃、pH6.5、酶底比1mL/g时,水解威兰胶样品6h获得65.3%的最高威兰胶蛋白质去除率;另外,比较了酶处理前后威兰胶样品的各组分含量和表观粘度,结果发现,中性蛋白酶降低了威兰胶样品中的蛋白质含量、提高了多糖含量,并保持了威兰胶的高粘度特性。因而,中性蛋白酶法是制备低蛋白、高品质威兰胶产品的有效方法。
威兰胶,脱蛋白,中性蛋白酶
威兰胶(welan gum),是产碱杆菌(Alcaligenes)发酵生产的一种胞外多糖[1-3],与结冷胶(gellan)、鼠李胶(rhamsan)、迪伦胶(diutan)共同构成结冷胶家族(sphingans)[4]。其结构骨架与结冷胶相同,为D-葡萄糖、D-葡萄糖醛酸、D-葡萄糖和L-鼠李糖组成的四糖片段,葡萄糖残基的C3位连有侧链(α-L-鼠李糖或α-L-甘露糖)[1]。威兰胶是一种性质优良的假塑性流体,拥有耐高温、耐酸碱、耐盐等优良特性[5-6],目前主要用于油墨[1]、混凝土[7]、石油[8]等工业生产中。1996年,日本厚生省首次将威兰胶列入食品添加剂名单(No.120,April 16,1996),其在果汁、饮料、乳制品、果酱、烘焙食品、肉制品等食品中具有应用价值。但目前商品化威兰胶中残留了大量蛋白质和菌体[9],这是由于威兰胶粘度高,生产过程中无法通过离心、过滤等物理方式除菌。若要将威兰胶产品应用于食品中,必须将其进行脱蛋白处理,获得低蛋白威兰胶产品。
酶法脱除粘性多糖中的蛋白,不需添加高盐或有机溶剂,操作简单、易于放大、绿色环保,是纯化制备微生物胞外多糖的重要发展趋势[10]。Wang等人采用碱性蛋白酶降解结冷胶中的蛋白,其蛋白质降解率高达86%[11];欧文等人比较Sevage法、三氯乙酸法、木瓜蛋白酶法对荠菜多糖除蛋白的效果,结果表明,木瓜蛋白酶法除蛋白效果最佳[12]。目前,少量文献报道了威兰胶的菌种选育、发酵优化等方面的研究[13-17],但威兰胶脱蛋白研究未曾报道。本文尝试采用中性蛋白酶降解威兰胶中的蛋白质,同时不改变威兰胶高粘度特性,获得低蛋白、高品质威兰胶产品。
1 材料与方法
1. 1 材料与仪器
威兰胶 河北鑫合生物化工有限公司;中性蛋白酶 诺维信公司,20000 U/mL;乙醇、福林酚试剂、苯酚、硫酸铜、硫酸、碳酸钠、氢氧化钠、酒石酸钾钠等试剂,均为分析纯 购自国药集团化学试剂有限公司。
DTU-1900紫外可见分光光度计 北京普析通用仪器有限责任公司;F-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;旋转流变仪Haake Rheostress 6000 美国Thermo Fisher Scientific公司;GZX-9146 MBE数显真空干燥箱 上海博迅实业公司医疗设备厂;SRT-202滚轴式混合器 海门市其林贝尔仪器制造公司。
1.2 实验方法
1.2.1 脱蛋白工艺 以20mmol/L磷酸盐缓冲溶液配制威兰胶溶液,加中性蛋白酶,恒温水浴锅反应6h,加入4倍乙醇静置过夜,抽滤,真空干燥。将酶处理后的威兰胶样品溶胀,测定样品中蛋白质含量及多糖含量,计算蛋白质去除率及多糖回收率。在实验优化过程中,首先采用单一因子变量法,控制其它反应条件不变,改变反应温度(40、45、50、55、60℃)、pH(6、6.5、7、7.5、8)、酶底比(0.5、1.0、1.5、2、2.5mL/g)、威兰胶浓度(0.5%、1%、1.5%、2%、2.5%),研究各反应条件对脱蛋白效果的影响。接着,采用正交实验法(如表1所示),进行进一步优化。

表1 正交实验因素水平表
1.2.2 蛋白质含量测定 以牛血清蛋白为标样,Folin-酚法[18]测定威兰胶中蛋白含量(500nm),计算蛋白质去除率。蛋白去除率(%)=(蛋白质去除前含量-蛋白去除后含量)/蛋白质去除前含量×100。
1.2.3 多糖含量测定 以葡萄糖为标样,硫酸苯酚法[19]测定威兰胶中多糖含量。
1.2.4 威兰胶样品粘度的测定 配制一定浓度的威兰胶溶液,置于滚轴混合器上,速度适中混合12h。在HaakeRheoStress 6000旋转流变仪上测定威兰胶溶液粘度,使用P60 TiL转子,测量间距设为1mm,实验温度为25℃。稳态剪切模式测定威兰胶粘度,剪切速率设定为0.01~500s-1,对数模式采集数据点。
1.3 数据处理方法
运用SPSS17.0软件进行正交设计,所有实验均重复3次并平行取样。数据分析均采用SPSS17.0进行处理。
2 结果与讨论
2.1 中性蛋白酶制备低蛋白威兰胶的条件优化
2.1.1 温度 酶的催化作用受温度影响很大。与化学反应一样,提高温度可以增加酶促反应速度,但大多数酶是一种蛋白质,温度过高会引起蛋白质变性,导致酶的失活。固定威兰胶浓度1%、pH7、酶底比为1mL/g,分别测定40、45、50、55、60℃时的蛋白质降解率。由图1可知:温度对蛋白质去除率影响巨大,当温度为50℃时,威兰胶样品的蛋白质去除率最高为63.7%,高于这个温度后威兰胶蛋白质去除率急剧下降。因而,中性蛋白酶除威兰胶蛋白的最适反应温度是50℃,在诺维信公司提供的中性蛋白酶最适反应温度区间内。
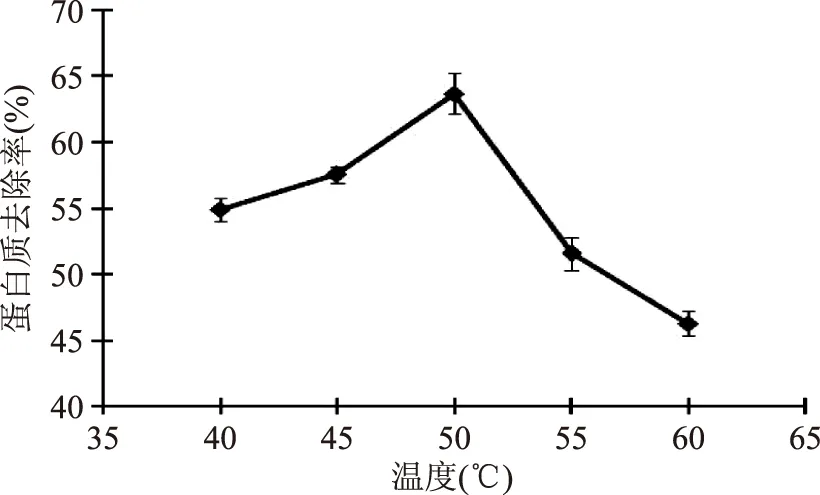
图1 温度对中性蛋白酶除威兰胶蛋白的影响Fig.1 The effect of temperature on deproteinization of welan gum with neutral protease
2.1.2 反应pH pH是影响酶催化效率的另一重要因素。酶只有在一定的pH范围内才表现活性,活性最高时的pH称为该酶的最适pH。当威兰胶浓度为1%、反应温度50℃、酶底比1mL/g时,采用不同pH(6、6.5、7、7.5、8)的20mmol/L磷酸盐缓冲溶液配制威兰胶溶液,考察pH对中性蛋白酶除蛋白的影响。由图2可知:蛋白质降解率在pH6~8范围内呈现先升高后减小的趋势,其中在pH=7时蛋白质去除率最高,达62.3%。

图2 pH对中性蛋白酶除威兰胶蛋白的影响Fig.2 The effect of pH on deproteinization of welan gum with neutral protease
2.1.3 酶底比 固定威兰胶浓度1%、反应温度50℃、pH7,分别测定酶底比为0.5、1.0、1.5、2、2.5mL/g时的威兰胶蛋白去除率,结果如图3所示,当酶底比增加到1.0mL/g时,蛋白质去除率增加至最高,继续增加酶底比,威兰胶蛋白质去除率基本保持平稳,故选择酶底比1.0mL/g,此时蛋白质去除率为57.2%。
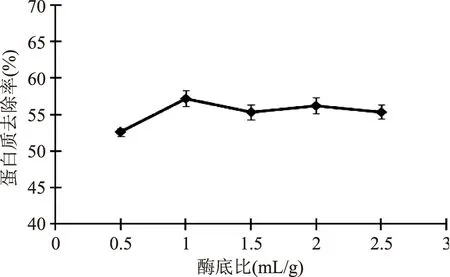
图3 酶底比对中性蛋白酶除威兰胶蛋白的影响Fig.3 The effect of enzyme/substrate dosage on deproteinization of welan gum with neutral protease
2.1.4 威兰胶浓度 固定反应温度50℃、pH7、酶底比1mL/g,分别测定不同威兰胶浓度(0.5%、1%、1.5%、2%、2.5%)下的蛋白质去除率。如图4所示,随着威兰胶浓度的增加,蛋白质去除率急剧下降。这可能是威兰胶的高粘度特性造成的结果,浓度增加使得溶液粘度急剧增加,酶的流动性和催化行为大大受到限制。考虑到威兰胶产品发酵产量在10~20g/L[13-17],发酵液稀释造成后续威兰胶沉淀所需酒精用量增加,故选择威兰胶浓度1%作为最终底物浓度,此浓度下酒精使用成本较低,蛋白去除率较高。

图4 威兰胶浓度比对中性蛋白酶除威兰胶蛋白的影响Fig.4 The effect of substrate concentration on deproteinization of welan gum with neutral protease
2.2 正交实验及实验验证
在单因素考察的基础上,固定威兰胶浓度1%,选取温度(A)、pH(B)、酶底比(C)为考察因素,每个因素考察3个水平,进行正交实验,以蛋白去除率优选中性蛋白酶法除威兰胶蛋白的工艺,实验结果见表2。由直观分析结果可以看出3个因素对蛋白质去除率的影响程度不同,依次为酶底比>pH>温度,最佳条件为A2B1C1,即温度50℃、pH6.5、酶底比1mL/g,反应6h后蛋白去除率为56.3%。
在正交实验的最佳工艺下,即温度50℃、pH6.5、酶底比1mL/g时,进行3次验证实验。测得蛋白去除率分别为62.1%、66.5%、67.2%,平均值为65.3%,3次蛋白去除率都较高,说明该正交优化结果较好。
2.3 酶处理前后威兰胶样品性质比较
2.3.1 样品中各组分含量 如表4所示,分别测量了酶处理前后威兰胶样品的水分、蛋白质、多糖含量。经酶处理后,威兰胶中蛋白质含量从20.8%下降到9.7%,多糖含量由70.5%升高至80.9%。威兰胶样品中蛋白质去除率达53.6%,略低于正交实验优化结果,这可能与样品制备量较多,样品粘度较高,造成酶解反应不够充分,但酶解过程仍去除了高粘度威兰胶样品中的多半蛋白质。

表2 中性蛋白酶酶法除威兰胶蛋白工艺L9正交实验及结果

表3 正交实验方差分析
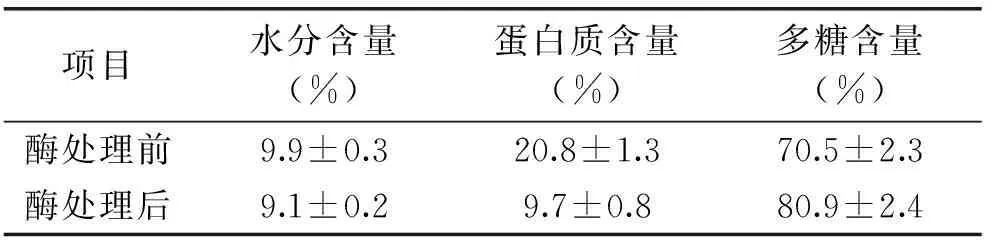
表4 酶处理前后威兰胶样品中的水分、蛋白质及多糖含量
2.3.2 表观粘度 超高粘度是威兰胶最突出的特性,因而酶法除蛋白应确保酶处理后威兰胶能保持这一优良特性。如图5所示,酶处理后,0.1%、1%威兰胶表观粘度值基本没有改变。同时,酶处理前后样品均表现出“剪切变稀”的假塑性流体特性。

图5 酶处理前后威兰胶样品表观粘度比较Fig.5 Viscosity comparison of welan gum before and after enzymatic treatment
3 结论
对商品化的威兰胶进行了中性蛋白酶除蛋白研究。通过单因素实验和正交优化实验,确定其最优除蛋白工艺为:威兰胶浓度1%、温度50℃、pH6.5、酶底比1mL/g。最后,制备了低蛋白威兰胶样品,其中,蛋白质含量从初始20.8%下降到9.7%,多糖含量由70.5%升高至80.9%,同时该样品保持了初始威兰胶样品的高粘度特性。
[1]KS Kang,GT Veeder. Heteropolysaccharide S-130[P]. US 4342866 A,1982.
[2]H Li,H Xu,H Xu,et al. Biosynthetic pathway of sugar nucleotides essential for welan gum production inAlcaligenessp. CGMCC2428[J]. Applied Microbiology and Biotechnology,2010,86(1):295-303.
[3]S Li,H Xu,H Li,et al. Optimizing the production of welan gum byAlcaligenesfacalisNX-3 using statistical experiment design[J]. African Journal of Biotechnology,2010,9(7):1024-1030.
[4]AM Fialho,LM Moreira,AT Granja,et al. Occurrence,production,and applications of gellan:current state and perspectives[J]. Applied Microbiology and Biotechnology,2008,79:889-900.
[5]M Tako,ASakae,S Nakamura. Rheological properties of welan gum in aqueous media[J]. Biological Chemistry,1990,54(12):3079-3084.
[6]S Campana,C Andrade,M Milas,et al. Polyelectrolyte and rheological studies on the polysaccharide welan[J]. International Journal of Biological Macromolecules,1990,12(6):379-384.
[7]L Ma,Q Zhao,C Yao,et al. Impact of welan gum on tricalcium aluminate-gypsum hydration[J]. Materials Characterization,2012,64:88-95.
[8]DH Hoskin,TO Mitchell,P Shu. Oil reservoir permeability profile control with crosslinked welan gum biopolymers[P]. US 4991652 A,1991.
[9]曹花. 微生物多糖威兰胶的提取工艺研究[D]. 无锡:江南大学,2010.
[10]韩冠英,凌沛学,王凤山. 黄原胶纯化工艺研究进展[J]. 中国生化药物杂志,2012,33(1):87-89.
[11]X Wang,Y Yuan,K Wang,et al. Deproteinization of gellan gum produced by Sphingomonas paucimobilis ATCC 31461[J]. Journal of Biotechnology,2007,128:403-407.
[12]欧文,黄榕彬,曹轩,等. 荠菜多糖提取液的除蛋白工艺研究[J]. 化工技术与开发,2012,41(11):7-10.
[13]李莎. 威兰胶发酵工艺优化及结构性能的研究[D]. 南京:南京工业大学,2005.
[14]蒋芸. 新型微生物多糖威伦胶的发酵工艺研究[D]. 无锡:江南大学,2008.
[15]周浩然. 微生物多糖威兰胶生产工艺的研究[D]. 无锡:江南大学,2009.
[16]姬彬. 威兰胶发酵及其流变性研究[D]. 无锡:江南大学,2012
[17]李会. Alcaligenes sp. NX-3生物合成威兰胶的代谢途径与过程控制研究[D]. 南京:南京工业大学,2011.
[18]OH Lowry,NJ Rosenbrough,AL Farr,et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265-275.
[19]M Dubois,KA Gilles,JK Hamilton,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28:350-356.
Study on deproteinization of welan gum with neutral protease
DENG Kuan,LI Na,SHAO Chuang,DUAN Neng,ZHANG Wang-zhong,ZHAO Meng*
(School of Food and Pharmaceutical Engineering,Hubei University of Technology,Wuhan 430068,China)
The deproteinization condition of neutral protease for welan gum and the effect of hydrolysis on welan gum properties were investigated. The conditions for neutral protease to hydrolyze protein in welan gum sample were optimized through the single factor and the orthogonal experiments. The optimal welan concentration,reaction temperature,pH and enzyme/substrate dosage of deproteinization were 1%,50℃,pH6.5 and 1mL/g,respectively. After hydrolysis for 6h under these optimal conditions,the deproteinization ratio was about 65.3%. The main component contents and apparent viscosity of welan gum samples were compared before and after the enzymatic treatment. Results showed that neutral protease reduced the protein content and increased the polysaccharide content,on the premise of maintaining the high-viscosity characteristic of welan gum. Deproteinization with neutral protease is an effective method to prepare welan gum sample with low protein and good properties.
welan gum;deproteinization;neutral protease
2014-05-04
邓宽(1991-),女,学士,研究方向:食品功能因子的保护和增益。
湖北省大学生创新创业训练计划项目(201310500020)。
TS201.1
A
1002-0306(2015)07-0093-04
10.13386/j.issn1002-0306.2015.07.010
*通讯作者:赵萌(1983-),博士,讲师,研究方向:食品功能因子的保扩和增益。
