环境因子及接种量对单增李斯特菌生长/非生长界面的影响
2015-05-08周小红李学英杨宪时刘尊雷
周小红,李学英,杨宪时,刘尊雷
(中国水产科学研究院东海水产研究所,上海 200090)
环境因子及接种量对单增李斯特菌生长/非生长界面的影响
周小红,李学英,杨宪时*,刘尊雷
(中国水产科学研究院东海水产研究所,上海 200090)
单增李斯特菌在实验设定的环境条件下,通过10倍梯度稀释将菌悬液分别稀释到101、103、105、107CFU/mL四个接种水平,然后接种到TSB-YE肉汤中,培养基置于恒温培养箱中进行培养,然后通过肉眼观察培养基浊度并结合涂布TSA-YE平板对其生长/非生长情况进行判定,通过Logistics多项式回归模型对处理的数据建立了单增李斯特菌生长/非生长的界面模型。实验结果表明不同生长温度,pH和盐度的交互作用对单增李斯特菌的生长/非生长界面的影响较大,接种量的大小也会影响单增李斯特菌生长/非生长过渡区域的具体位置,但具体原因和作用机制还有待进一步研究。该研究为抑制单增李斯特菌生长的环境因子条件范围和实际产品中的污染严重程度提供一定的参考依据,对于有潜在单增李斯特菌污染的产品来说,这为加强产品的栅栏因子,优化工艺条件以提高其安全度也提供了重要的参考。
单增李斯特菌,生长/非生长界面,影响
微生物生长/非生长模型描述了栅栏因子的协同作用对微生物生长的影响,这些模型特别适合用来评估温和加工食品中微生物暴露量的风险性[1]。大部分已建立的生长/非生长模型是基于环境因素如温度、盐度(水分活度)、pH和抑菌剂等,而这些研究是在含有较高接种量的实验培养基进行的[2]。然而食品中发生致病或导致中毒等检测到的微生物浓度往往较低。许多食源性致病菌在较低剂量就能使人感染或中毒,尤其是对于一些免疫力低下的人群[3]。
一些研究中有报道微生物的污染程度对于微生物的生长有显著影响,因此在建立微生物生长模型中应该考虑微生物的接种水平。本文探讨了不同温度、盐度和pH的交互作用对单增李斯特菌生长/非生长情况的影响,并且测定了所设定环境条件下不同接种水平对单增李斯特菌生长状况的影响,旨在分析除了温度、盐度和pH交互作用对微生物生长的影响外,进一步探讨不同微生物接种水平对微生物生长的影响,为微生物生长/非生长界面受环境因子及微生物接种水平的影响提供定量的参考数据,并为实际生产过程中食品中微生物生长/非生长界面模型的建立提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
实验菌种单核细胞增生李斯特菌(LM54001) 购自中国药品生物制品研究所;含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE),含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE),脑心浸液(BHI) 均为北京陆桥技术有限公司提供。
Sensitire Automated Microbiology System微生物鉴定和药敏分析仪 英国TECK Diagnostic Systems公司;ESCO CA2-4A1生物安全柜 上海生叉仪器有限公司;LabMASTER-aw型水分活度仪 瑞士Novasina公司;YXQ-LS-50SII全自动立式压力蒸汽灭菌锅 上海博讯实业有限公司;Sanyo MIR 253、553高精度培养箱 日本三洋科研设备公司;Sanyo MIR 150、153恒温培养箱 日本三洋科研设备公司;pHS-3C型数显酸度计 上海伟业仪器厂;SA-960-II SHJ-系列净化工作台 上海净化设备厂;721型可见光分光光度计 上海菁华科技仪器有限公司。
邻苯二甲酸氢钾、硼砂、磷酸氢二钠、氢氧化钠、盐酸等化学试剂(AR) 均由国药集团化学试剂上海分公司提供。
1.2 实验方法
1.2.1 菌悬液的准备 菌株采取斜面低温保藏法[4]于4℃冰箱中保藏。每月移种一次,实验前用无菌接种环挑取一至两环加入无菌TSB-YE液体培养基中,37℃[5]下培养至菌液浓度达到108CFU/mL[6],以作为菌悬液备用。
1.2.2 实验设计 为了了解单增李斯特菌在各环境因子和不同接种水平下的生长/非生长界面,本实验采用部分分析因子设计方案。因子和水平的选择主要基于前期实验的单因素实验[7]以及一些相关参考文献[8]。选择接种量、温度、盐度和pH四个因素,其中接种量分别为101、103、105、107CFU/mL,温度分别为0、4、10、15、20、25、30℃,盐度分别为0.5%、2.5%、4.5%、6.5%、8.5%,pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,实验结合TSB-YE培养基和涂布TSA-YE平板对单增李斯特菌的生长与非生长状况进行了全因子实验。
1.2.3 生长/非生长实验 根据实验设计,配制TSB-YE液体培养基,调节其盐度、pH到各实验所需的条件下,然后将各培养基分装到各个试管中,121℃下灭菌20min。将菌悬液分别以10倍梯度稀释到101、103、105、107CFU/mL四个接种水平,单增李斯特菌的初始接种量通过涂布TSA-YE平板计算得到。各试管震荡混匀后放入相应温度的恒温培养箱,根据前期的实验结果,分别培养不同的时间,每组实验做两个平行,培养结束后观察各试管的混浊度。如果试管中菌液混浊度明显,则判定其生长,并记为1,对于菌液混浊度不明显或者有质疑的试管。则对该试管进行涂布确认,并将菌种培养48h后的菌落总数与初始接种菌数进行比较,如果最终的菌量比初始接种量多于0.5logCFU/mL[9],则判定单增李斯特菌生长,并记为1,否则记为0。对于实验结果与预测结果有偏差的实验数据,按上述方法再次进行重新测定确认,如果还是与预测结果不符,则作为异常点保留。
1.2.4 模型的建立 采用多项式logistic回归模型来拟合实验数据,分析方法通过R软件的GLM函数实现。该模型是由Ratowsky[10]等人通过微生物生长动力学模型修正而来,此模型为概率模型,通过似然比卡法统计量来检验模型的拟合效果。该模型描述了微生物的生长概率与不同的培养温度,培养基的pH,NaCl浓度之间的关系,具体模型如下:
Logit(p)=ln[p/(1-p)]=F
式(1)
式(1)中,p为微生物生长概率,p∈(0,1),F如下:
F=a0+a1T+a2pH+a3bw+a4TpH+a5Tbw+a6pHbw+a7T2+a8pH2+a9bw2
式(2)
式中ai为模型拟合参数(i=0,1,2,3……9);T为微生物培养温度;pH为培养基的pH;bw=(1-aw)0.5,aw为培养基水分活度。
为了更好地阐述该回归模型在描述单增李斯特菌的生长/非生长界面的生物学意义,令p=0.1、0.5、0.9并用Microsoft Excel Solver来计算这三种情况下生长/非生长界面上的预测T、pH和bw值。
2 结果与分析
2.1 生长/非生长实验设计数据及结果
不同接种量单增李斯特菌在不同生长温度、盐度和pH条件下的生长/非生长实验设计及接种量为101CFU/mL时的生长/非生长情况如表1,其中“1”表示生长,“0”表示不生长。从所选的数据可以看出单增李斯特菌在低温下(15℃以下)出现生长情况较少,温度越低则出现生长情况越少,盐度越高则出现的生长情况也越少;如在15℃、pH5.5时,单增李斯特菌生长较非生长多,pH≥6.0时,在所有测定的盐度下生长的情况等于1,而pH为4.5时,生长的情况均为0。因此可以看出pH(4.0~7.5范围内)高的环境更利于该菌株的生长。从所选数据可以得出温度,pH和盐度对单增李斯特菌的交互影响较为明显。当盐度为4.5%,温度为15℃,pH为5.0时,单增李斯特菌不生长,而保持盐度,温度不变,pH为6.0时,单增李斯特菌则生长;当保持温度,pH不变,盐度为2.5%时,则单增李斯特菌出现生长。
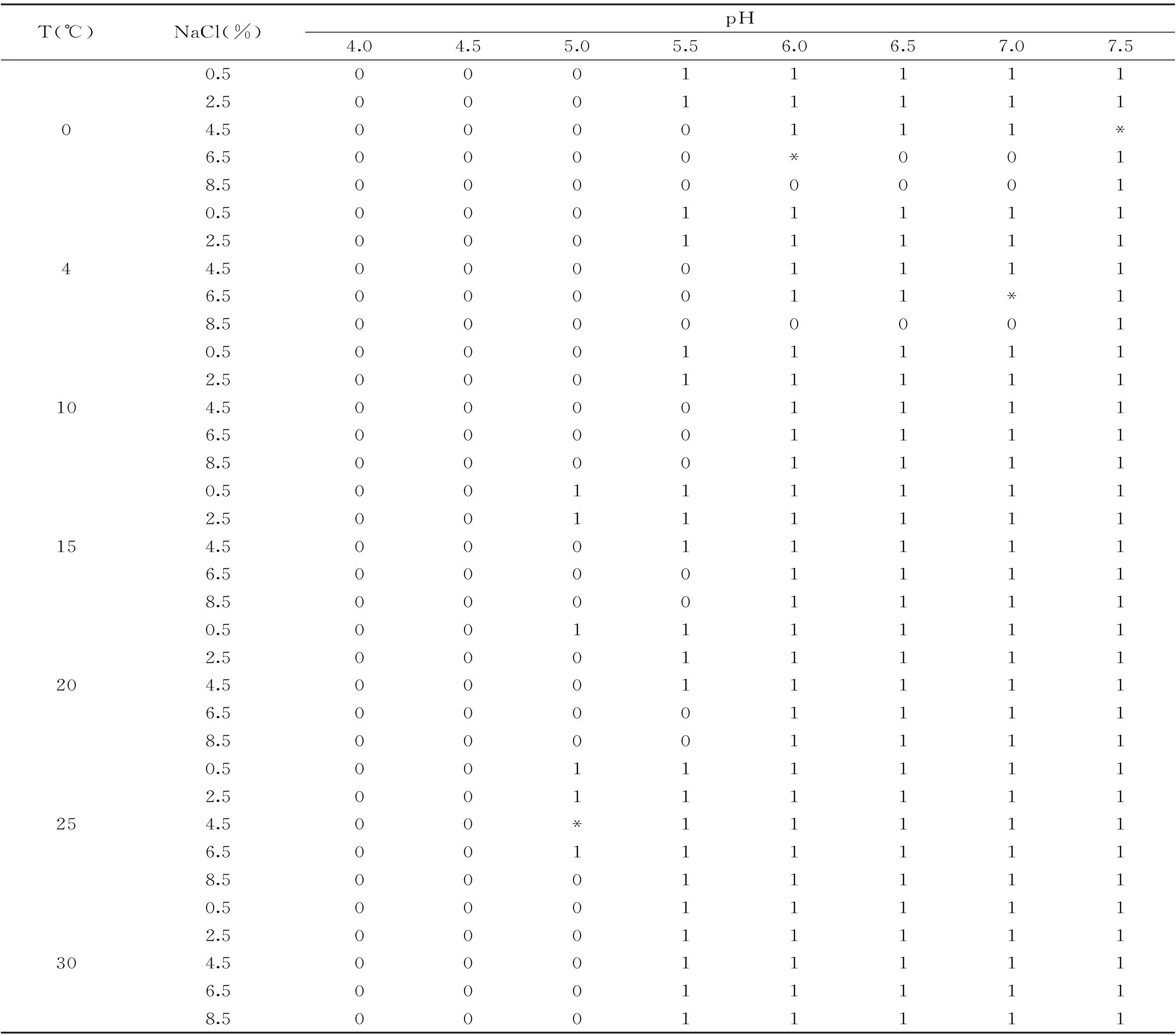
表1 实验设计表及结果
注:“*”表示异常点。
2.2 模型拟合结果及分析
单增李斯特菌在不同接种水平下的生长/非生长界面的logistic回归模型相关参数的预测值和标准偏差如表2所示。所有实验数据经过Excel表处理后,通过R软件的GLM函数对生长/非生长界面的logistic回归模型拟合计算后,得到的各个参数预测值和标准差(p<0.05),从表中数据可看出,各预测值和标准差的相关性较好。

表2 不同接种量单增李斯特菌生长/非生长界面logistic回归模型预测值和标准差
2.3 接种量对单增李斯特菌生长概率的影响
图1为25℃条件下接种量分别为101、103、105、107CFU/mL的单增李斯特菌生长/非生长界面的横截图[11]。
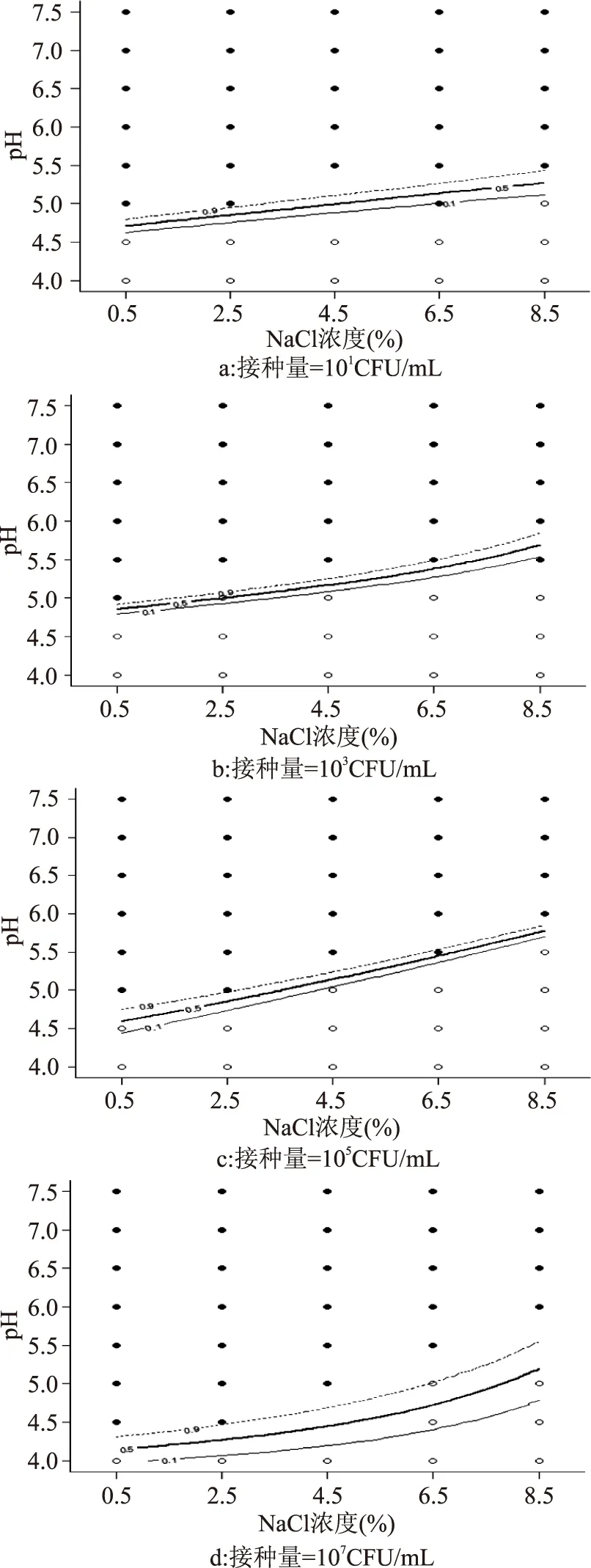
图1 不同接种量单增李斯特菌对应的生长/非生长界面截面图Fig.1 Predicted growth/no growth interfaces with respect to pH and salinity at 25℃,for Listeria monocytogenes注:图中“○”表示单增李斯特菌生长概率为0;“●”表示单增李斯特菌生长概率为1。虚线表示p为0.1的生长/生长界线,实现表示p为0.5的生长/生长界线,点线表示p为0.9的生长/生长界线。三条线之间的区域为p∈[0.1,0.9]转换区域,图2~图4同。
由图1的截面图可以看出,pH和盐度对单增李斯特菌生长/非生长的交互影响较显著,而随着接种水平的变化,生长与非生长界面的过渡区域开始发生移动,在接种浓度较低如由101CFU/mL增加到103CFU/mL时,生长与非生长界面的变化还不是很明显,而当接种浓度达到105CFU/mL和107CFU/mL时,生长与非生长界面明显向下移动。接种浓度越大,抑制微生物生长所需的条件越严苛。而且接种浓度不同,0.1、0.5、0.9三条生长/生长界线间的转换区域宽度也不同,接种量为107CFU/mL时,生长非生长界面在p∈[0.1,0.9]转换区域最平缓。所以接种量对微生物生长/非生长还是会产生一定的影响,这可能与初始接种菌数对微生物的生长起点会产生影响有关,也可能与菌种细胞间的相互作用有关,其具体作用机制和产生此结果的原因还有待进一步的研究,
2.4 环境因子对单增李斯特菌生长概率的影响
绘制不同温度,盐度和pH下p=0.1、0.5、0.9时的生长/非生长界线,见图2~图4。转换区域之外的空间即为微生物生长和不生长两种状态,这对实际生产来说是最有意义。
2.4.1 温度对单增李斯特菌生长概率的影响 15、20、25、30℃下盐度和pH的交互作用对单增李斯特菌的生长概率影响的生长/非生长界面见图2,从图2中可以看出,随着温度的增加,转化区域在下移,出现绝对增长的情况变多;随着温度的降低,三条曲线的距离逐渐缩短,转换区域在缩小,即较低的温度下,pH和水分活度发生较小的变化时,便会对单增李斯特菌的生长概率造成极大的影响。这个和其他文献里面报道的情况相同[12-13]。单增李斯特菌是一种对环境耐受力极强的嗜冷菌,但是由于在低温下其生长情况较不太稳定,建模数据不及温度高一些的理想,这样会影响建模的结果,因此文章选取了10℃以上的温度。从图中可以看出,15℃下单增李斯特菌在盐度较低,pH接近中性或偏碱性的情况下生长较旺盛。当盐度为6.5%,pH5.5时,只有在15℃以下,单增李斯特菌的生长才会受到抑制,而当温度越高时,盐度处在单增李斯特菌生长较理想的盐度时,单增李斯特菌的生长已经不受pH的抑制。例如,当T=30℃,盐度为4.5%,pH5.0时,单增李斯特菌在p=0.5的生长概率为1,即判定为生长。很明显地可以看出,温度对p∈[0.1,0.9]转换区域影响较大。
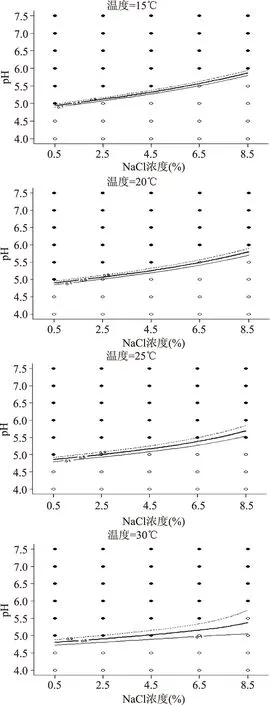
图2 不同温度时单增李斯特菌生长/非生长界线图Fig.2 Growth/no growth boundaries at different tempreature for the predicted growth probability of Listeria monocytogenes
2.4.2 盐度对单增李斯特菌生长概率的影响 NaCl浓度为2.5%、4.5%、6.5%和8.5%时,单增李斯特菌的生长/非生长界面见图3。从图3中可以看出,盐度越高,其转换区域往温度和pH高的地方移动。图中很明显地看出,盐度对单增李斯特菌生长概率的影响较大。pH很低时,盐度对单增李斯特菌的抑制作用增强。当盐度较高时,可以在较高的温度下,抑制单增李斯特菌的生长。例如当盐度为8.5%时,温度在15℃以下时,单增李斯特菌在pH<6.0条件下均受到抑制,而当盐度为2.5%时,pH<5.0时其生长才受到抑制,说明温度较低时,盐度对单增李斯特菌生长的影响较大。当盐浓度较低时,温度和pH的交互作用对单增李斯特菌生长抑制的影响较大。本实验是通过调节培养基盐度来测得其对单增李斯特菌生长的影响,而NaCl达到一定浓度会形成高渗透压,会对细菌有着一定的抑制作用,所以盐度对单增李斯特菌的生长会产生较大的影响。
2.4.3 pH对单增李斯特菌的生长概率的影响 pH在4.0、5.0、6.0和7.0时单增李斯特菌的生长/非生长界面见图4。当pH越高时,单增李斯特菌的生长状况越好。当pH=7.0时,在实验设定的温度和盐度范围内,单增李斯特菌的生长完全不受抑制,而当pH=4.0时,不论温度和盐度如何变化,单增李斯特菌都不生长,即生长受到完全抑制。在pH=5.0和pH=6.0时,单增李斯特菌的生长/非生长转换区域往盐度高和温度低的方向移动。当pH越高时,或者处于微酸性或中性时,抑制单增李斯特菌生长时的盐度和温度条件越苛刻。而pH达到4.0时,其他两个因子的交互作用对单增李斯特菌生长的影响不大。有学者报道单增李斯特菌的生长pH为4.3~9.6[14],最适pH为中性至弱碱性[15]。这说明当微生物所处环境因子之一接近极限值时,其余因子对微生物生长的影响会很小[16-17]。实验数据显示,pH在7和7.5时,单增李斯特菌的生长情况较类似,这也说明单增李斯特菌较适宜在中性或弱碱性环境中生长。这个对于实际产品的生产尤为重要,为了抑制单增李斯特菌生长时,可以通过添加一些食用有机酸适当地降低产品的pH。从图4可以看出,当pH为6.0,盐度低于8.5%时,单增李斯特菌可以在各温度下生长,温度起不到抑制其生长的作用。
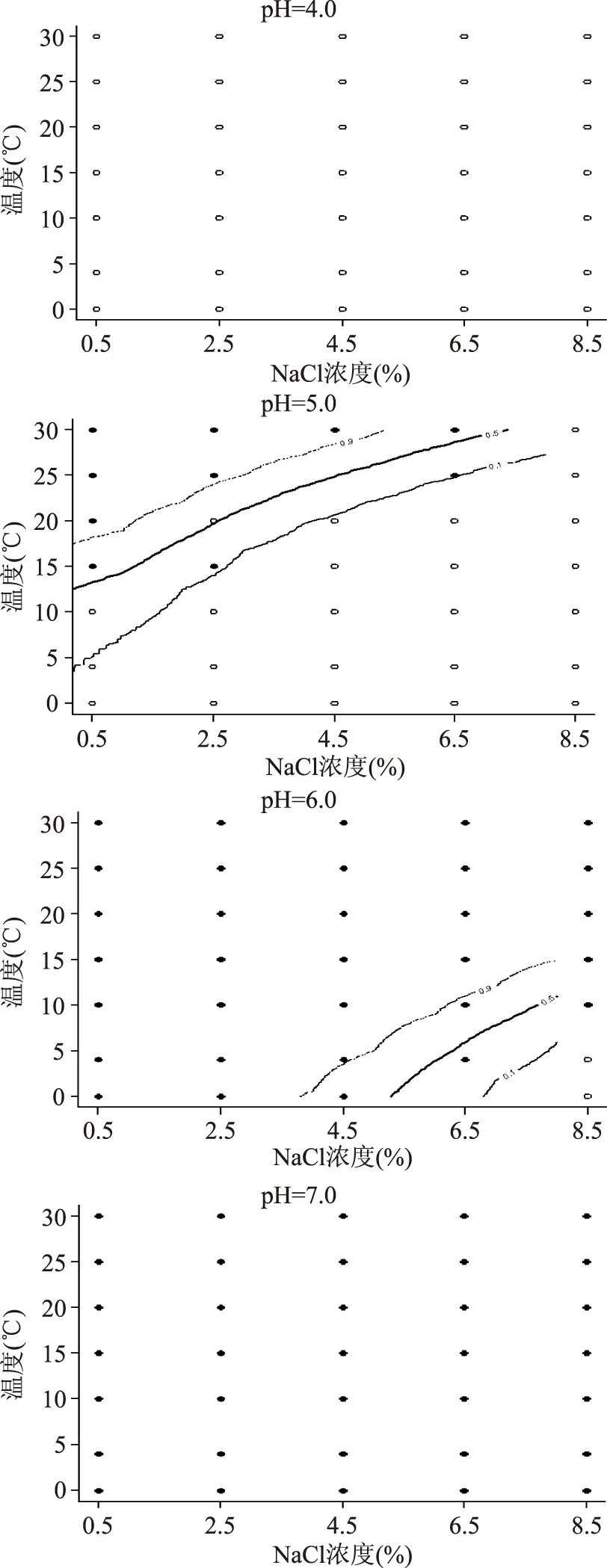
图4 不同pH时单增李斯特菌的生长/非生长界线图Fig.4 Growth/no growth boundaries at different pH for the predicted growth probability of Listeria monocytogenes
3 结论与讨论
微生物安全问题是食品界最为突出的问题,如何抑制食品中有害微生物的生长并极大延长产品的货架期是食品制造商最为关心的话题。随着食品预测微生物的发展,有关微生物的各种预测模型被建立,这些模型不仅摒弃了传统预测方法的耗时,耗力和耗财的缺点,同时也大大增加了预测结果的准确性。根据预测模型,可以得到在不同的环境条件例如温度、pH、盐度(水分活度)下的微生物生长情况,从而制定出更为严格、更为安全的生产工艺。研究人员更多地是建立微生物生长动力学模型用来计算产品的货架期,然而这类模型只能给出微生物生长的信息,却不能给出微生物不生长的信息。与腐败菌达到一定数量食品才会出现问题不同,致病菌处于任何生长期都有引起中毒的潜在危险,对于含有潜在致病菌和产毒素菌株的食品来说,描述其生长/非生长情况比描述其生长速率更有意义[18]。
从图2~图4中可以很明显地看出不同生长温度,pH和盐度的交互作用对单增李斯特菌的生长/非生长界面的影响较大。同时实验表明通过适当降低生长温度和pH以及提高培养基的盐度可以有效地抑制单增李斯特菌的生长。生长/非生长界面图可以很直观地描述不同环境因子之间的交互作用对单增李斯特菌生长概率的影响。同时,如图1所示,接种量对单增李斯特菌的生长/非生长过度界面也有一定的影响,这可能与初始接种菌数对微生物的生长起点会产生影响有关,也可能与菌种细胞间的相互作用有关。但是具体作用机制和产生此结果的原因还有待进一步的研究,因此本研究结果只能提供有限参考。生长/非生长模型能描述出微生物不生长情况,通过得到抑制微生物生长的环境因子组合可以有效地防止微生物对产品的污染,可以作为新产品研发或者风险评估时的依据,通过得到特定环境条件下产品中主要致病菌或腐败菌的生长概率,更好地优化生产工艺以抑制这类微生物的生长,提高产品的安全性。但是文中只选取了三个环境因子,而实际产品中由于多种防腐剂的添加,或者辐照等工艺的加入,环境条件要更为复杂。本文中建立的logistic回归模型可以为抑制单增李斯特菌生长的环境因子条件范围和实际产品中的污染严重程度提供一定的参考依据,对于有潜在单增李斯特菌污染的产品来说,这为加强产品的栅栏因子,优化工艺条件以提高其安全度也提供了重要的参考。但是由于实验中采用的基质是TSB-YE液体培养基,相对于实际产品来说,条件较为苛刻,而实际产品更利于微生物的生长,同时由于各企业的标准不一样,因此划定生长/非生长的界线标准也与本文中不一样,这样也会导致生长/非生长界面模型的差异。因此需要进一步以实际产品为基质,研究单增李斯特菌的生长情况并建立特定产品的生长/非生长界面模型。
[1]Gysemans K P M,Bernaerts K,Geeraerd A H,et al. Exploring the performance of logistic regression model types on growth/no growth data ofListeriamonocytogenes[J]. International Journal of Food Microbiology,2007,114:316-331.
[2]Pascual C,Robinson T P,Ocio M J,et al.The effect of inoculum size and sublethal injury on the ability of Listeria monocytogenes to initiate growth under suboptimal conditions[J]. Letters in Applied Microbiology,2001,33:257-361.
[3]Ross T,Dalgaard P,Tienungoon S. Predictive modeling of the growth and survival of Listeria in fishery products[J]. International Journal of Food Microbiology,2000,62:231-245.
[4]吕红线,郭利美.工业微生物菌种的保藏方法[J].山东轻工业学院学报,2007,21(1):52-55.
[5]刘柳,孙保华.温度及气调包装对冷却猪肉中单核细胞增生性李斯特菌生长的影响[J].食品科学,2008,29(1):334-337.
[6]李燕杰,朱小花,阴冠秀,等.不同方法观察单增李斯特菌生物被膜的比较研究[J].食品工业科技,2010,31(10):241-246.
[7]周小红,李学英,杨宪时,等.培养条件对单增李斯特菌生长的影响[J].食品工业科技,2013,34(15):140-148.
[8]Koutsoumanis K,Sofos J N.A comparative study on growth limits ofListeriamonocytogenesas affected by temperature,pH and aw when grown in suspension or on a solid surface[J]. Food Microbiology,2004,21:415-422.
[9]Skandamis P N,Stopforth J D,Kendall P A,et al. Modeling the effect of inoculum size and acid adaptation on growth/no growth interface of Escherichia coli O157∶H7[J]. International Journal of Food Microbiology,2007,120(3):237-49.
[10]Ratkowsky D. Some examples of,and some problems with,the use of nonlinear logistic regression in predictive Food Microbiology[J].International Journal of Food Microbiology,2002,73:119-125.
[11]Lothar L. Basic aspects of food preservation by hurdle technology[J]. International Journal of Food Microbiology,2000,55(1-3):181-186.
[12]Presser K,Ross T,Ratkowsky D. Modelling the growth limits(growth/no growth interface)of Escherichia coli as a function of temperature,pH,lactic acid concentration,and water activity[J]. Applied and Environmental Microbiology,1998,64(5):1773-1779.
[13]Stewart C M,Cole M B,Legan J D,et al. Staphylococcus aureus growth boundaries:moving towards mechanistic predictive models based on solute-specific effects[J]. Applied and environmental microbiology,2002,68(4):1864-1871.
[14]Jeffery M,Farber. Present situation in Canada regardingListeriamonocytogenesand ready-to-eat seafood products[J]. International Journal of Food Microbiology,2000,62:247-251.
[15]沈晓盛,郑国兴,李庆,等. 食品中单核细胞增生李斯特菌的危害及其检测[J]. 食品与发酵工业,2004,30(8):87-91.
[16]Lanciottir,Sinigagllam,Gardini F,et al. Growth/no growth interfaces of Bacillus cereus,Staphylococcus aureus and Salmonella enteritidis in model systems based on water activity,pH,temperature and ethanol concentration[J]. Food microbiology,2001,18(6):659-668.
[17]Quintavallas,Parolari G. Effects of temperature,aw and pH on the growth of Bacillus cells and spores:a response surface methodology study[J]. International journal of food microbiology,1993,19(3):207-216.
[18]陈琛,杨宪时,李学英,等. 蜡样芽胞杆菌生长/非生长界面模型的建立和评价[J]. 食品与发酵工业,2013,39(5):18-24.
Impact of environmental factors on growth/no growth interface model ofListeriamonocytogenesunder different inoculum size
ZHOU Xiao-hong,LI Xue-ying,YANG Xian-shi*,LIU Zun-lei
(East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai 200090,China)
The growth/no growth responses ofListeriamonocytogeneswere monitored at different environmental factors,and inoculated concentration at four levels(101,103,105,107CFU/mL)by means of 10-fold dilution into tryptic soy broth added with 0.6% yeast extract(TSB-YE),and then cultivated in constant temperature incubator. The study was carried on tryptic soy agar added with 0.6% yeast extract(TSA-YE)plates and growth was monitored visually by observing the turbidity of the medium combined with plate counts. The growth/no growth interface ofListeriamonocytogeneswas modeled by using logistic polynomial regression. Results showed that the hurdle effects of temperature,salinity and pH had a significant influence on the growth/no growth ofListeriamonocytogenes,and inoculation size also had certain impact on the specific position of transition areas on growth/no growth interface ofListeriamonocytogenes,but its mechanism and more details need to be further discussed. This study provided certain references for controlling environmental factors to inhibit the growth of theListeriamonocytogenesand predicting the pollution extent in practical products. For products which have a potential risk ofListeriamonocytogenescontamination,this study also provided an important reference in strengthening the hurdle factors,optimizing process conditions and improving safety for real products.
Listeriamonocytogenes;growth/no growth interface;impact
2014-05-04
周小红(1988-),女,硕士,研究方向:食品科学与工程。
*通讯作者:杨宪时(1954-),男,本科,研究员,研究方向:水产品加工与贮藏。
农业部引进国际先进农业科学技术项目 (2011-Z12)。
TS201.3
A
1002-0306(2015)07-0053-07
10.13386/j.issn1002-0306.2015.07.002
