温度对水酶法大豆油氧化稳定性影响
2015-05-05马文君齐宝坤江连洲
李 杨,马文君,齐宝坤,王 晶,李 丹,曹 亮,江连洲
(东北农业大学食品学院,黑龙江哈尔滨 150030)
温度对水酶法大豆油氧化稳定性影响
李 杨,马文君,齐宝坤,王 晶,李 丹,曹 亮,江连洲*
(东北农业大学食品学院,黑龙江哈尔滨 150030)
本文以水酶法提取的大豆油为原料,在不同温度、时间条件下,以大豆油的过氧化值、p-茴香胺值、共轭二烯、共轭三烯值为评价指标,评价其氧化稳定性。基于过氧化值变化确定氧化诱导时间IP,通过阿伦尼乌斯方程得到水酶法大豆油的活化能。结果表明:随着时间的延长水酶法大豆油的过氧化值、p-茴香胺值、共轭二烯、共轭三烯值均增大,其中在60℃条件下过氧化值与储藏时间呈显著相关;水酶法大豆油的活化能为72.10kJ/mol。水酶法大豆油在储藏过程中要注意低温保藏。
大豆油,温度,诱导期,氧化稳定性
油脂中不饱和脂肪酸与氧气发生反应是导致食品劣变主要原因之一。人们长期食用氧化的油脂,由于其富含自由基,将会促发癌症的产生[1]。油脂氧化产物主要包括氧化初级产物和氧化次级产物[2]。温度在评价油脂氧化程度中起到重要作用,它决定氧化初级产物氢过氧化物的裂解程度[3]。氢过氧化物裂解形成次级氧化产物使得食物产生不良风味如哈喇味。目前,没有一个标准方法可以说明油脂在氧化过程中发生的变化[4]。因此,要从整体评价油脂氧化状态必须同时分析油脂初级和次级氧化产物。在正常情况下,油脂由诱导期到氧化期的时间较长,测定诱导时间耗时耗力,一般采用加速氧化的方法,测定油脂的诱导时间来说明其氧化稳定性。
水酶法提油是通过机械破碎破坏油料的子叶细胞或脂蛋白、脂多糖的复合结构,经过酶解,使得油脂从中释放出来,基于油相与水相密度差异及不相溶性,用物理方式将其分离[5]。具有安全性高,无溶剂残留,条件温和等优势;能够同时得到变性程度较低的蛋白质、高品质的油脂以及其他功能成分[6]。对于水酶法提取的大豆油,其储藏稳定性尚未研究,国内至今还是空白。因此,本研究通过测定在不同温度和不同时间影响下的水酶法大豆油的过氧化值、p-茴香胺值、共轭二烯值、共轭三烯值的变化,确定其反应活化能。了解温度对其氧化稳定性的影响,为选择合理的贮存方式提供实验依据,从而为水酶法提取大豆油的全面认识提供理论基础。
1 材料与方法
1.1 材料与仪器
大豆片 产自吉林敦化;Protex 6L 无锡杰能科生物工程有限公司。
JE-502 电子天平 上海浦春计量仪器有限公司;HH-4 丹瑞数显恒温水浴锅 金坛市双捷实验仪器厂;PHS-25C 数字酸度计 上海大普仪器有限公司;LGR20-W 台式高速冷冻离心机 北京京立离心机有限公司;SC-3614 低速离心机 安徽中科中佳科学仪器有限公司;BGZ-246 电热鼓风干燥箱 上海博讯实业有限公司医疗设备厂;R205 旋转蒸发器 上海申胜生物技术有限公司;ZNCL 智能恒温磁力搅拌器 东西仪(北京)科技有限公司;1600PC 紫外-可见分光光度计 上海美谱达仪器有限公司;WSL-2 罗维朋比色计 浙江托普仪器有限公司;Agillent 6890-5973 气相色谱-质谱联用仪美国安捷伦公司。
1.2 实验方法
1.2.1 水酶法提取工艺要点 经过挤压膨化的大豆[8]经粉碎后,按料液比1∶5(g/mL)加入蒸馏水,置于恒温水浴锅中不断的搅拌,用NaOH调节pH至8.5,加入2%的Protease 6L碱性蛋白酶,恒温50℃下酶解3.0h后,升温至100℃灭酶5min,最后进行离心分离(4500r/min、20min),收集上层清油。吸取乳状液,进行冷冻解冻破乳,然后进行离心分离(10000r/min、15min),取上层清油,与第一次收集的油合并。冷冻保存。
1.2.2 水酶法提大豆油的工艺流程图

1.2.3 储藏条件对水酶法大豆油氧化稳定性的影响 采用Schaal 烘箱法进行加速氧化测试。所有油样均不加任何抗氧化剂或增效剂。称取50g的大豆油,放入100mL敞口烧杯,置于恒温烘箱内。在25、40、60和80℃黑暗条件下分别储藏60、30、12和6d。定时搅拌,每隔一定时间测定其理化指标。
1.2.4 过氧化值测定 参考Pegg方法测定[8]。准确称量样品0.3g,溶解在9.9mL氯仿∶甲醇(7∶3v/v)中,然后加入50.0μL,10mmol/L的二甲酚橙和50.0μL的氯化亚铁溶液。将上述混合溶液在室温下静置5min,在5℃,1000×g下离心5min,上清液用紫外可见分光光度计在560nm下测定吸光度。用三氯化铁溶液作为标准曲线,过氧化值表示毫克当量,计算公式如下:

其中:As-样品的吸光度;Ab-空白的吸光度;Mi-三氯化铁标准曲线斜率的倒数;W-样品的质量;55.84-铁的原子量(g/mol)。
1.2.5 p-茴香胺值测定 参考AOCS 2011 Cd-18-90方法[9]。称量2g油样置于25mL容量瓶中,用异辛烷溶解并稀释到刻度成为未反应溶液,用异辛烷溶剂作空白。吸取未反应溶液5mL置于带塞试管中,另一试管加入5mL异辛烷溶剂,分别加入1mL 0.25%(w/v)甲氧基苯胺乙酸溶液,振摇后静置10min,在350nm处分别测定上述溶液吸光度Ab和As。按下式计算p-茴香胺值:
其中:As-加入甲氧基苯胺试剂后油脂样品的吸光度;Ab-未加入甲氧基苯胺试剂的油脂样品的吸光度;m-油脂样品的质量,g。
1.2.6 共轭二烯、共轭三烯的测定 参考IUPAC(1979),II.D.23方法[10]。称取待测样品约0.05~0.25g,准确称至0.0001g,置于25mL容量瓶中。用异辛烷溶解并稀释到刻度,用异辛烷溶剂作空白,使用分光光度计测定在232、270nm的吸光度。按下式计算共轭二烯、共轭三烯值:
其中:E-紫外吸光度以浓度1g/100mL(1%)10mm比色皿波长λ测得吸光度表示;A(λ)-波长λ下试样吸光度;ϖ-测试溶液样品的浓度,单位为克每100毫升(g/100mL)。
1.2.7 数据统计与分析 所有的实验至少进行3次实验,利用SPSS Statistics 18.0软件对实验数据进行统计,采用Tukey’s 检验进行差异显著性分析;并进行油样的品质指标与加热时间的相关性分析和回归分析;应用Origin 8.5 进行作图。
2 结果与分析
2.1 储藏温度和时间对水酶法大豆油过氧化值的影响
在油脂自动氧化过程,会先经历缓慢的诱导期,然后是反应剧烈的氧化期。在诱导期会形成初级氧化产物(过氧化物),过氧化值(POV)可以定量反应油脂氧化生成氢过氧化物的多少,可以说明油脂品质的高低[11]。从表1中可以看出,水酶法大豆油在25、40、60、80℃时,随着储藏时间的增长过氧化值逐渐升高。储藏温度越高,大豆油的过氧化值增长速率也逐渐增大。在25℃条件下储藏60d的变化幅度较低。可以说明温度对油脂的氧化稳定性具有很大影响,温度越高,越容易导致自氧化而产生劣变,因此,水酶法大豆油应在较低的温度下储藏。
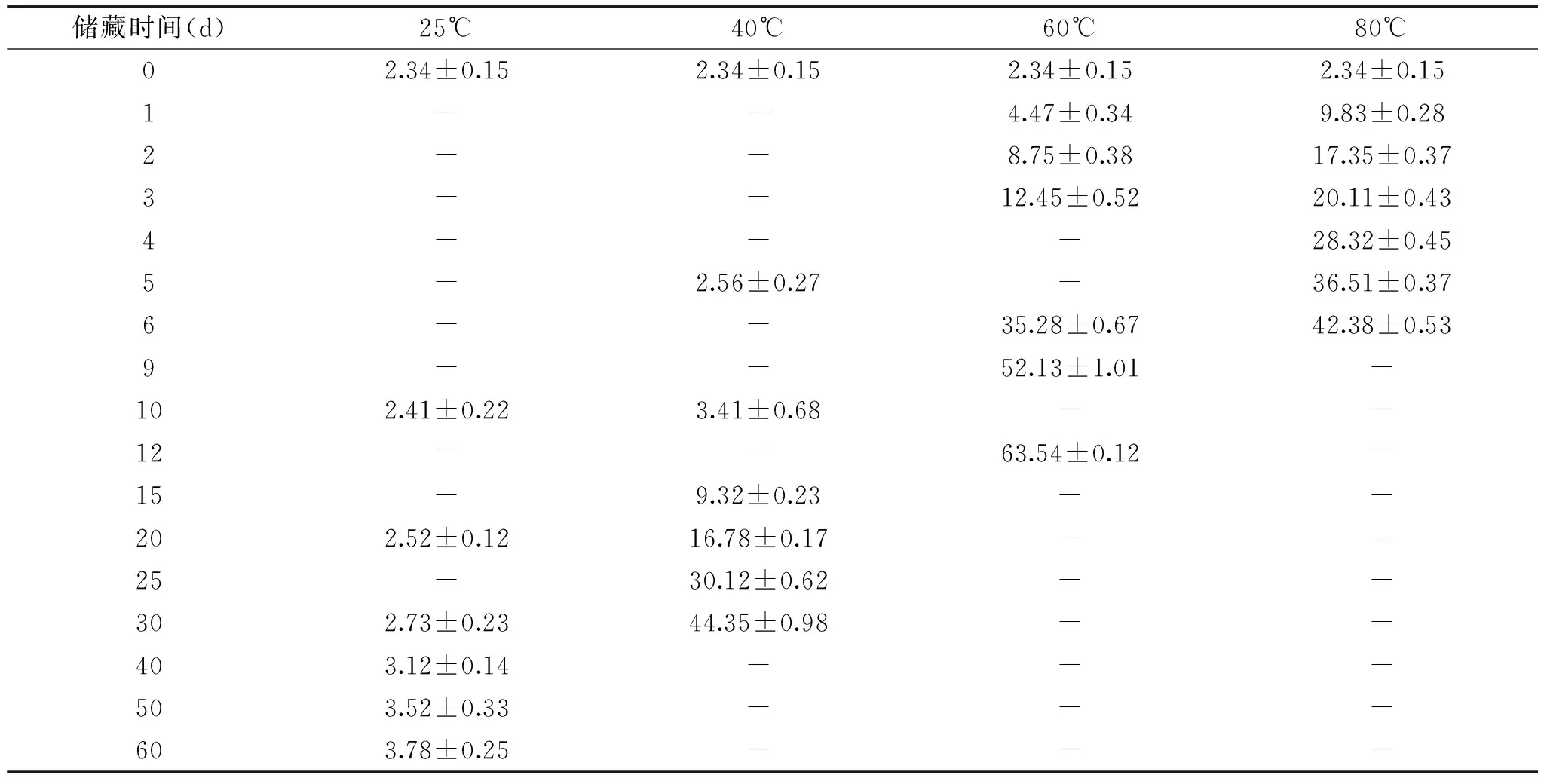
表1 不同温度和受热时间下水酶法大豆油过氧化值的测定结果(meqO2/kg)Table 1 Results of EAEP soybean oil POV under different temperatures and heated times(meqO2/kg)
利用表1中的实验数据,对自变量 x(储藏时间)和因变量 y(过氧化值)进行一元线性回归分析,得直线回归方程,再将各方程进行显著性检验,结果见表2。由方程的显著性检验结果可知:过氧化值与储藏时间有一定的相关性,相对而言,在60℃储藏时,具有更高的相关性。
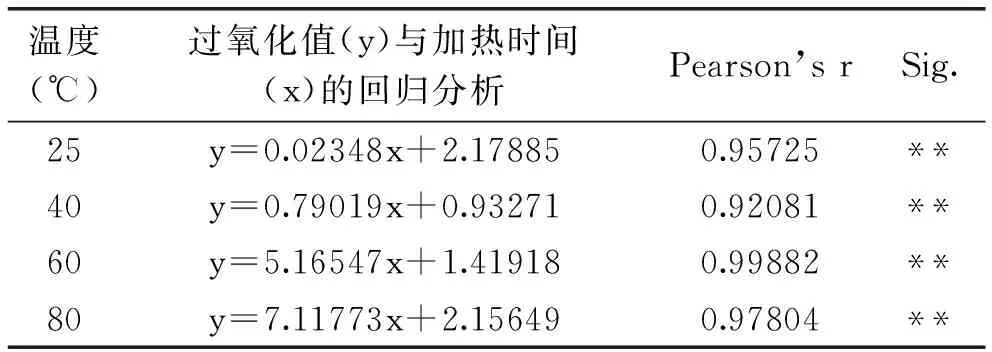
表2 回归方程检验结果Table 2 Tests results of the regression equation
2.2 水酶法大豆油的氧化动力学曲线
油脂在自动氧化过程中会经历诱导期和氧化期,分别生成初级氧化产物(过氧化物)和次级氧化产物(醛、酮等)。诱导期反应相对较为缓慢,主要为氢过氧化物的积累过程。诱导期后的氧化期,过氧化值会迅速升高,油脂品质开始下降[12]。油脂自动氧化过程中诱导期大氧化期之间时间的长短可以表明油脂氧化稳定性。
根据经典阿伦尼乌斯(Arrhenius)公式,反应速率常数k与温度T之间的关系如下:
ln k=ln k0-Ea/R(1/T)(k,k0,Ea,R,T分别为反应速率常数、指钱因子、活化能J/mol、气体常数8.314 J/K/mol、绝对温度)。根据曲线的斜率、截距可以确定活化能和指前因子。根据诱导期,计算反应活化能需对先前公式进一步变形,ln IP=ln kIP-EaIP/R(1/T)(kIP为指前因子)。
由表1计算可知水酶法大豆油在 25、40和60℃ 时的诱导期IP为22.9、8.9、1.1d。由图1可知大豆油的ln IP和1/T曲线具有较强的线性回归(R2=0.9734)。根据阿伦尼乌斯方程计算水酶法大豆油的反应活化能Ea分别为72.10 kJ/mol,略低于一级大豆油的活化能73.64 kJ/mol[13]。

图1 ln IP和1/T阿伦尼乌斯拟合曲线Fig.1 Arrhenius plot of natural log of the induction period (Ln IP)versus inverse absolute temperature(1/T)
2.3 储藏温度和时间对水酶法大豆油p-茴香胺值的影响
在氧化过程中,由于过氧化物的进一步降解,仅测定过氧化值并不能充分说明油脂氧化情况。因此,需要测定油脂的二级氧化产物。p-茴香胺值可以确定油脂二级氧化产物中不饱和羰基化合物尤其是α-不饱和醛含量的多少。其原理是基于醛中的羰基与p-茴香胺中的氨基发生反应,所形成的物质在350nm处有较强的吸收峰[14-15]。
分别对贮存在不同储藏条件下的大豆油的茴香胺值进行测定,结果如表3所示。p-茴香胺值具有与过氧化值相似的变化规律,在较高温度下储藏,p-茴香胺值变化速率较快,上升程度较高。说明大豆油的p-茴香胺值与储藏时间的长短、储藏温度的高低相关。另外,水酶法提取的大豆油没有经过精炼过程,含有较高的水分和挥发物质,导致其具有较高p-茴香胺值[16]。由于茴香胺值反映的是一级产物的降解情况,随着储藏温度的升高,氢过氧化物降解速率提高,p-茴香胺值提高。因此,在25℃储藏的大豆油的茴香值变化没有其他温度条件下变化的明显(p<0.01)。但整体上p-茴香胺值都处于增长状态。
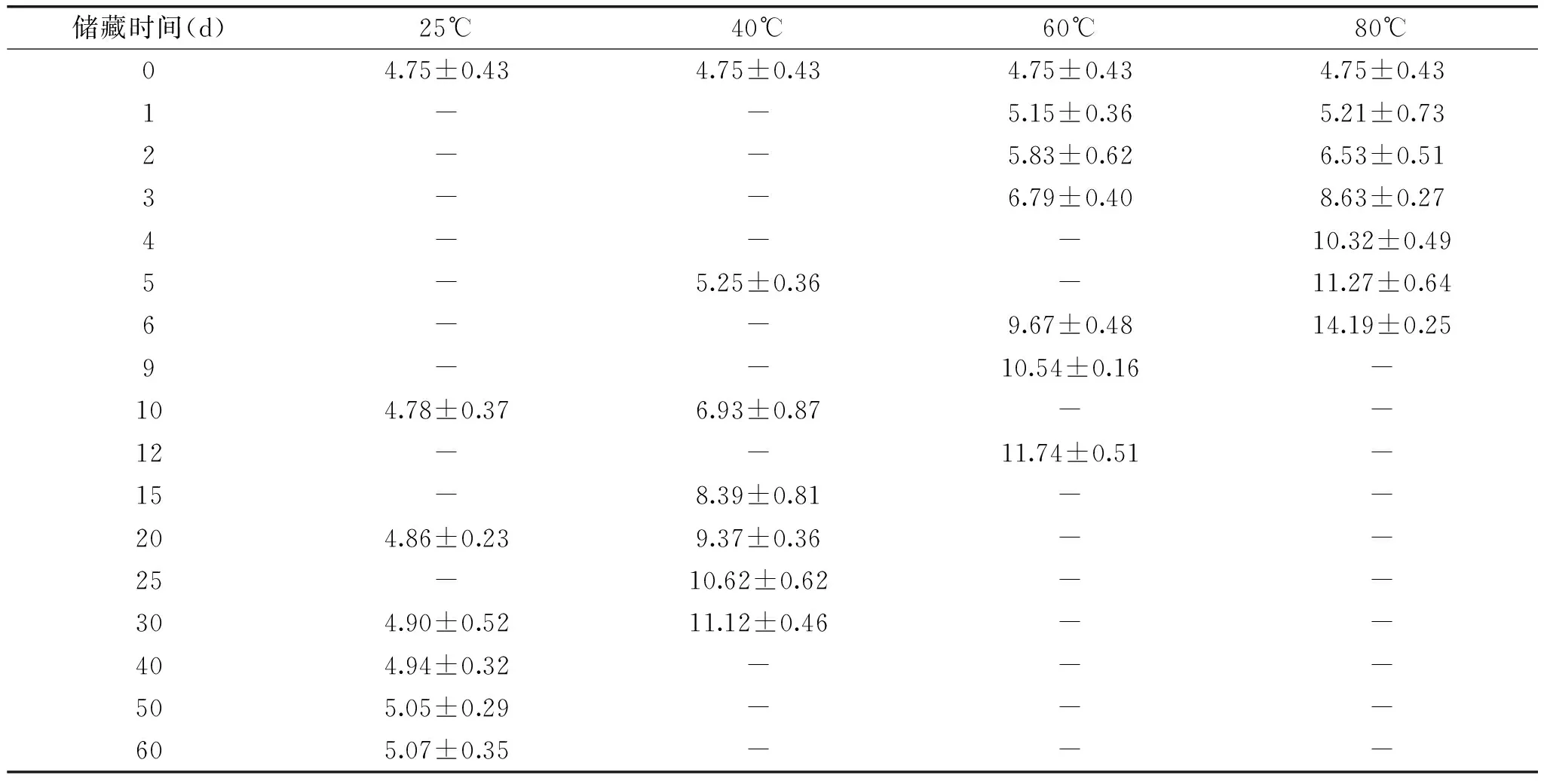
表3 不同温度和受热时间下水酶法大豆油p-茴香胺值的测定结果Table 3 Results of EAEP soybean oil PAV under different temperatures and heated times
2.4 加速氧化实验对共轭二烯、共轭三烯值的影响
图2给出的是水酶法大豆油在60℃的烘箱内加速氧化24d,每隔4d测定共轭二烯(CD)、共轭三烯值(CT)(0~24d)的结果。多不饱和脂肪酸在自动氧化过程中与氧气接触时会伴随着双键的重排,非共轭双键会异构化生成较为稳定的共轭双键,形成共轭二烯、共轭三稀。这类化合物相对较稳定,在紫外区域230nm和268nm有较强吸收峰,通过测定它们的吸光度可以确定油脂的氧化程度[17]。共轭二烯主要在氧化初始阶段形成,共轭三烯则与次级氧化产物、亚油酸和亚麻酸的降解有关[18]。从图2可知,从数值上看,共轭三烯要远远低于共轭二烯值,这主要与大豆油中亚油酸含量有关。在储藏初期共轭二烯值缓慢增长,随后增长速率加快。当共轭二烯的形成速率及其降解速率达到平衡时,增长速率最小。共轭二烯值与过氧化值变化趋势较为相似。
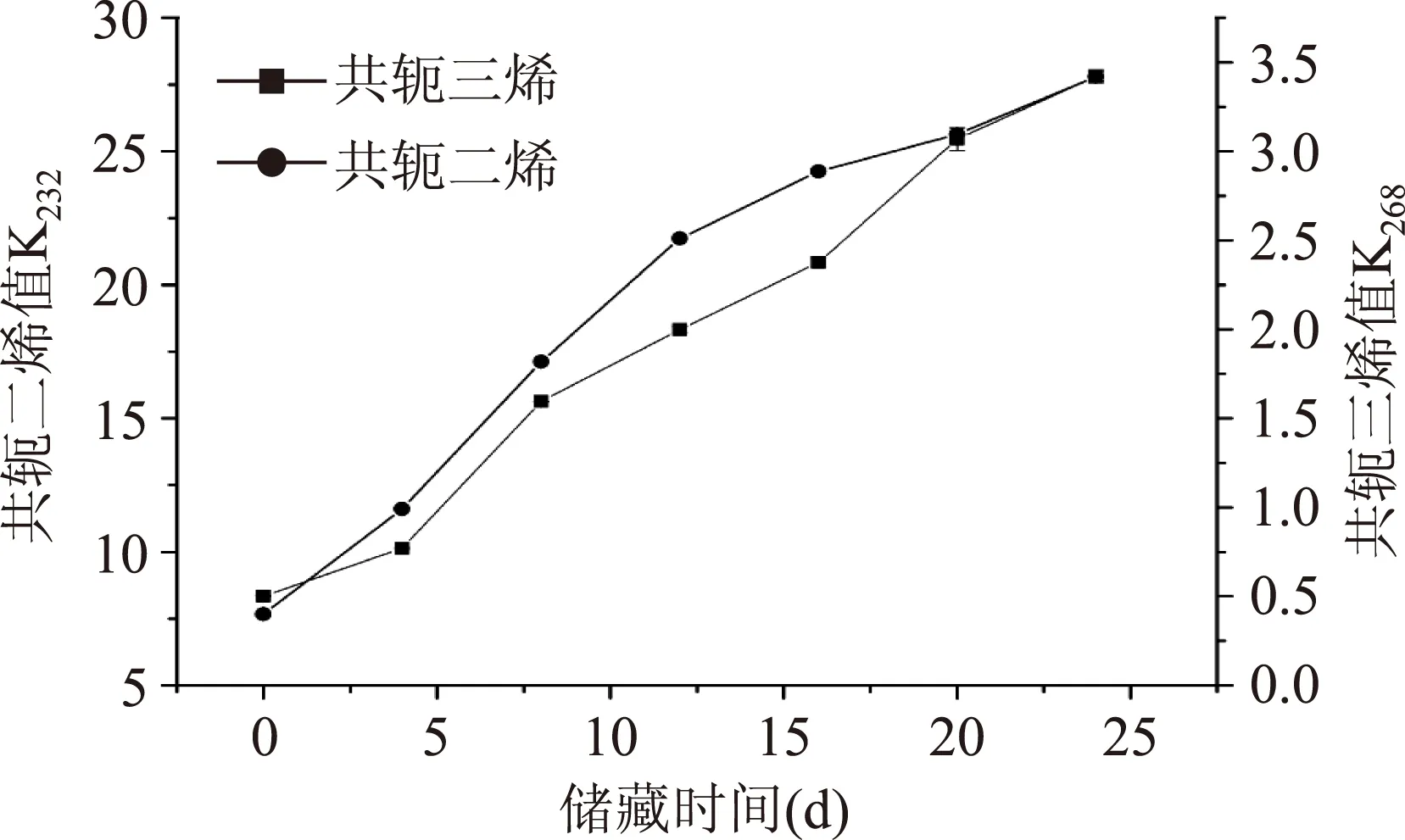
图2 加速氧化实验对共轭二烯、共轭三烯值的影响Fig.2 Determination of absorptivity at 232nm and 268nm of EAEP soybean oil during oven test
3 结论
储藏温度高低与受热时间的长短都会影响水酶法大豆油的氧化稳定性,其中尤以温度高低的影响最为显著,温度越低,大豆油发生自动氧化程度越低,越有利于油脂的保藏。在储藏水酶法大豆油时,应在较低温度下避光保存。在本实验条件下,不添加任何抗氧化剂和增效剂的水酶法大豆油的活化能为72.10kJ/mol。
[1]Naz S,Siddiqi R,Sheikh H. Deterioration of olive,corn and soybean oils due to air,light,heat and deep-frying[J]. Food Research International,2005,38(2):127-134.
[2]Bansal G,Zhou W,Barlow J. Review of rapid tests available for measuring the quality changes in frying oils and comparison with standard methods[J].Critical Reviews in Food Science and Nutrition,2010,50(6):503-514.
[3]Saguy S,Dana D. Integrated approach to deep fat frying:engineering,nutrition,health and consumer aspects[J].Journal of Food Engineering,2003,56(2):143-152.
[4]Choe E,Min DB. Mechanisms and factors for edible oil oxidation[J].Comp Rev Food Sci Food Safety,2006,5:169-186.
[5]张霜玉,王瑛瑶,陈光,等. 水酶法从油菜籽中提取油及水解蛋白的研究[J]. 中国油脂,2009,34(1):30-33.
[6]齐宝坤,江连洲,李杨,等. 挤压膨化后微体化预处理水酶法提取大豆油脂工艺研究[J].食品工业科技,2012,33(21):196-200.
[7]张雅娜,王妍,王欢,等. 加热对大豆油品质特性的影响[J]. 食品工业科技,2013,34(23):77-83.
[8]Pegg,R B. Measurement of primary lipid peroxidation products(D2.1.1-D2.1.15). In R. E. Wrolsted(Ed.),Current protocols in food analytical chemistry[M]. New York:John Wiley & Son Inc,2001.
[9]American Oil Chemists’ Society(AOCS). Official and recommended practices of the American Oil Chemists Society,5th edn. AOCS Press,Champaign,1997.
[10]IUPAC(1979). Standard methods for the analysis of oils and fats and derivatives. Toronto,Canada:Pergamon Press.
[11]Naz H,Sheikh R,Siddiqi S. Oxidative stability of olive,corn and soybean oil under different conditions[J]. Food Chemistry,2004,88:253-259.
[12]Besbes S,Blecker C,Deroanne C,et al. Heating effects on some quality characteristics of date seed oil[J]. Food Chemistry,2005,91:469-476.
[13]Lee J,Lee Y,Choe E. Temperature dependence of the autoxidation and antioxidants of soybean,sunflower,and olive oil[J]. Eur Food Res Technol.,2007,226:239-246.
[14]Malheiro R,Oliveira I,Vilas-Boas M,et al. Effect of microwave heating with different exposure times on physical and chemical parameters of olive oil[J].Food Chem Toxicol,2009,47:92-97.
[15]Naz H,Sheikh R,Siddiqi S. Oxidative stability of olive,corn and soybean oil under different conditions[J]. Food Chemistry,2004,88:253-259.
[16]李杨,张雅娜,王欢,等.水酶法提取大豆油与其他不同种大豆油品质差异研究[J]. 中国粮油学报,2014,29(6):46-52.
[17]YettellaR R,Henbest B,Proctor A. Effect of antioxidantson soybean oil conjugated linoleic acid production and its oxidative stability[J].J Agric Food Chem,2011,59:7377-7384.
[18]Berasategi I,Barriuso B,Ansorena D. Stability of avocado oil during heating:comparative study to olive oil[J]. Food Chemistry,2012,132(1):439-446.
Effect of temperature on oxidation kinetics of EAEP soybean oil
LI Yang ,MA Wen-jun,QI Bao-kun,WANG Jing,LI Dan,CAO Liang,JIANG Lian-zhou*
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
Oxidation stability of EAEP soybean oil under different temperature and storage time was studied. The quality parameters peroxide value,p-anisidine value,conjugated dienes,conjugated trienes was evaluated. The model accounting for the effect of temperature on oxidation rate was merged with the Arrhenius equation to get a model predicting shelf life on the basis of the concomitant changes in temperature. These results were time-dependent.The results showed that peroxide value,p-anisidine value,conjugated dienes,conjugated trienes follow the pattern that a higher rate of increment during early storage,then the rate decreased. The activation energy(Ea)for the IP of EAEP soybean oil autoxidation was 72.10kJ/mol,storage at 60℃ revealing significantly temperature dependence for autoxidation in oil. The EAEP soybean oil should store at low temperature.
soybean oil;temperature;induction period;oxidative stability
2014-08-19
李杨(1981-),男,博士,副教授,研究方向:粮食、油脂及植物蛋白工程。
*通讯作者:江连洲(1960-),男,博士,教授,研究方向:粮食、油脂及植物蛋白工程。
国家高技术研究发展计划(863计划)(2013AA102104)。
TS201.2
A
1002-0306(2015)13-0090-05
10.13386/j.issn1002-0306.2015.13.010
