LPS诱导小鼠急性肺损伤TLR4及TNF-α表达*
2015-05-05谷志龙姜华茂胡占升
谷志龙 姜华茂 胡占升
急性肺损伤(Acute Lung Injury,ALI)是在创伤、重症感染、休克等等非心源性疾病过程中,肺泡上皮细胞和肺毛细血管内皮细胞损伤造成的弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全或衰竭[1];脂多糖(LPS)诱导的ALI在重症感染后早期出现[2],并且死亡率较高[3]。Toll like receptors(TLRs)家族和先天性免疫系统关系比较密切[4],其中TLR4目前研究最多,是LPS受体[5]。本实验基于建造小鼠内毒诱导ALI[6-7],深入探讨ALI、LPS和TLR4及TNF-α之间的关系及损伤机制,并可能为临床ALI的预防和治疗提供实验基础和新方法。
1 材料与方法
1.1 主要材料、仪器及试剂 DNA marker(大连宝生物)和引物(大连宝生物),梯度PCR仪器(德国Biometre公司),超净工作台(苏州净化设备厂),DU800核算蛋白分析仪(德国BECKMAN COULTER公司),半干式转膜仪,辣根标记羊抗兔二抗(北京中杉金桥)兔抗小鼠TLR4抗体(SANTA),DNA及蛋白maker(大连宝生物),引物(大连宝生物)。
1.2 方法
1.2.1 实验动物及分组 SPF级别的BALB/C雄性小鼠,体重30~35 g,随机分成3组,每组10只,A组为正常对照组,不作任何处理;B组为急性肺损伤模型组:腹腔内注射给予LPS(4 mg/kg)腹腔内注射制备ALI模型;C组为抗体组:建造ALI模型前8~10 h给予TLR4/MD腹腔内注射(50 μg)。在建造模型成功后各组小鼠无菌条件下取出肺组织和取小鼠血检测内毒素及TNF-α水平,一部分肺组织置于液氮冷冻后,在-80 ℃冰箱保存,为mRNA及蛋白表达的检测,另外部分放置在4%多聚甲醛内固定24 h后,HE染色镜下观察小鼠肺组织形态改变。
1.2.2 实验指标检测及试验方法
1.2.2.1 小鼠血内毒素含量检测 选用试剂盒(动态浊度法-血浆内毒素检测试剂)的处理方法和步骤,处理血标本,并应用LPS监测分析得出检测数据。
1.2.2.2 小鼠肺组织HE染色及形态改变 4%多聚甲醛中固定,浸润、经过梯度脱水,透明化处理(二甲醛),石蜡包埋处理,各组切片6张,厚度约7 μm,HE染色后,光学显微镜下观察形态及病理变化;损害评分标准应用Gloor等[8]方法。
1.2.2.3 小鼠肺组织TLR4基因表达 按照TAKALA说明书进行提取总RNA。TLR4基因表达:通过分光光度仪测RNA280 nm/260 nmOD值,立即开始进行逆转录,合成cDNA,引物序列(TLR4),上游 5’-CCCTGAAAGGCTTGGTCT-3’;下游3’-GAGGTGTCHHTHHTCTAA-5’,扩增产物长度268 bp;引物序列(β-actin),上游 5’-AGGCATACAGGGACAGCA-3’;下游 3’-TACAGCAGGGTCAACCATTG-5’, 扩增产物长度 534 bp。反应体系:10×RT Buffer 1 μL,MgCl22 μL,AMV逆转录酶0.5 μL,RNase Inhibitor 0.25 μL,Oligo dT 0.5 μL,RNase FREE dH2O 3.75 μL,dNTP Mixture 1 μL,Total RNA 1 μL。 反 应条件:32 ℃ 9 min,49.2 ℃ 32 min,97 ℃ 4 min,4 ℃ 4 min。cDNA为模板PCR扩增,反应体系:5×PCR Buffer 10 μL,MgCl22 μL,dNTP Mixture 1 μL,cDNA 2 μL,上下游引物各 1 μL,H2O 32.75 μL,Taq酶 0.25 μL;反应条件:96 ℃6 min、(95 ℃ 30 s、49.2 ℃ 30 s、72 ℃ 30 s)33 cycle、72 ℃9 min。
1.2.2.4 小鼠肺组织TLR4蛋白表达 取小鼠肺组织进行总蛋白的提取,提取后用BCA法进行蛋白含量的检测,检测后进行PAGE凝胶电泳,电泳分离60 min后,通过maker条带选取约95 kd大小切胶,应用半干转膜方法,封闭60 min,经过一抗、二抗孵育,ECL显色,暗室内曝光,Tannon Gis软件分析测曝光底片光密度值。
1.2.2.5 小鼠血浆TNF-α双抗夹心ELISA检测 通过应用ELISA检测TNF-α试剂盒方法与流程进行标本处理及检测,并在酶标仪进行检测分析。
1.3 统计学处理 应用SPSS 17.0软件进行统计学分析,计量资料以(±s)表示,各组的均数采取单因素方差分析,组间进行两两比较LSD检验,P<0.05为差异具有统计学意义。
2 结果
2.1 建模小鼠情况 各组小鼠观察情况如下:A组无死亡小鼠,B组小鼠攻毒后最初仅异常活动增多,随后出现蜷缩、抱团现象,刺激无反应,不能进食、水,腹部呼吸频率快,死亡1只;C组小鼠变化同A组。
2.2 LPS含量检测 和A组比较,B组(模型组)LPS水平显著升高,C组LPS水平也呈现升高趋势,建模成功,见表 1、图 1。表3、图4、图5。

表1 各组小鼠血浆内毒素水平

图1 各组小鼠血浆内毒素水平
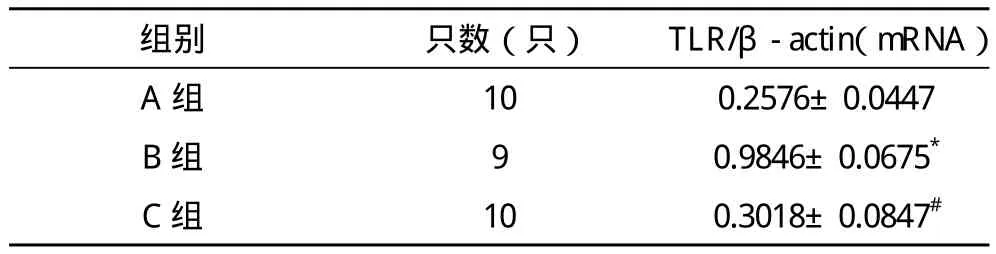
表3 各组小鼠TLR4 mRNA及Protein表达
2.3 小鼠肺组织HE染色镜下观察 小鼠攻毒造模后,镜下肺泡水肿及腔内红染,肺泡间隔增厚并充血,视野可见大量中性粒细胞浸润。抗体组干预后小鼠肺组织状况明显改善,镜下仅少量中性粒细胞浸润,肺泡及间隔水肿不明显,见表2、图2、图3。
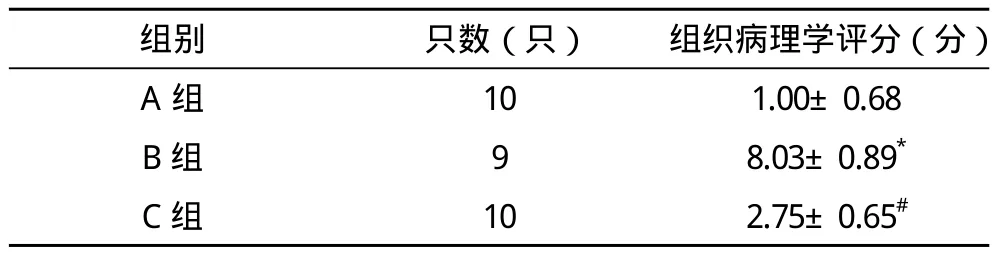
表2 各组小鼠肺组织病理学评分

图2 各组小鼠肺组织HE染色镜下改变(×200)

图3 各组小鼠肺组织病理学评分
2.4 各组小鼠TLR4基因的表达 A组小鼠(正常对照组)肺组织内仅有少量TLR4 mRNA表达。与A组比较,B组(模型组)TLR4 mRNA表达明显上调(P<0.05),C组(抗体组)和B组比较,TLR4 mRNA表达呈下调(P<0.05),见
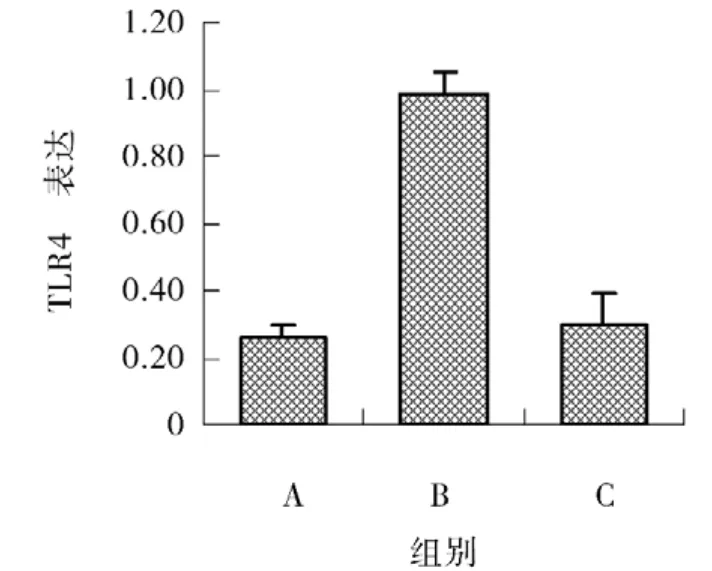
图4 TLR4 mRNA表达

图5 TLR4 mRNA及Protein表达结果
2.5 各组小鼠TLR4蛋白的表达 A组小鼠(正常对照组)肺组织内仅有少量TLR4 Protein表达。与A组比较,B组(模型组)TLR4 Protein表达明显上调(P<0.05),C组(抗体组)和B组比较,TLR4 Protein表达呈下调(P<0.05),见表4、图5、图6。

表4 各组小鼠TLR4 Protein表达

图6 TLR4 Protein表达
2.6 各组小鼠TNF-α检测 TNF-α水平变化同TLR4 mRNA和Protein趋势相同。C组(抗体组)的TNF-α水平明显低于B组(模型组),差异有统计学意义(P<0.05),见表5、图7。*与A组比较,P<0.05;#与B组比较,P<0.05

表5 各组小鼠TNF-α表达(x-±s)

图7 TNF-α表达
3 讨论
ALI/ARDS病死率极高,其致病原因主张分直接肺损伤和间接肺损伤[9]。直接肺损伤因素:误吸,重症肺炎,肺挫伤,再灌注及淹溺等;间接肺损伤因素:严重创伤伴休克,脓毒症及大量输血制品等[10]。LPS水平在导致ALI病死率高达70%~90%[11-12],以往研究认为,炎症调控的强弱是NF-kB,其受LPS、缺氧、创伤等多种因素启动[13-14],诱导多种细胞因子(如IL1、IL4、IL6、IL8、PAF)、黏附分子急性期反应蛋白等进行下游表达,从而产生一系列的SIRS生物学效应。TLR4是先天性免疫系统识别病原微生物主要受体,为LPS主要受体[15]。近年,对于TLRs家族成员与疾病的关系研究愈发收到关注、尤其是TLR4[16]。
本实验动物模型制备简单,可控性腔,重复率较高,同人类急性肺损伤相似。和正常对照组比较,模型组TLR4 mRNA、Protein及TNF-α表达明显上调,提示ALI发生机制可能和TLR4及TNF-α相关。和模型组比较,抗体组的TLR4介导LPS信号通路表达下调,从而使炎性介质、细胞因子等减少,TNF-α水平下调,丧失了对LPS的反应性,进而产生耐受,故通过阻断TLR4信号靶点的表达,降低其下游TNF-α水平,能够增加LPS耐受性的产生和LPS导致的ALI。既往研究热点主要是NF-kB、NO、IL1、黏附因子等下游分子的启动,而本实验从LPS受体蛋白TLR4作为研究靶点,实验表明TLR4是控制ALI的瀑链式SIRS的门户蛋白。
综上所述,脓毒血症导致ALI,通过腹腔内注射LPS动物模型复制性较好;其损伤机制可能是LPS和TLR4受体结合,介导TNF-α信号途径导致。通过干预TLR4受体靶点能够下调TNF-α,减轻临床症状,这位临床对于脓毒血症所致ALI提供新的治疗思路和实验基础。
[1] Bakowitz M, Bruns B, McCunn M. Acute lung injury and the acute respiratory distress syndrome in the injured patient[J]. Scand J Trauma Resusc Emerg Med, 2012, 20(1):54.
[2]王建红,李红,赵龙凤.慢性乙型肝炎患者肠源性内毒素血症中免疫调节细胞因子表达变化的研究[J].中国医学创新,2014,11(12):20-22.
[3] Kim T W, Joh E H, Kim B, et al.Ginsenoside ameliorates lung inflammation in mince by inhibiting the binding of LPS to Toll like receptor 4 on macrophages[J]. Int Immunopharmacol, 2012,12(1):110-116.
[4]陈赛娟,王一煌.Toll样受体和树突状细胞:免疫激活传感器——2011年诺贝尔生理学或医学奖简介[J].自然杂志,2011,22(6):315-321.
[5] Seki H, Tasaka S, Fukunaga K, et al.Effect of Toll-like receptor 4 inhibitor on lps -induced lung injury [J]. Inflamm Res, 2010,59(10): 837-845.
[6] Tomita M, Okuyama T, Katsuyama H, et al. Mouse model of paraquatpoisoned lungs and its gene expression profile [J]. Toxicology, 2007,231(2): 200-209.
[7] Liu Z, Yang Z, Fu Y, et al.Protective effect of gossypol on lipopolysaccharide-indeced acute lung injury in mice[J]. Inflamm Res,2013,62(5):499-506.
[8] Gloor B, Blinman T A, Righerg D A, et al.Kuppffer cell blockade reduces hepatic and systemic cytokine levels and lung injury in hemorrgagic pancreatitis in rats[J]. Pancreas, 2000,21(4):414-420.
[9] Wang F N, Ma Z Q, Liu Y Z, et al. New phenylethanoid glycosides from the fruits of forsythia suspense(thunb)vahl[J]. Molecules,2009,14(3):1324-1331.
[10]曹荣荣,崔磊.谷氨酰胺对急性肺损伤患者肺部转归的影响研究[J].中国医学创新,2013,10(14):15-16.
[11] Agorreta J, Garayoa M, Montuenga L M, et al.Effects of acute hypoxia and lipopolysaccharide on nitric oxide synthase-2 expression in acute lung injury[J]. Am J Respir Crit Care Med,2003,168(2):287-296.
[12]矫青,黄宇戈.内皮抑素在高氧肺损伤中的研究[J].中国医学创新,2011,8(10):192-194.
[13]黄敏坚,张远新,李平.血必净对油酸型急性肺损伤家兔血清炎症因子与肺水转运的影响[J].中国医学创新,2012,9(18):20-21。
[14]曹荣荣,崔磊.谷氨酰胺对急性肺损伤患者肺部转归的影响研究[J].中国医学创新,2013,10(14):15-16.
[15] Tsujimoto H, Ono S, Efron P A, et al. Role of Toll like receptors in the sevelopment of sepsis[J].Shock,2008,29(3):315-321.
[16] Tidswell M, Tillis W, Larosa S P, et al.Phase 2 trial of eritoran tetrasodium(E5564),a Toll like receptor 4 antagonist in patients with severe sepsis[J]. Critical Care Medicine,2010,38(1):72-83.
