紫杉醇脂质纳米粒子对KB、SKOV3细胞作用的对比分析
2015-05-05王宗站杨金霞周宓邢晓波
王宗站 杨金霞 周宓 邢晓波
紫杉醇(TAX)被广泛用于乳腺癌、非小细胞肺癌、卵巢癌、头颈部肿瘤。紫杉醇水溶性差,将其溶于无水乙醇和聚氧乙基代蓖麻油的混合溶媒中,此溶媒容易导致严重的过敏反应[1]。脂质体作为转运载体,其制作简单、能降低药物不良反应的发生并容易实现肿瘤靶向等治疗的优点[2]。紫杉醇脂质纳米粒子作用KB、SKOV3,探讨其作用机制,为临床应用提供基础证实。
1 材料与方法
1.1 材料 紫杉醇纳米粒子(TAX-NLC,苏州大学,批号:20080525),1640培养基(GIBCO公司),Fluo-3(美国Molecular Probes公司),小牛血清(GIBCO公司),胎牛血清(GIBCO公司),Dapi(上海宝曼科技生物有限公司),MTT(上海励瑞生物科技有限公司),Phellotin Tax-Red(美国Molecular Probes公司),TCP-SP型激光共聚焦显微镜(德国Leica公司),人口腔上皮癌KB细胞(中科院上海细胞库),人卵巢癌SKOV3细胞(中科院上海细胞库),HERA CO2培养箱(德国Kedro公司)。
1.2 细胞培养 KB细胞以含15%小牛血清的RPMI-1640培养,SKOV3以含15%胎牛血清的RPMI-1640培养,培养箱CO2浓度设定为5%,温度设定为37 ℃。
1.3 方法
1.3.1 TAX-NLC作用KB、SKOV3细胞后钙浓度的变化 制备KB、SKOV3细胞悬液,接种在盖玻片上;培养24 h后,PBS洗涤3次;放入4 μmol/L的Fluo-3负载液中,在常温条件下避光培养40 min,PBS洗涤;放入激光共聚焦显微镜专用凹槽内,加入200 μL无血清1640培养基;对照组为200 μL无血清1640,实验组为终浓度是100 nmol/L的TAX-NLC 200μL,同时在电脑上标记细胞,动态观测细胞内荧光强度变化。
1.3.2 TAX-NLC作用KB、SKOV3细胞对F-肌动蛋白的影响 KB、SKOV3细胞接种在盖玻片上,培养24 h,加入最终浓度为100 nmol/L的TAX-NLC,作用3 h,PBS洗涤细胞,继续培养24 h。PBS洗涤,以戊二醛固定30 min,PBS洗涤,加入1%的tritonX-100和1%的BSA放置30 min,PBS洗涤。再加入5 μg/mL的Taxax Red-x phallodin 100 μL避光培养30 min,PBS洗涤,加入2 μg/mL的Dapi 100 μL避光培养30 min。激光共聚焦显微镜下观察KB、SKOV3细胞F-肌动蛋白形态学变化。
1.3.3 MTT法检测TAX-NLC对KB、SKOV3细胞的抑制率 将KB、SKOV3细胞接种于96孔培养板中,每孔终体积为100 μL,设置6个复孔。培养24 h,每孔加入TAXNLC 10 μL,终浓度为100 nmol/L,对照组加入10 μL 1640培养基,培养3 h,PBS洗涤细胞。加入培养基继续培养12、24、48、72 h,上机测试前4 h加入10 μL 5 mg/mL的MTT,弃上清液,加入100 μL DMSO,震荡10 min,在波长为570 nm处测各孔OD值。每组重复3次。100 nmol/L TAX-NLC对KB、SKOV3细胞的抑制率为(1-实验组OD值/对照组OD值)×100%。
1.3.4 荧光显微镜下观察TAX-NLC作用KB、SKOV3细胞诱导多核细胞 制备细胞悬液,接种到盖玻片上,培养24 h后,加入终浓度为100 nmol/L的TAX-NLC,作用3 h后,继续培养24 h,每组设3个平行样本。PBS洗涤细胞,以2%的戊二醛在常温下固定30 min,PBS洗涤,加入2 μg/mL的Dapi 100 μL在常温下避光培养30 min,在荧光显微镜下观察细胞核的形态变化。每个样品至少计数10个高倍镜视野,计数1000个细胞。
1.4 统计学处理 采用SPSS 16.0进行统计学分析,计量资料以(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 激光共聚焦显微镜下观察细胞荧光强度变化 对照组KB细胞、SKOV3细胞,随着时间的延长,荧光强度逐渐增强,细胞亮度也随之逐渐增加,形态越来越清晰。100 nmol/L的TAX-NLC作用KB、SKOV3细胞后,细胞亮度也逐渐增加,细胞形态逐渐清晰,但其亮度远远超过对照组。Fluo-3可以与细胞内游离钙结合,细胞内荧光强度的增强说明细胞内钙离子浓度的增加。100 nmol/LTAX-NLC作用后,KB 细胞荧光强度在60 min时,达到最高值;SKOV3细胞在50 min时,达到最高值。SKOV3细胞在开始时荧光强度就很高。对照组KB细胞内荧光强度去本底后最大值为12(图1),实验组KB细胞内荧光强度去本底后最大值为68(图2);对照组SKOV3细胞内荧光强度去本底后最大值为16(图3),实验组SKOV3细胞内荧光强度去本底后最大值为38(图4)。
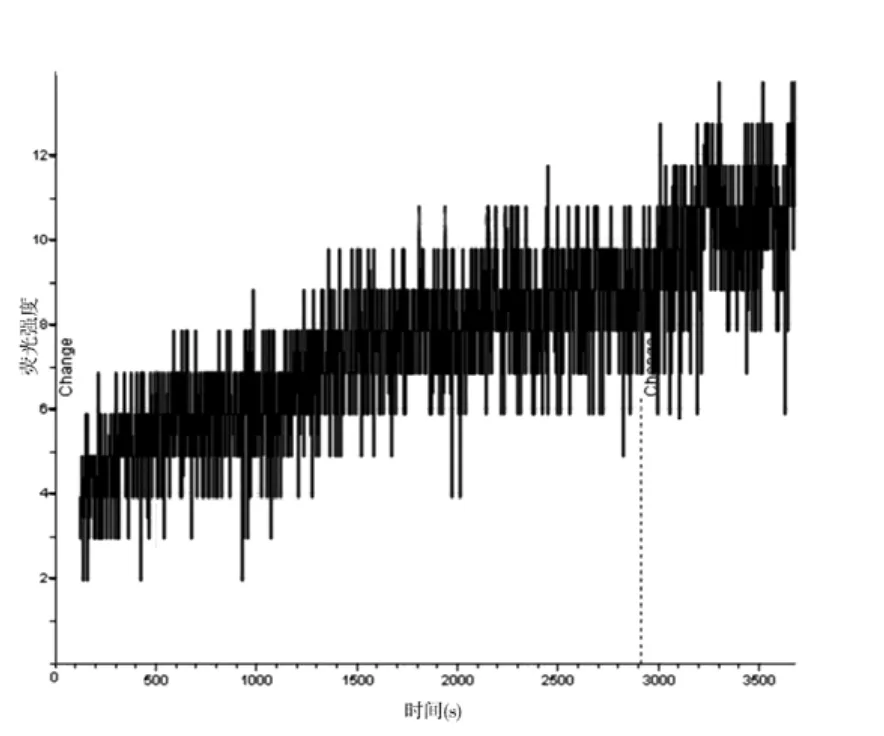
图1 对照组去本底KB细胞荧光强度
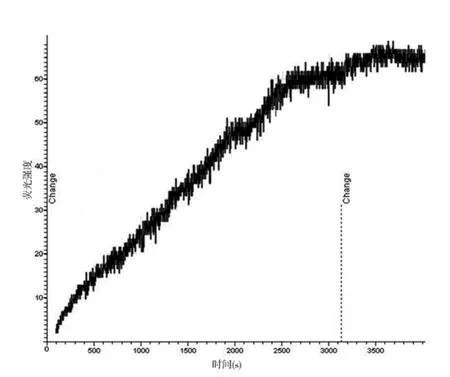
图2 实验组KB细胞去本底荧光强度

图3 对照组SKOV3细胞去本底荧光强度

图4 实验组SKOV3细胞荧光强度
2.2 激光共聚焦纤维镜下观察KB、SKOV3细胞F-肌动蛋白的变化 蓝色的为细胞核,红色的F-肌动蛋白,图5、7为未加药组KB、SKOV3细胞F-肌动蛋白形态图像,F-肌动蛋白以细胞核为中心往四周呈放射状分布,条理清楚,结构完整,呈丝状排列。图6、8是经100 nmol/L的TAX-NLC作用后F-肌动蛋白形态图像,F-肌动蛋白集聚呈团块状或点状,条理不清楚,结构不完整,排列紊乱。
2.3 MTT实验测定细胞抑制率 100 nmol/LTAX-NLC 24、48、72 h对KB细胞的抑制率高于对SKOV3细胞的抑制率(P<0.05)。见表1。
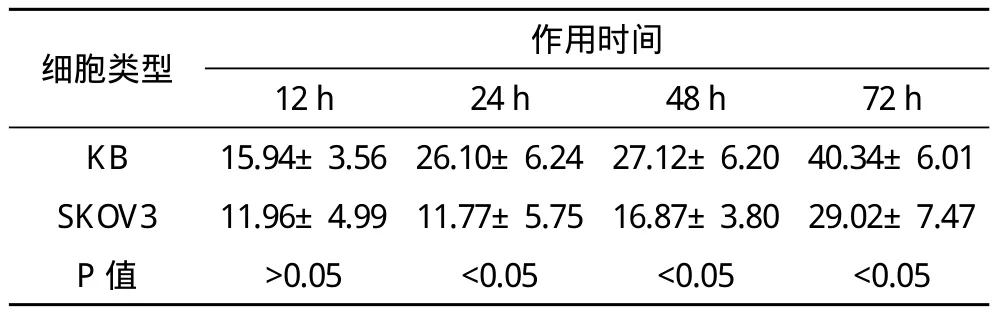
表1 100 nmol/L TAX-NLC对KB、SKOV3细胞的抑制率(x-±s,n=3) %
2.4 荧光显微镜下观察TAX-NLC诱导KB、SKOV3细胞产生多核细胞 正常KB、SKOV3细胞基本很少能见到多核细胞,加药后多核细胞数目明显增多。100 nmol/L的TAX-NLC作用KB、SKOV3细胞后,多核细胞比例分别为(85.62±2.51)%,(56.22±3.14)。100 nmol/L TAX-NLC 诱导KB、SKOV3细胞产生的多核细胞数目相比较,KB细胞的数目明显多于SKOV3细胞,差异有统计学意义(P<0.05)。见图9~12。
3 讨论
TAX是临床上广泛使用的一类抗肿瘤药物,对卵巢癌、乳腺癌、非小细胞肺癌、头颈部肿瘤、前列腺癌等均有较好疗效[3]。TAX-NLC是由TAX、硬脂酸、卵磷脂、胆固醇、玉米油、无水乙醇经高压乳匀合成的纳米化脂质药物。刘圣活等[4]报道纳米颗粒具有优良的传输性能。TAX以脂质纳米粒为载体,可以将TAX载入肿瘤细胞内,更好地杀伤细胞。刘敏等[5]报道,TAX-NLC对KB细胞的杀伤作用优于TAX,其作用机制可能是TAX-NLC更容易通过细胞膜,并在细胞中浓聚。

图5 正常KB细胞F-actin
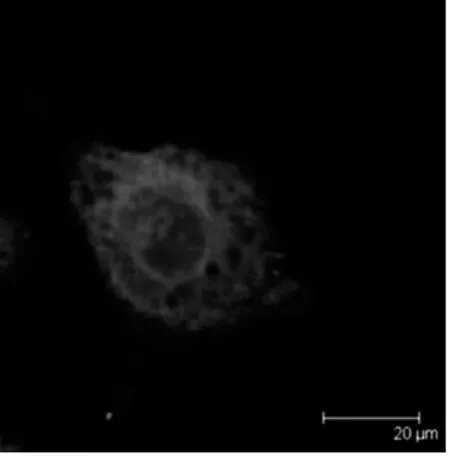
图6 实验组KB细胞F-actin
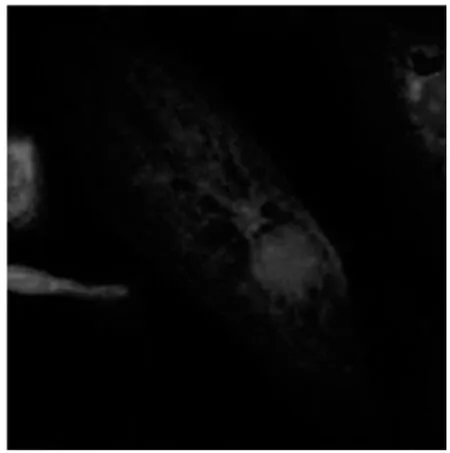
图7 正常SKOV3细胞F-actin

图8 实验组SKOV3细胞F-actin

图9 正常KB细胞 ×1000(荧光显微镜)

图10 实验组KB细胞 ×1000(荧光显微镜)
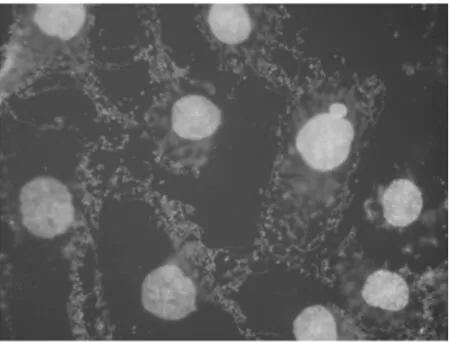
图11 正常SKOV3细胞×1000(荧光显微镜)
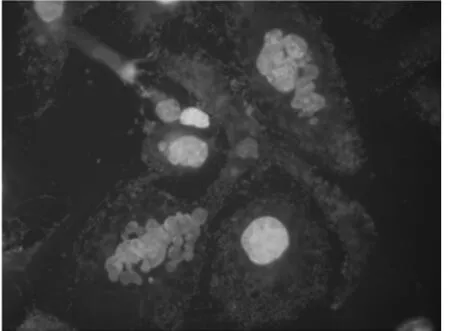
图12 实验组SKOV3细胞×1000(荧光显微镜)
紫杉醇的抗肿瘤作用靶点在微管上[6],通过抑制微管解聚,干扰有丝分裂纺锤体的组装,染色体不能分离,使肿瘤细胞阻滞在G2、M期,最终达到抗肿瘤的目的[7-8]。高鹏[9]报道紫杉醇可以阻断微管网的重建路径,将癌细胞的分裂控制在G2/M阶段,抑制癌细胞扩散。胞浆内Ca2+可以调控微丝的构架分布,低浓度时可阻断微丝末端的延伸,高浓度时可将其切成片段。微管的组装与解聚受到钙离子浓度的影响,低浓度时促进组装,高浓度时促使其解聚,而微管的解聚也会促使胞外钙离子向细胞内流动,进而造成细胞内钙离子浓聚[10]。本实验中,TAX-NLC作用KB、SKOV3细胞后,细胞内Ca2+浓度迅速升高,随后出现F-actin变性,聚集成点状、团块状,从而使细胞丧失功能,最后死亡。说明胞内Ca2+浓度增加在TAX-NLC的抗肿瘤机制方面发挥了重要作用。
本实验中,对照组荧光强度随时间的延长也轻微的逐渐升高,可能是由于激光的照射激发细胞外的钙离子向细胞内流动,游离钙与Fluo-3结合,从而显示荧光强度增加。KB细胞对照组去本底后荧光强度最高值为12,SKOV3细胞对照组在相同时相点为11,相差不是太大。实验组KB细胞钙离子浓度去本底后最大值为68,是细胞外钙离子浓度的5.6倍;实验组SKOV3细胞内钙离子浓度去本底后最大值为38,是细胞外钙离子浓度的3.4倍;而KB细胞的胞内钙离子浓度大约是SKOV3细胞内钙离子浓度的1.7倍。TAXNLC可能是启动了某种机制,使细胞内的钙离子浓度升高,致使F-actin形态异常,功能障碍,进而导致微丝功能丧失,最终细胞死亡。细胞内钙离子浓度升高的原因,目前还不十分清楚。一方面可能是激光的照射导致细胞内结合钙的解离或者是细胞外钙离子的内流;另一方面可能是微管十分稳定,不能解聚,反馈机制要求钙离子浓度升高,促使微管解聚,进而导致钙离子浓度的升高。TAX-NLC作用后KB细胞钙离子浓度比SKOV3的浓度高,可能KB细胞对TAX-NLC更敏感,也可能KB细胞恶性程度更高。SKOV3细胞开始时就有较高钙离子浓度,而后又缓慢升高,而KB细胞的钙浓度开始时就从较低水平逐渐的升高,说明SKOV3细胞在加入TAX-NLC的即刻就有产生了大量的游离钙,而KB细胞的游离钙是通过TAX-NLC作用后逐渐释放的。
100 nmol/L的TAX-NLC对KB细胞的抑制率约为SKOV3细胞的1.5倍,与细胞内钙离子浓度变化的结果基本是一致的,即抑制率与细胞内钙离子浓度是密切相关联的。TAX-NLC对KB细胞有较强的抗肿瘤作用,可能是因为它将更多的TAX载入到细胞内。TAX-NLC可能仅改变其剂型和跨膜的性能,而TAX本身的抗肿瘤特性并没有发生改变。张丽等实验结果证实[11],TAX与紫杉醇脂质体对细胞抑制机制相似。
正常培养细胞中ASG细胞很少会形成多核巨细胞,但TAX作用于ASG细胞后会形成大量多核巨细胞。多核瘤细胞的形成是细胞死亡前的特征性表现之一[12-13]。TAX作用于微管,阻止了纺锤丝的形成,细胞核可以正常的分裂,而细胞浆不能正常的分裂,进而一个胞浆内可见多个细胞核,形成多核细胞。曾春等[14]研究发现TAX作用骨肉瘤U-2OS细胞后,出现大量多核细胞,其数量随药物浓度及作用时间的增加而增加。本实验中,100 nmol/L的TAX-NLC对KB、SKOV3细胞作用后,产生大量的多核细胞,有的可见多核巨细胞,两者比较差异有统计学意义,TAX-NLC诱导KB细胞产生的多核细胞比例约为SKOV3细胞的1.5倍,此结果与细胞抑制率、细胞内钙离子浓度基本相一致。TAX-NLC作用KB、SKOV3细胞,使细胞内钙离子浓度增高,导致F-actin功能障碍,进而使细胞的微管系统的平衡遭到破坏,导致细胞生长抑制,产生大量的多核细胞,最后细胞死亡。
Shi-Mun等[15]研究认为多核细胞的出现和细胞凋亡有一定的关系,表达突变型p53的细胞可以打乱细胞周期的阻滞,出现多核细胞,表达野生型p53的细胞出现有丝分裂的阻滞,在某些因素的影响下,出现细胞凋亡。不依赖p53基因的细胞也可以产生多核细胞。成纤维细胞,在松胞素的作用下,细胞核正常分裂,而细胞质失去正常分裂能力,形成的双核细胞,而且还可以进入下一个周期,并没有出现细胞凋亡。TAX-NLC作用KB、SKOV3细胞后,产生大量的多核细胞,其产生的原因可能与p53基因有一定的关系。
TAX-NLC 与TAX具有相似的抗肿瘤机制,作用于微管系统,使细胞内钙离子浓度增加,使F-actin聚集成团块状、点状,微丝的功能受到影响,有的形成多核细胞,最终导致细胞死亡。TAX-NLC改变了剂型,更利于用药,疗效更好,有着广泛的应用前景。
[1] Kutuk O, Letai A. Displacement of Bin by Bmf and Puma rather than increase in Bim level mediates paclitaxl-induced apoptosis in breast cancer celld[J]. Cell Death Differ, 2010,17(10):1624-1635.
[2] Dhanikula R S, Dhanikula A B, Panchanula R, et al.Thermoreversible liposomal poloxamerel for the delivery of paclitaxel:dose proportionality and hematological toxicity studies[J]. Pharmazie,2008,63(6):439-445.
[3]张春芳. 紫杉醇注射液60例药物不良反应分析[J]. 中国医学创新,2012, 9 (23) :146-147.
[4]刘圣活,帅心涛,周建华,等. MG7抗体靶向紫杉醇纳米药物对胃癌治疗的研究[J]. 中国医学创新,2011, 8(17):3-5.
[5]刘敏,李智慧,许玉杰. 纳米化紫杉醇与电离辐射对KB细胞联合作用的研究 [J]. 苏州大学学报(医学版),2011, 31(1):16-20.
[6]许成贵. 紫杉醇联合化疗对中晚期胃癌的临床疗效观察及抗癌作用机制的探讨[J]. 中国医学创新,2013, 10(16):34-36.
[7] Srivastava V, Negi A S, Kumar J K, et al. Plant-based anticancer molecules: A chemical and biological profile of some important leads[J].Bioorganic ﹠ Medicinal Chemistry, 2005,13(21):5892-5908.
[8] Anil K S, Alka G, Deepika A. Paclitaxel and its formulations[J]. Int J Pharm, 2002,235(122): 179-192.
[9]高鹏. 周剂量紫杉醇联合表阿霉素治疗晚期乳腺癌的临床观察[J].中国医学创新,2014, 11(36):43-44.
[10] Hill P B, Dora K A, Hughes A D. The involvement of intracellular Ca2+in 5-HT (1B/1D) receptor-mediated contraction of the rabbit isolated renal artery[J]. Br J Pharmacol, 2000, 130(4): 835-842.
[11]张丽,佟仲生,李淑芬,等. 紫杉醇脂质体对乳腺癌MCF-7细胞生长抑制作用的机制[J]. 肿瘤防治研究,2013,40(2):138-143.
[12] Reinecke P, Knopf C, Schmitz M, et al. Growth inhibitory effects of Paclitaxel on human epitheliod sarcoma in vitro[J].Cancer,2000,88(7):1614-1622.
[13] Swanson P E, Carroll S B, Zhang X F, et al. Spontaneous premature chromosome condensation, micronucleus formation,and non-apoptotic cell death in heart Hela S3 cell Ultrastructural observations[J].Am J Pathol,1995,146(4):963-971.
[14]曾春,郭卫,冯传汉. 紫杉醇诱导骨肉瘤细胞系凋亡的体外研究 [J].中华骨科杂志,2002, 22(11):675-679.
[15] Shi-Mun Kim, Rockki Kim, Jae-Hyun Ryu, et al. Multinuclear giant cell formation is enhanced by down-regulation of Wnt signaling in gastric cancer cell line, AGS [J]. Experimental Cell Research, 2005,308(1): 18-28.
