固相萃取/超高效液相色谱-串联质谱法同时测定禽蛋中4种苏丹红染料残留量
2015-04-27刘正才尹太坤
刘正才,杨 方,尹太坤,钱 疆
(1.福建出入境检验检疫局 福建省检验检疫技术研究重点实验室,福建 福州 350001;2.福州大学 石油化工学院,福建 福州 350108)
研究简报
固相萃取/超高效液相色谱-串联质谱法同时测定禽蛋中4种苏丹红染料残留量
刘正才1*,杨 方1,尹太坤2,钱 疆1
(1.福建出入境检验检疫局 福建省检验检疫技术研究重点实验室,福建 福州 350001;2.福州大学 石油化工学院,福建 福州 350108)
建立了禽蛋及其制品中4种苏丹红染料(苏丹红Ⅰ,Ⅱ,Ⅲ和Ⅳ)残留量的固相萃取/超高效液相色谱-串联质谱(UPLC-MS/MS)测定方法。样品经正己烷超声提取,上清液经苏丹红专用SPE柱净化,采用Waters CORTECSTMUPLC® C18(2.1 mm×100 mm,1.7 μm) 柱以5 mmol/L乙酸铵溶液-0.2%甲酸和乙腈为流动相梯度洗脱分离,电喷雾电离(ESI)正离子多反应监测模式(MRM)进行测定,内标法定量。结果表明,苏丹红Ⅰ~Ⅳ在0.5~20 μg/L范围内线性关系良好,相关系数均大于0.999;在低、中、高3个加标水平的平均回收率为80.0%~104.2%,相对标准偏差为4.2%~10.9%。方法的检出限(LOD)为0.26~0.35 μg/kg,定量下限(LOQ)为0.9~1.2 μg/kg。该方法操作简便、准确、快速、灵敏,可用于禽蛋和蛋制品中苏丹红染料的检测分析。
超高效液相色谱-串联质谱法;固相萃取;苏丹红染料;禽蛋
苏丹红染料是非生物合成的亲脂性偶氮化合物,常用于石油、机油、汽车蜡等工业产品的着色,由于其颜色鲜艳、不易褪色、价格低廉等特点,一些不法商贩将其用于食品加工行业以谋利,但由于其致突变性和致癌性等危害性[1],我国和欧盟等国家已禁止将苏丹红作为食用色素进行添加。目前,针对苏丹红的检测方法国内外进行了大量的研究,检测方法有薄层色谱-紫外分光光度法[2]、酶联免疫分析法(ELISA)[3]、气相色谱法(GC)[4]、气相色谱-质谱联用法(GC-MS)[5-6]、高效液相色谱法(HPLC)[7-8]、液相色谱-质谱联用法(HPLC-MS)[9-12]等,这些方法已经被广泛应用于辣椒制品、蛋禽类制品、调味品等食品中苏丹红残留量的检测。我国和欧盟均以高效液相色谱法测定食品中苏丹红残留量为标准,但由于食品种类繁多、基体复杂等因素的影响,该法表现出很多缺点,无法规避假阳性结果的出现,且前处理过程耗时耗力。本研究采用固相萃取/超高效液相色谱-串联质谱法技术,建立了同时测定禽蛋及其制品中4种苏丹红染料(苏丹红Ⅰ,Ⅱ,Ⅲ和Ⅳ)残留量的分析方法。该方法灵敏度高,定性定量准确。
1 实验部分
1.1 仪器与试剂
UPLC超高效液相色谱仪、WAT 200609真空提取装置(美国Waters公司);TripleQuad5500三重四极杆质谱仪(美国AB Sciex公司);CR22G高速冷冻离心机(Himac日立公司);SBEQ-CA4954苏丹红专用SPE柱(上海安谱科学仪器有限公司),使用前依次用3 mL二氯甲烷和3 mL 正己烷进行活化。
苏丹红Ⅰ~Ⅳ标准品、同位素内标苏丹红Ⅰ-D5和苏丹红Ⅳ-D6(含量均>90.0%,德国Dr.Ehrenstorfer公司);乙腈、甲醇、乙酸乙酯、丙酮、甲酸(色谱纯,德国Merck公司);正己烷、二氯甲烷(分析纯,国药集团化学试剂有限公司);实验用水为超纯水。
1.2 标准储备液的配制
准确称取苏丹红Ⅰ~Ⅳ标准品,用丙酮配制成0.1 mg/mL的储备液,临时用乙腈稀释成不同浓度的混合标准溶液,4 ℃下避光保存。
1.3 动物实验与样品制备
选取20只约1.0 kg的母鸡,分为空白对照组和试验组,在散养的条件下适应性饲养1周,自由饮水与采食。之后以口灌的方式喂含有苏丹红染料的饭团,连续给药5 d,从第6 d后开始取样(鸡蛋);皮蛋、咸蛋购于当地市场。鸡蛋、皮蛋、咸蛋样品,去壳,均质后置于清洁样品容器中,密封,将制备好的试样于-18 ℃以下保存。
1.4 仪器条件
1.4.1 质谱条件 电离模式:正离子模式(ESI+);检测方式:多反应监测(MRM);电喷雾电压(IS):5 000 V;离子源温度(TEM):500 ℃;气帘气压力(CUR):0.241 MPa;辅助气压力0.379 MPa,定性、定量离子对和碰撞能量(CE)及去簇电压(DP)见表1。

表1 4种苏丹红染料的主要MS/MS参数
* quantitative ion
1.4.2 液相色谱条件 Waters CORTECSTMUPLC®C18柱(2.1 mm×100 mm,1.7 μm);流动相:A为5 mmol/L乙酸铵溶液-0.2%甲酸,B为乙腈,梯度洗脱程序为0~3 min,75% B;3~4 min,75%~100% B;4~6 min,100% B;6~7 min,100%~75%B;7~12 min,75% B;流速:0.4 mL/min;柱温:30 ℃;进样量:2 μL。
1.5 样品前处理方法
准确称取5.0 g(±0.01 g)试样于离心管中,加入100 μL 100 μg/L苏丹红内标标准工作液、2 g酸性氧化铝和2 g无水硫酸钠,再加入15 mL 正己烷,涡旋混匀1 min,100 W功率下超声提取15 min,在15 000 r/min的速率下高速离心10 min,移出上清液,下层固体再用10 mL 正己烷提取1次,合并提取液并定容至25 mL容量瓶中。移取5 mL 上清液上样至活化过的苏丹红专用柱中,以6 mL正己烷进行淋洗,弃去淋洗液,最后用5 mL二氯甲烷洗脱,收集流出液于玻璃管中,于45 ℃下氮吹至近干。用1 mL 1%氨水乙腈将残渣重新溶解,涡旋10 s后过0.22 μm有机滤膜,供UPLC-MS/MS测定。
2 结果与讨论
2.1 质谱条件的优化
苏丹红分子中含有氮原子,容易带正电荷,因此使用ESI(+)电离模式。配制质量浓度为200 ng/mL的苏丹红Ⅰ~Ⅳ号混合标准溶液,通过蠕动泵直接进样,在全扫描方式下找出准分子离子质谱峰[M+H],然后改为子离子扫描模式作为检测模式,以准分子为母离子进行子离子扫描。选择子离子作为MRM检测离子,进一步优化锥孔电压、碰撞电压等参数,得到最佳质谱条件(见表1)。
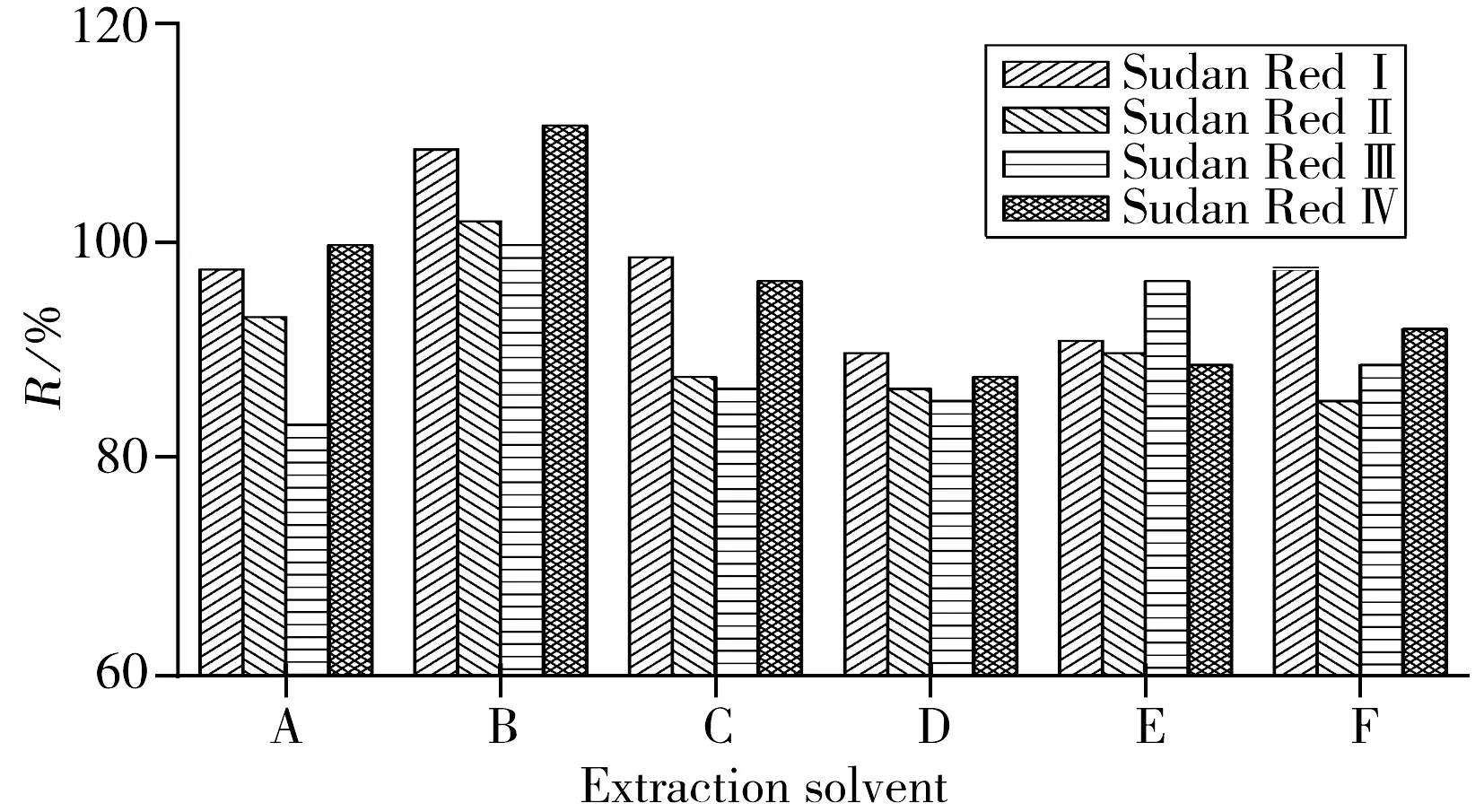
图1 不同提取溶剂对苏丹红提取效率的影响(n=6)
2.2 提取溶剂的选择
苏丹红类染料属于脂溶性染料,有较强的疏水性,目前对苏丹红提取的溶剂主要有正己烷、乙腈、二氯甲烷等[13]。为取得较佳的萃取效果,对比了乙腈、正己烷、乙酸乙酯、乙腈-丙酮、乙腈-乙酸乙酯、正己烷-丙酮对鸡蛋中苏丹红的提取效果,结果如图1所示。由图1可以看出,用正己烷提取苏丹红的回收率明显高于其它试剂的回收率。基于正己烷自身的折射率较低,与溶质的作用也较弱,以及后续过程中宜于直接过柱净化等诸多因素,最后确定以正己烷作为提取溶剂。进一步比较了振荡萃取和超声萃取两种不同的萃取方式,结果表明,超声萃取的效果较好,超声萃取15 min时对苏丹红Ⅰ~Ⅳ的加标回收率均能达到90%~105%。
2.3 净化方式的选择
鉴于鸡蛋基质中具有较多的脂肪和蛋白成分,而正己烷不仅能提取苏丹红染料,也能提取出大量的脂肪,而且不能较好地沉淀蛋白,因此,必须对提取液进行净化。实验在提取时加入适当的酸性氧化铝和无水硫酸钠,以去除沉淀蛋白和部分油脂。另外比较了3种固相萃取柱(C18柱、中性氧化铝柱和SDR苏丹红专用柱)的净化效果,发现苏丹红染料在中性氧化铝柱上保留差异较大,苏丹红Ⅰ、Ⅱ保留较弱,苏丹红Ⅲ、Ⅳ保留较强,洗脱溶剂较多,净化效果较差;C18柱由于采用正己烷洗脱容易堵塞,苏丹红Ⅰ、Ⅱ的回收率较差;SDR苏丹红专用柱以正己烷上样,二氯甲烷洗脱,无需进行繁琐的活度调节和活性测试,操作过程简单,溶剂耗费少,4种苏丹红染料均具有较好的过柱回收率(84.5%~99.2%)。采用SDR苏丹红专用柱,考察了不同洗脱溶剂(丙酮、丙酮-正己烷、二氯甲烷)对苏丹红染料的洗脱效果,结果发现,二氯甲烷对4种苏丹红染料的洗脱效果最好,因此本实验确定以二氯甲烷为洗脱溶剂,其洗脱曲线见图2,最佳的洗脱体积为5 mL。
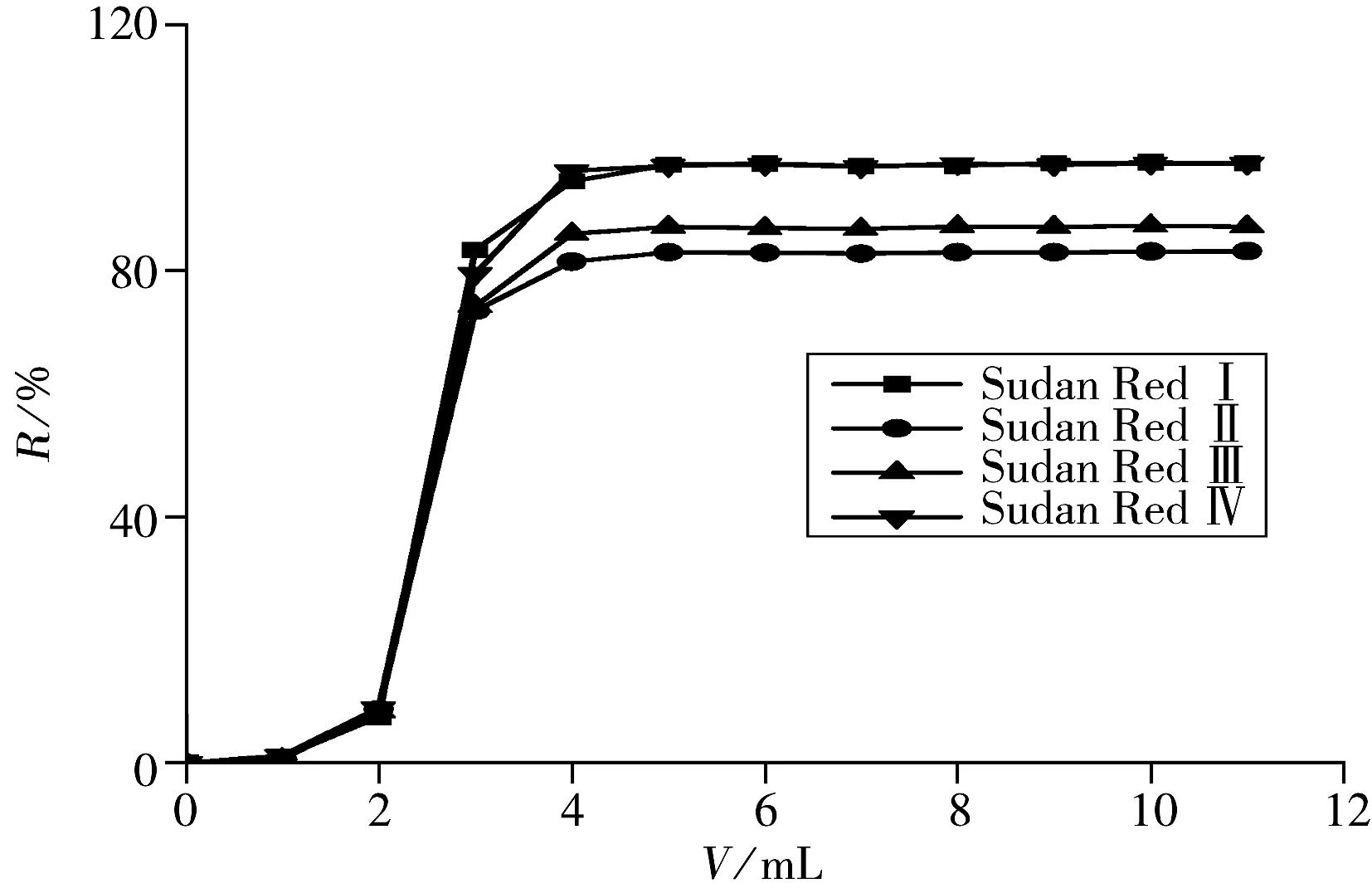
图2 洗脱体积对苏丹红提取效率的影响
2.4 基质效应的评价与消除
本文通过配制标准工作曲线和基质曲线,以峰面积为纵坐标,质量浓度为横坐标作图,以基质曲线和标准曲线的斜率求商来考察化合物的基质效应[14]。以空白溶剂、鸡蛋提取液、SPE净化液分别比较了低、中、高3个不同加标水平(1.0,2.0,10.0 μg/L)下的基质效应。测定结果表明,4种苏丹红染料在鸡蛋提取液中均存在严重的基质抑制效应(Sudan Red Ⅰ:-38.2%;Sudan Red Ⅱ:-36.7%;Sudan Red Ⅲ:-68.4%;Sudan Red Ⅳ:-42.0%),而在SPE提取液中则明显降低(Sudan Red Ⅰ:-16.5%;Sudan Red Ⅱ:-15.8%;Sudan Red Ⅲ:-25.2%;Sudan Red Ⅳ:-22.8%),这表明SPE可有效降低样品中苏丹红系列目标物测定的基质效应。为减少基质效应对苏丹红染料定量结果的影响,本方法采用同位素内标法定量。由于市面上很难获得每种化合物所对应的同位素内标,根据各化合物的色谱保留时间及其结构的相似性,苏丹红Ⅰ、Ⅱ采用SudanⅠ-D5,苏丹红Ⅲ、Ⅳ采用Sudan Ⅳ-D6分别作为内标进行定量。
2.5 苏丹红光学异构现象的解决

图3 不同浓度氨水-乙腈溶液定容时第一色谱峰 的面积百分比(A1/A)
研究中发现在4种苏丹红染料的MRM色谱图中,苏丹红Ⅲ和Ⅳ在不同的保留时间分别出现两个色谱峰。Mölder等[15]的研究表明,由于苏丹红染料分子结构中含有氮氮双键,在光照条件下会发生顺反互变异构,从而产生两个色谱峰。在测定4种苏丹红染料的残留时,由于顺反异构现象从而会导致苏丹红染料定量不准确[16]。文献[17]采用黑暗放置12 h较好的避免了这种现象,但操作时间过长。为解决此问题,本实验研究了溶剂酸碱性对苏丹红Ⅲ,Ⅳ顺反异构的影响,分别采用3种不同浓度的溶剂(甲酸-乙腈、乙腈-水、氨水-乙腈)定容,研究发现当采用浓度不小于1%的氨水-乙腈定容时,第一色谱峰(其面积用A1表示)会瞬间消失(见图3),两色谱峰的面积总和(A)基本保持不变,说明第一色谱峰转化为第二色谱峰,该方法快速、高效地避免了偶氮染料定量分析过程中产生的顺反异构现象。苏丹红是一类萘酚偶氮染料,具有共轭平面性质,由于分子中酚羟基的存在使其易电离出H+,因此苏丹红所处溶液的酸碱性直接影响其分子的存在型体,使其在碱性溶液中主要以离子型体存在,氨水的加入会催化异构化,加快顺反异构的转变,致使第一色谱峰瞬间消失。
2.6 线性范围与检出限
采用SPE小柱净化后的空白样品溶液配制质量浓度分别0,0.5,1.0,2.0,5.0,10,20 μg/L的苏丹红系列混合标准溶液,按“1.4”方法进行测定。以苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的峰面积(y)对相应浓度(x,μg/L)作线性回归分析。结果表明,在0.5~20 μg/L浓度范围内,苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ均呈良好的线性关系,相关系数(r)均大于0.999。采用空白样品添加低浓度的4种标准品,按实验方法进行前处理后,上机测定,以3倍信噪比(S/N)计算检出限(LOD),10倍信噪比(S/N)计算定量下限(LOQ),得到鸡蛋、皮蛋、咸蛋组织中苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的检出限为0.26~0.35 μg/kg,定量下限为0.9~1.2 μg/kg(见表2)。
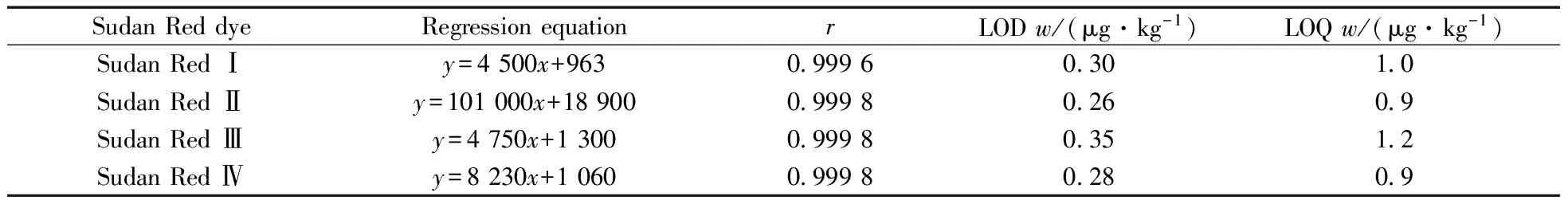
表2 苏丹红Ⅰ~Ⅳ的线性方程、相关系数(r)、检出限(LOD)及定量下限(LOQ)
2.7 回收率与精密度
选取空白的鸡蛋、皮蛋、咸蛋作为加标回收实验的基质,分别进行1.0,5.0,10.0 μg/kg 3个不同水平的加标回收实验,每个水平做6组平行实验,结果如表3所示。在不同加标浓度下,苏丹红Ⅰ~Ⅳ的回收率为80.0%~104.2%,方法的相对标准偏差(RSD)为4.2%~10.9%;采用日内进样10次的方法考察重复性的精密度,并以每个加标浓度水平日间平行测定6次考察重现性的精密度,实验结果显示,相对标准偏差小于11%,表明方法具有较好的回收率及稳定性。空白鸡蛋加标样品的色谱图见图4,可看出各化合物的峰形良好,且目标物出峰处无杂峰干扰。
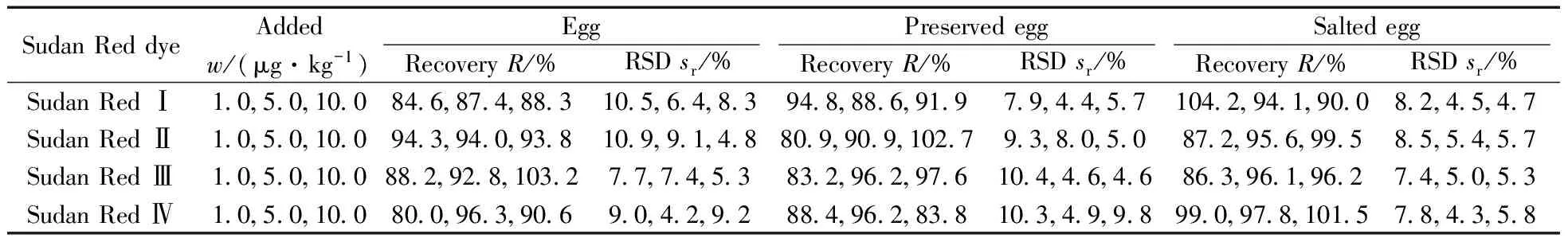
表3 蛋品中苏丹红的加标回收率与相对标准偏差(n=6)
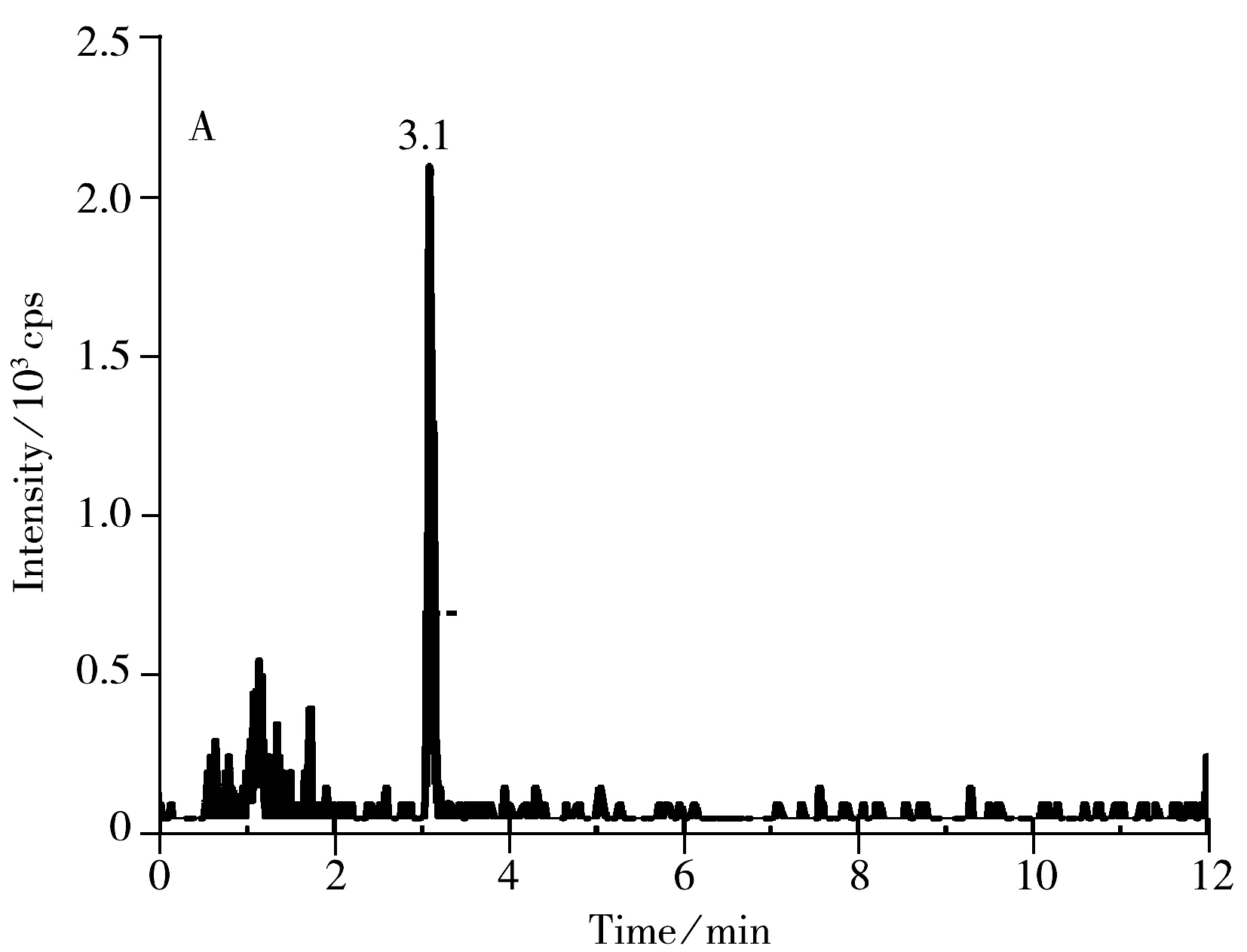
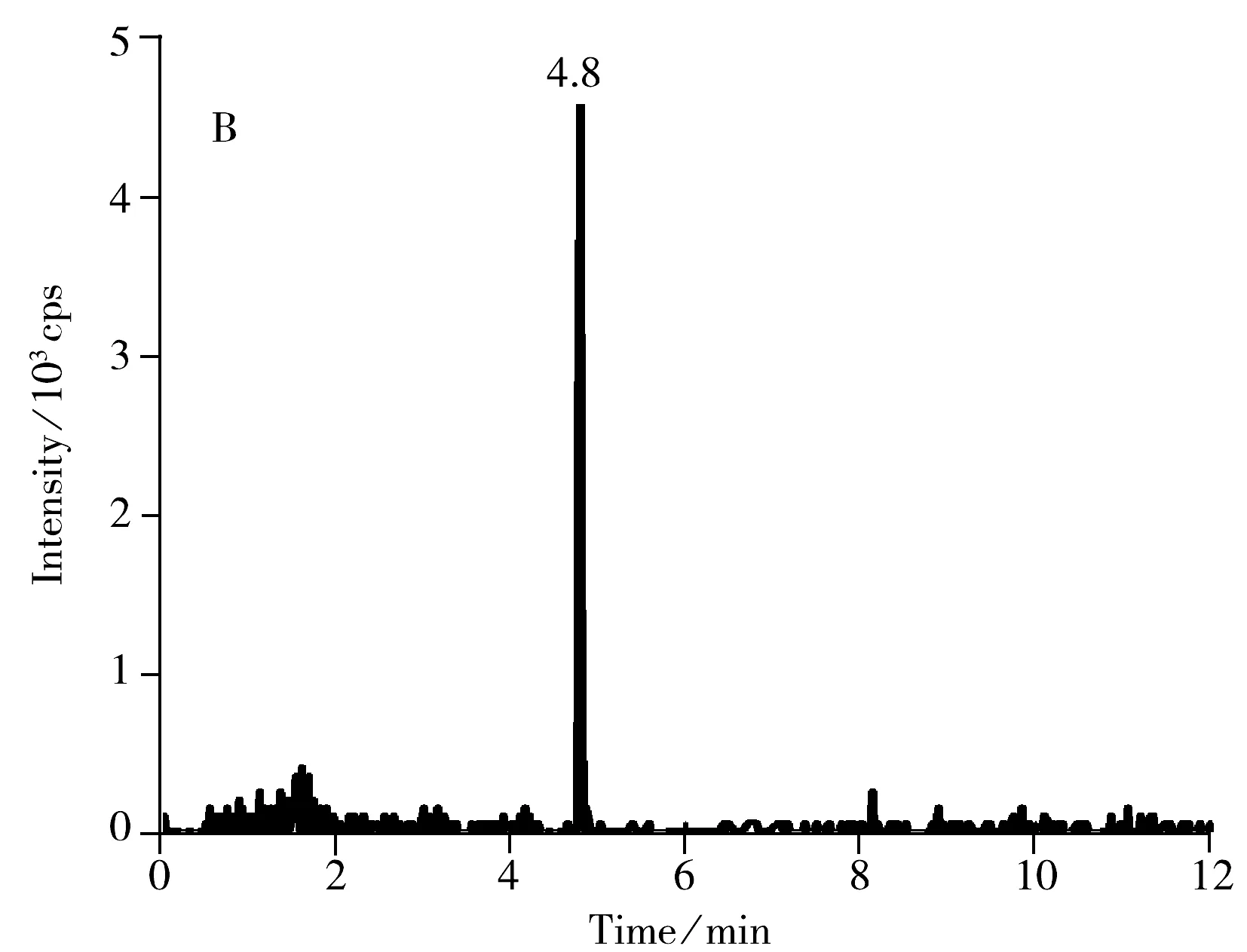
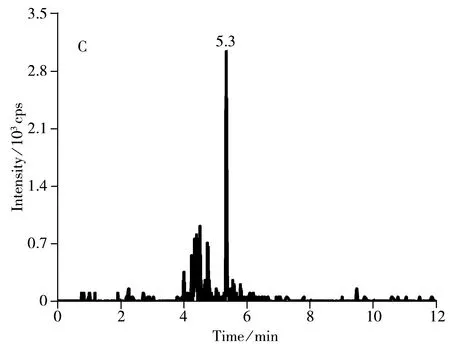
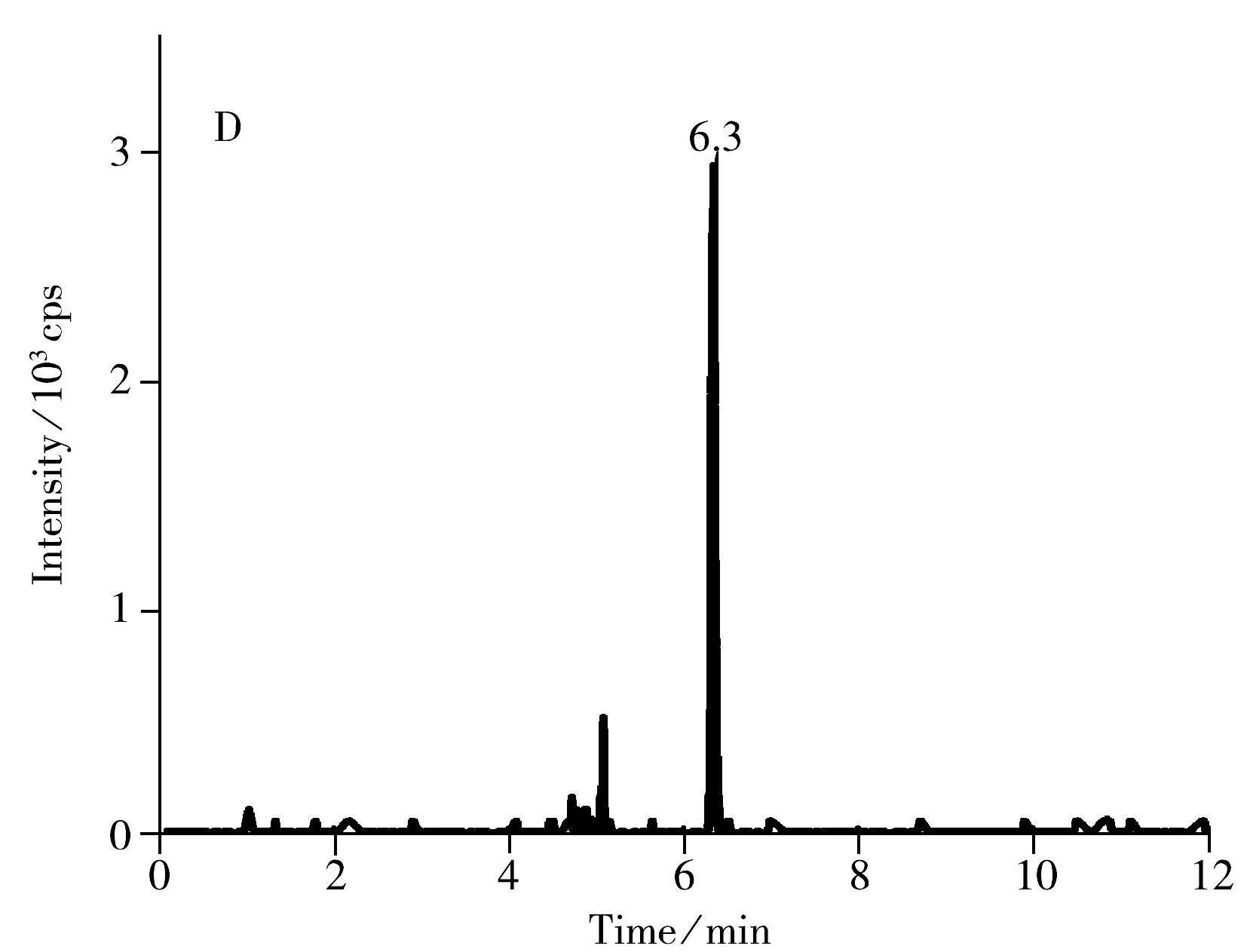
图4 鸡蛋中添加1.0 μg/kg 4种苏丹红药物的MRM离子流色谱图
2.8 实际样品的检测
按“1.3 ”方法进行苏丹红动物残留代谢的模拟实验,给鸡喂饲含有苏丹红染料的饭团,苏丹红Ⅰ和苏丹红Ⅱ按4 mg/kg体重/次给药,苏丹红Ⅲ和苏丹红Ⅳ按2 mg/kg体重/次给药,连续喂药5 d。取停药后5 d收集到的鸡蛋样品,去壳后混匀全蛋液,按“1.5”方法处理后检测其残留量,得到阳性鸡蛋样品中苏丹Ⅰ,Ⅱ,Ⅲ和Ⅳ的平均含量分别为2.9,18.6,135,408 μg/kg。
3 结 论
针对蛋白和油脂含量较高的禽蛋及其制品,本方法采用酸性氧化铝和苏丹红专用柱进行有效净化,建立了一套采用固相萃取净化,结合超快速液相色谱-串联质谱测定其中苏丹红染料的分析方法。该方法操作简便,准确度和灵敏度高,适用于禽蛋及其制品中痕量苏丹红染料的残留检测。
[1] Wei M,Hou J,Li P.MedicalRecapitulate(魏明,侯进,李萍.医学综述),2012,18(21):3619-3621.
[2] Jin X D.Sci.Technol.Res.(金宪丹.科技研究),2013,(10):179-180.
[3] Qi Y H,Shan W C,Liu Y Z,Zhang Y J,Wang J P.J.Agric.FoodChem.,2012,60(9):2116-2122.
[4] He L M,Su Y J,Fang B H,Shen X G,Zeng Z L,Liu Y H.Anal.Chim.Acta,2007,594(1):139-146.
[5] Erdemir U S,Izgi B,Gucer S.Anal.Methods,2013,5(7):1790-1798.
[6] Huang X L,Wu H Q,Huang F,Lin X S,Deng X.J.Instrum.Anal.(黄晓兰,吴惠勤,黄芳,林晓珊,邓欣.分析测试学报),2005,24(4):1-5.
[7] Zhu H,Li X P,Zou B B,Chen X H,Chen T Y,Jin M C.J.Instrum.Anal.(朱浩,李小平,邹宝波,陈晓红,陈泰宇,金米聪.分析测试学报),2013,32(11):1379-1383.
[8] Piao C Y,Chen L G.J.Chromatogr.A,2012,1268:185-190.
[9] Chen D M,Li X Q,Tao Y F,Pan Y H,Wu Q H,Liu Z L,Peng D P,Wang X,Huang L L,Wang Y L,Yuan Z H.J.Chromatogr.B,2013,939(15):45-50.
[10] Gao H,Yang M L,Wang M L,Zhao Y S,Gao Y,Chu X G.J.AOACInt.,2013,96(1):110-115.
[11] Schummer C,Sassel J,Bonenberger P,Moris G.J.Agric.FoodChem.,2013,61(9):2284-2289.
[12] Qian X Y,Liu H S,Zhu X Y,Chen X M,Mo W M.J.Instrum.Anal.(钱晓燕,刘海山,朱晓雨,陈笑梅,莫卫民.分析测试学报),2014,33(5):527-532.
[13] Gou H,Linghu Y,Luo S X,Wu Y H.JiangsuAgric.Sci.(勾华,令狐燕,罗宿星,伍远辉.江苏农业科学),2012,40(11):315-317.
[14] Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal.Chem.,2003,75(13):3019-3030.
[15] Mölder K,Künnapas A,Herodes K,Leito I.J.Chromatogr.A,2007,1160(1/2):227-234.
[16] Zacharis C K,Kika F S,Tzanavaras P D,Rigas P,Kyranas E R.Talanta,2011,84(2):480-486.
[17] Zhu H,Huang K Y,Fu J F,Hu Y,Huang X N,Chen X H,Zou B B,Jin M C.Chin.J.Chromatogr.(朱浩,黄坤玉,付建飞,胡岳,黄娴妮,陈晓红,邹宝波,金米聪.色谱),2014,32(3):224-229.
Simultaneous Determination of Four Sudan Red Dyes Residues in Poultry Eggs by Solid-phase Extraction Combined with Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
LIU Zheng-cai1*,YANG Fang1,YIN Tai-kun2,QIAN Jiang1
(1.Fujian Entry-Exit Inspection & Quarantine Bureau,Fujian Provincial Key Laboratory of Inspection and Quarantine Technology Research,Fuzhou 350001,China;2.School of Chemical Engineering,Fuzhou University,Fuzhou 350108,China)
A solid-phase extraction combined with ultra performance liquid chromatography-tandem mass spectrometric method was established for the simultaneous determination of Sudan Red dyes(Sudan RedⅠ,Ⅱ,Ⅲ and Ⅳ) in poultry eggs and its products.The samples were ultrasonically extracted withn-hexane,and then the supernatant was purified with tonyred dedicated SPE column.The chromatographic separation was performed on a Waters CORTECSTMUPLC® C18(2.1 mm×100 mm,1.7 μm) by gradient elution with 5 mmol/L ammonium acetate solution containing 0.2% formic acid and acetonitrile as mobile phase.The electrospray ionization(ESI) source in the positive mode and multiple-reaction monitoring(MRM) mode were used for the quantitative analysis by the internal standard.The results showed that the calibration curves for four Sudan Red dyes were in good linearities in the range of 0.5-20 μg/L with correlation coefficients more than 0.999.The average recoveries ranged from 80.0% to 104.2% with relative standard deviations(RSDs) of 4.2%-10.9% in low,medium and high standard addition levels.The limits of detection(LODs) and the limits of quantitation(LOQs) of this method were in the ranges of 0.26-0.35 μg/kg and 0.9-1.2 μg/kg for four analytes,respectively.The method was simple,accurate,rapid and sensitive,and could be used for the analysis of Sudan Red dyes in poultry eggs and egg products.
ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);solid phase extraction;Sudan Red dyes;poultry egg
2014-09-16;
2014-10-20
福建检验检疫局科技计划项目(FK2010-23);质检公益项目(201310143-02);福建省科技重点项目(2012Y6001)
10.3969/j.issn.1004-4957.2015.02.008
O657.63;F767.4
A
1004-4957(2015)02-0171-06
*通讯作者:刘正才,硕士,高级工程师,研究方向:农兽药残留分析,Tel:0591-87065542,E-mail:zhengcailiu@163.com
