基于QuEChERS提取的液相色谱-串联质谱法测定干腌火腿中15种真菌毒素
2015-04-27郭礼强宫小明丁葵英
郭礼强,宫小明,丁葵英,王 可,孙 军,赵 晗
(1.潍坊出入境检验检疫局,山东 潍坊 261041;2.石家庄市疾病预防控制中心,河北 石家庄 050011)
基于QuEChERS提取的液相色谱-串联质谱法测定干腌火腿中15种真菌毒素
郭礼强1*,宫小明1,丁葵英1,王 可2,孙 军1,赵 晗1
(1.潍坊出入境检验检疫局,山东 潍坊 261041;2.石家庄市疾病预防控制中心,河北 石家庄 050011)
建立了干腌火腿中15种真菌毒素(黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、赭曲霉毒素A、橘青霉素、T-2毒素、HT-2毒素、蛇形菌素、新茄镰孢菌醇、疣孢青霉原、O-甲基杂色曲霉素、杂色曲霉素、环匹阿尼酸、青霉酸)多残留的液相色谱-线性离子阱质谱(QTrap LC-MS/MS)检测方法。火腿样品经含1%甲酸的乙腈水溶液提取,QuEChERS方法净化后,以含0.1%甲酸和9.9%乙腈的5 mmol/L乙酸铵水溶液(A)与含0.1%甲酸的乙腈(B)为流动相,经Eclipse Plus C18色谱柱(3.0 mm×100 mm,1.8 μm)分离,以多级反应监测(MRM),通过信息相关扫描方式(IDA)触发增强子离子扫描(EPI),结合建立的15种真菌毒素的标准谱图库检索的多模式进行分析。结果表明,15种真菌毒素在0.05~200 μg/L范围呈良好线性,相关系数均大于0.993,定量下限为0.05~2.5 μg/kg。样品在1倍、2倍、10倍定量下限3个加标水平下的平均回收率为79.1%~95.5%,相对标准偏差(RSD)为3.2%~12.8%。该方法灵敏、简便、准确,可用于干腌肉类中真菌毒素的检测分析。
干腌火腿;真菌毒素;液相色谱-串联质谱;分散固相萃取;QuEChERS

目前,多种真菌毒素同时检测的方法主要有液相色谱法[7-11]和液相色谱-串联质谱法[12-19](LC-MS/MS)。液相色谱法是常用的检测方法,但其选择性较差,多种毒素同时检测受到限制,灵敏度也达不到要求。LC-MS/MS方法的选择性好,操作简单,省时,尤其是线性离子阱质量分析器,能够在保证灵敏度的情况下达到定性化合物的目的。QTrap的优势是既能得到化合物MRM的信息,也可以设定MRM域值(IDA设定),通过EPI扫描得到化合物二级质谱碎片的全部信息,再结合谱库检索能实现对未知化合物的同时定性定量。本研究选择易污染干腌火腿的常见产毒真菌代谢物为研究对象,建立了15种真菌毒素的LC-MS/MS谱库,并采用QuEChERS前处理提取方法,结合谱库检索建立了干腌火腿中15种真菌毒素的快速LC-MS/MS测定方法。该方法简便快速,可操作性强,只需一步提取浓缩即可同时定性定量分析干腌火腿中的多种真菌毒素,对企业及食品安全监管部门提供了有效的技术支撑。
1 实验部分
1.1 仪器与试剂
高效液相色谱-线性离子阱质谱联用仪:AB eksigent ultra LC 100-XL/Qtrap 5500(美国AB公司),配电喷雾离子源(ESI);5810R型离心机(Eppendorf公司);N-EVAP氮吹仪(Organomation Associates公司);Milli-Q纯水机(美国Millipore公司);KQ-500型超声波清洗器(昆山市超声仪器有限公司)。
黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、赭曲霉毒素A(OTA)、橘青霉素(Citrinin)、T-2毒素(T-2)、HT-2毒素(HT-2)、蛇形菌素(DSA)、新茄镰孢菌醇(NEO)、疣孢青霉原(Verruculogen)均购于Biopure公司。O-甲基杂色曲霉素(MST)、杂色曲霉素(ST)、环匹阿尼酸(CPA)、青霉酸(Penicillic acid)购于Sigma公司。中性氧化铝(Alumina-N)购于上海五四化学试剂有限公司,石墨炭黑粉(GCB)、C18(ODS)、PSA粉和氨丙基粉(NH2)购于Agela technologies inc公司;甲醇、乙酸乙酯、乙腈和甲酸均为色谱纯,购于美国Biopure公司;实验用水为超纯水。
用乙腈配制真菌毒素标准储备液(质量浓度100 mg/L) 各50 mL,存储期6个月;然后用乙腈配制浓度分别为100 μg/L 的标准品中间液,再根据需要用干腌火腿提取液稀释成适当浓度的混合标准工作液,于4 ℃保存,有效期3个月。
1.2 色谱条件
色谱柱:Eclipse Plus C18(3.0 mm×100 mm,1.8 μm);柱温:40 ℃;流动相A:水-乙腈-甲酸(900∶99∶1)+5 mmol/L乙酸铵;流动相B:乙腈-甲酸(999∶1);梯度洗脱程序:0~3.0 min,5%~50% B;3.0~5.0 min,50%~90% B;5.0~8.0 min,90% B;8.0~8.1 min,90%~5% B;8.1~12 min,5% B;流速:0.4 mL/min;进样体积:10 μL。
1.3 质谱条件
MRM扫描模式,电离源:ESI+;气帘气流量:35 L/min;离子电压:5 500 V;碰撞气:氮气;干燥气温度:550 ℃;GS1:55 L/min,GS2:55 L/min;Q1分辨率为low,Q3分辨率为unit;15种真菌毒素的部分质谱参数见表1。当MRM信号域值大于IDA设定的5 000 cps时同时启动EPI功能。EPI扫描范围:80~750 Da;扫描速率:10 000 Da/s;离子源碰撞气流速为high;建库时碰撞能量(Collision energy,CE)为35,化合物子离子的碰撞能量(Collision energy spread,CES)设为15。

表1 15种真菌毒素的部分质谱参数
*quantitative ion
1.4 谱库建立
对15种真菌毒素的混合标准品进行EPI扫描,CES为15 V,在20,35,50 V 3种碰撞能量下各采集1张EPI谱图,平均后得到1张综合EPI谱图,将各真菌毒素的EPI谱图输入数据库,同时填写分子式、相对分子量及化学名称等。
1.5 样品处理
准确称取(4±0.01) g绞碎均匀的干腌火腿样品,置于50 mL具塞离心管内,加入20 mL乙腈-水-甲酸(79∶20∶1,下同)溶液均质30 s,超声辅助萃取90 min,以10 000 r/min离心10 min,转移上清液10 mL至20 mL干净玻璃试管中,加入700 mg ODS涡旋振荡2 min,静置分层后,取5 mL上清液于干净10 mL玻璃试管中氮气吹干,用1 mL含0.1%甲酸的5%乙腈水溶液溶解,于涡旋振荡器振荡1 min,经0.22 μm双系滤膜过滤,供QTrap LC-MS/MS分析测定。
2 结果与讨论
2.1 样品提取条件的选择
提取溶剂对回收率的影响很大,常用的提取溶剂主要有甲醇-水[7-8,11,14]和乙腈-水[13,15-16,18-20]。比较了两种提取液对15种真菌毒素回收率的影响,结果表明使用乙腈-水作为提取液时15种真菌毒素的回收率在50%~80%之间,各种毒素均比甲醇-水作为提取液的回收率提高了6%以上。进一步考察了提取液pH值对回收率的影响。实验发现真菌毒素OTA和DSA在碱性和中性水溶液环境下不稳定,空白基质的加标回收率仅能达到50%左右,在提取溶液中加入1%甲酸后回收率可提高到80%以上。干腌火腿基质复杂,而常用的免疫亲和柱及多功能净化柱受真菌毒素化学性质的限制,不能同时净化多种真菌毒素,并且净化成本很高。本文使用QuEChERS方法[21-22],同时考察了Alumina-N,GCB,ODS,PSA,NH25种净化粉对15种真菌毒素的吸附回收率,通过标准品加净化粉经质谱检测并计算回收率,结果发现ODS对15种真菌毒素的吸附影响较小,回收率为93.5%~117.8%。而文献报道中常与ODS联合使用的PSA和NH2由于对OTA,CPA和Penicillic acid的吸附非常严重而不能使用,结果见表2。
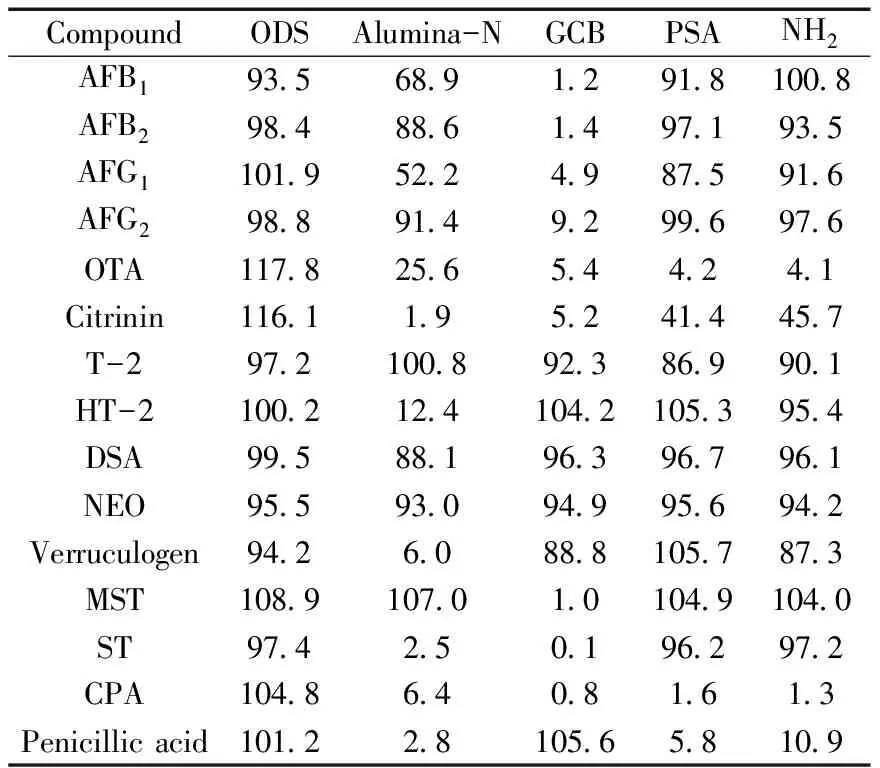
表2 经ODS,Alumina-N,GCB,PSA,NH2吸附后15种真菌毒素的回收率
2.2 色谱条件的优化
由于待测15种真菌毒素的质荷比在171~534之间,化学性质相差较大,要达到良好分离比较困难,尤其是4种黄曲霉毒素(AFB1,AFB2,AFG1,AFG2)结构类似,且有相近或相同的碎片离子,出峰时间不合适易造成EPI谱图干扰,影响谱库检索时对真菌毒素定性的判断。实验发现流动相为甲醇-水(各含0.1%甲酸,下同)时,疣孢青霉原和青霉酸的峰形不好,分离度达不到要求。参考已有文献[15],调整流动相为乙腈-水,经反复试验确定了“1.2”所述流动相比例以及梯度洗脱方法,应用该方法时基线平稳,各组分能完全分离,真菌毒素的EPI谱图无干扰且响应值高。
2.3 质谱条件的优化
将100 μg/L的15种毒素标准品溶液通过自动进样泵以7 μL/min直接注入ESI离子源,在找到真菌毒素各自的准分子离子峰[M+H]+或[M+NH4]+后,分别优化其质谱参数,得到碎片离子信息,优化的MRM质谱参数见表1。化合物的EPI扫描谱图和MS2扫描谱图类似,可在优化真菌毒素质谱参数时同时建立其数据库谱图,也可在MRM扫描检测时建立。为了达到同时定性、定量的目的,本研究采用MRM→IDA→EPI→数据库检索的模式。以MRM触发EPI,可以同时获得化合物的保留时间、峰面积以及全面的二级结构信息等,由于EPI扫描比MRM扫描响应值高100倍以上,从而提高了方法的灵敏度,并可通过EPI谱库检测和二级结构信息快速确认化合物结构。上述质谱条件下15种真菌毒素混合标准溶液(10 μg/L)的总离子流色谱图、EPI谱图以及MRM见图1。

图1 15种真菌毒素混合标准溶液的总离子流色谱图、EPI谱图和MRM图
2.4 线性关系、检出限与定量下限
对15种真菌毒素质量浓度在0.05~200 μg/L之间的系列混合标准溶液(用空白火腿提取液配制)进行测定,以各化合物峰面积的平均值(Y)对其质量浓度(X,μg/L)绘制标准曲线,其相关系数(r)均大于0.993。在干腌火腿基质中添加系列浓度的混合标准物质,以3倍信噪比(S/N=3)计算方法的检出限(LOD),以10倍信噪比(S/N=10)计算方法的定量下限(LOQ),结果得15种真菌毒素的LOD为0.02~0.8 μg/kg,LOQ为0.05~2.5 μg/kg。15种真菌毒素的线性方程、相关系数、线性范围、检出限和定量下限见表3。

表3 15种真菌毒素的线性方程、相关系数、线性范围、检出限与定量下限(n=6)
2.5 准确度与精密度
在干腌火腿空白样品中添加15种真菌毒素1倍、2倍、10倍定量下限3个水平的混合标准物质进行加标回收实验。以回收率结果表示方法准确度,回收率的相对标准偏差(RSD)表示方法的精密度,每个水平平行测定6个样品,测定结果见表4。结果显示,15种真菌毒素在3个加标水平下的平均回收率为79.1%~95.5%,RSD为3.2%~12.8%。

表4 15种真菌毒素在空白样品中的平均回收率及相对标准偏差(n=6)
2.6 实际样品的测定
对超市购买的15份干腌火腿中的真菌毒素含量进行测定,结果在1份火腿样品中检出CPA,通过EPI谱库检索,样品中CPA离子匹配度为70.2(匹配度值从0到100,大于60为可信),检测含量为1.07 μg/kg(n=3),其EPI比对结果见图2。


图2 干腌火腿中阳性样品EPI谱库检索结果
3 结 论
本文建立了一种基于QuEChERS原理的前处理技术,结合超高效液相色谱-线性离子阱质谱快速测定干腌火腿中15种真菌毒素残留的方法,通过MRM扫描和EPI谱库检索,能够实现对15种真菌毒素的同时定性、定量分析。该方法具有简便、快速、灵敏、准确、实用性强等优点,可以满足对干腌火腿中真菌毒素残留的检测要求。
[1] Binder E M.Anim.FeedSci.Technol.,2007,133(1/2):149-166.
[2] Bryden W L.Anim.FeedSci.Technol.,2012,173(1/2):134-158.
[3] Berthiller F,Sulyok M,Krska R,Schuhmacher R.Int.J.FoodMicrobiol.,2007,119(1/2):33-37.
[4] Rojas F J,Jodral M,Gosalves F,Pozo R.Int.J.FoodMicrobiol.,1991,13(4):249-255.
[5] Núňez F,Rodríguez M M,Bermúdez M E,Cordoba J J,Asensio M A.Int.J.FoodMicrobiol.,1996,32(1/2):185-197.
[6] Bailly J D,Tabuc C,Quérin A,Guerre P.J.FoodProtect.,2005,68(7):1516-1520.
[7] Tassaneeyakul W,Razzazi-Fazeli E,Porasuphatana S,Bohm J.Mycopathologia,2004,158(2):239-244.
[8] Thirumala-Devi K,Mayo M A,Reddy G,Tangni E K,Larondelle Y,Reddy D V,Emmanuel K E.FoodAddit.Contam.,2001,18(9):830-835.
[9] Sewram V,Shephard G S,van der Merwe L,Jacobs T V.J.Agric.FoodChem.,2006,54(15):5688-5693.
[10] Trucksess M W,Scott P M.FoodAddit.Contam.,2008,25(2):181-192.
[11] Zheng R,Mao D,Wang S M,Wang K,Ji S.Chin.J.Pharm.(郑荣,毛丹,王少敏,王柯,季申.中国医药工业杂志),2010,41(5):368-372.
[12] Lau B P,Scott P M,Lewis D A,Kanhere S R.J.MassSpectrom.,2000,35(1):23-32.
[13] Gong X M,Wang H B,Zhang Y B,Sun J,Dong J,Lin L M,Yu J L,Feng Z,Li K.J.Chromatogr.Sep.Tech.,2012,3(2):125-132.
[14] Moldes-Anaya A S,Asp T N,Eriksena G S,Skaar I,Rundberget T.J.Chromatogr.A,2009,1216(18):3812-3818.
[15] Varga E,Glauner T,Berthiller F,Krska R,Schuhmacher R,Sulyok M.Anal.Bioanal.Chem.,2013,405:5087-5104.
[16] Spanjer M C,Rensen P M,Scholten J M.FoodAddit.Contam.,2008,25(4):472-489.
[17] Streit E,Schwab C,Sulyok M,Naehrer K,Krska R,Schatzmayr G.Toxins,2013,5:504-523.
[18] Storm M L D,Rasmussen R R,Rasmussen P H.Toxins,2014,6:2256-2269.
[19] Warth B,Parich A,Atehnkeng J,Bandyopadhyay R,Schuhmacher R,Sulyok M,Krska R.J.Agric.FoodChem.,2012,60:9352-9363.
[20] Meng J,Zhang J,Zhang N,Shi J C,Shao B.Chin.J.Chromatogr.(孟娟,张晶,张楠,施嘉琛,邵兵.色谱),2010,28(6):601-607.
[21] Wang L Z,Huang X Y,Chen Y,Lin Z X,Wang G F,Zhou Y.J.Instrum.Anal.(王连珠,黄小燕,陈泳,林子旭,王根芳,周昱.分析测试学报),2014,33(10):1102-1108.
[22] Li J,Zhang H,Chai Z F,Shen J C,Yang B.J.Instrum.Anal.(李静,张鸿,柴之芳,沈金灿,杨波.分析测试学报),2014,33(10):1109-1115.
Determination of 15 Mycotoxins in Dry-cured Hams with QuEChERS-based Extraction and Liquid Chromatography-Tandem Mass Spectrometry
GUO Li-qiang1*,GONG Xiao-ming1,DING Kui-ying1,WANG Ke2,SUN Jun1,ZHAO Han1
(1.Weifang Entry-Exit Inspection and Quarantine Bureau,Weifang 261041,China;2.Shijiazhuang Center for Disease Control and Prevention,Shijiazhuang 050011,China)
A method was developed for the simultaneous determination and identification of 15 mycotoxin residues in dry-cured hams,including aflatoxin B1,aflatoxin B2,aflatoxin G1,aflatoxin G2,ochratoxin A,citrinin,T-2 toxin,HT-2 toxin,diacetoxyscirpenol,neosolaniol,verruculogen,O-methyl sterigmatocystin,sterigmatocystin,cyclopiazonic acid and penicillic acid,by liquid chromatography-tandem triple-quadrupole linear ion trap mass spectrometry(LC-MS/MS).The dry-cured ham samples were purified by QuEChERS method after extraction with acetonitrile solution containing 1% formic acid,then separated on an Eclipse Plus C18column(3.0 mm×100 mm,1.8 μm) by gradient elution with mobile phases of 5 mmol/L ammonium acetate aqueous solution(containing 0.1% formic acid and 9.9% acetonitrile,A) and acetonitrile(containing 0.1% formic acid,B).A multiple reaction monitoring(MRM) as survey scan and an enhanced product ion(EPI) scan as dependent scan were performed in an information dependent acquisition(IDA) experiment.The identification of compounds was carried out by library search with a newly developed MS/MS library based on EPI spectra in positive mode.The results showed that the calibration curves were linear in the range of 0.05-200 μg/L for 15 mycotoxins with correlation coefficients(r) more than 0.993.The limits of quantitation(LOQs,S/N=10) were in the range of 0.05-2.5 μg/kg.The average recoveries(n=6) of 15 mycotoxins in dry-cured ham samples at three spiked levels(1 times,2 times,10 times of LOQ) ranged from 79.1% to 95.5% with relative standard deviations(RSDs) of 3.2%-12.8%.The method was sensitive,convenient and accurate,and could satisfy the demand for detection of mycotoxin residues in contaminated dry-cured meat.
dry-cured ham; mycotoxins; liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);dispersive solid phase extraction;QuEChERS
2014-10-22;
2014-11-10
国家质检总局科研基金项目(2013IK177);潍坊市科学技术发展计划(2014RKX094)
10.3969/j.issn.1004-4957.2015.02.003
O657.63;S852.44
A
1004-4957(2015)02-0141-06
*通讯作者:郭礼强,硕士,工程师,研究方向:食品中真菌毒素检测,Tel:0536-8862561,E-mail:glq1980@sina.com
